Hyaluronsäure
Hyaluronsäure (nach neuerer Nomenklatur Hyaluronan, Abkürzung HA) ist ein Glycosaminoglycan, das einen wichtigen Bestandteil des Bindegewebes darstellt und auch eine Rolle bei der Zellproliferation, Zellmigration und Metastasenbildung bei einigen Krebserkrankungen[2] spielt.[3] Die Hyaluronsäure wurde erstmals in den 1930er Jahren von dem deutschen Mediziner Karl Meyer entdeckt. Der Begriff Hyaluronsäure setzt sich zusammen aus dem altgriechischen Wort ὕαλος hyalos, deutsch ‚Glas‘ und Uron, einer Abkürzung der Uronsäuren. Meyer hatte den Stoff bei Untersuchungen des Glaskörpers entdeckt.
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
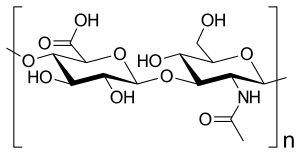 Disaccharid-Wiederholungseinheit der Hyaluronsäure (-4GlcUAβ1-3GlcNAcβ1-)n | |||||||||
| Allgemeines | |||||||||
| Name | Hyaluronsäure | ||||||||
| Andere Namen |
| ||||||||
| CAS-Nummer | |||||||||
| Monomere | D-Glucuronsäure und N-Acetyl-D-glucosamin | ||||||||
| Summenformel der Wiederholeinheit | C14H21O11N | ||||||||
| Molare Masse der Wiederholeinheit | 379,32 g·mol−1 | ||||||||
| ATC-Code | |||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse |
Filmbildner | ||||||||
| Eigenschaften | |||||||||
| Aggregatzustand |
fest | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Funktionen
Hyaluronsäure ist ein Bestandteil der extrazellulären Matrix (EZM oder ECM) von Wirbeltieren. Sie liegt in vielerlei Geweben als langkettiges, lineares Polysaccharid vor und erfüllt viele Funktionen, die auch auf ihren besonderen chemischen Eigenschaften beruhen, etwa der Eigenschaft, sehr viel Wasser zu binden. Nicht selten erreichen die einzelnen Ketten eine molare Masse von mehreren Millionen atomaren Masseneinheiten.
Wasserspeicherung
Die Hyaluronsäure besitzt die Fähigkeit, relativ zu ihrer Masse sehr große Mengen an Wasser zu binden (bis zu sechs Liter Wasser pro Gramm). Der Glaskörper des menschlichen Auges z. B. besteht zu 98 Prozent aus Wasser, das an nur zwei Prozent Hyaluronsäure gebunden ist.
Druckbeständigkeit
Wasser ist kaum komprimierbar, und diese Eigenschaft bleibt auch in hyaluronsäurehaltigem Gewebe gültig, in dem sehr viel Wasser gebunden werden kann. Dies gilt allgemein für große Teile des Bindegewebes. Eine besondere Bedeutung hat diese Tatsache während der Embryonalentwicklung, wenn feste Strukturen noch nicht entwickelt sind. Ein weiteres bekanntes Beispiel ist der Nucleus pulposus, der Gallertkern der Bandscheiben, der deshalb große Teile des Körpergewichts tragen kann.
Schmiermittel
Die Hyaluronsäure ist Hauptbestandteil der Synovia (Gelenkflüssigkeit) und wirkt als Schmiermittel bei allen Gelenkbewegungen. Sie zeichnet sich hier zusätzlich durch strukturviskose Eigenschaften aus; ihre Viskosität verändert sich mit einwirkenden mechanischen Kräften, genauer: Sie nimmt ab, je stärker die Scherkräfte werden. Zudem ist sie zwar flüssig, aber durch ihre hochmolekulare Gestalt so viskos, dass sie nicht wie Wasser aus dem Gelenk herausgepresst wird. Durch chemische Wechselwirkungen und die äußere Form „haftet“ sie besonders gut am Knorpel des Gelenks.
Wirken nun im Anfang einer Bewegung, zum Beispiel im Kniegelenk bei Absprung oder beim Stehen, starke Druckkräfte auf ein Gelenk, knäueln sich die Moleküle zu Kugeln zusammen und hängen wie in einem Kugellager an der Knorpeloberfläche. Wenn aber eine schnelle Scherbewegung nötig ist, so zum Beispiel beim Lauf, wird die Zähigkeit der Hyaluronsäure wegen ihrer Strukturviskosität herabgesetzt und die Reibung verringert.
Freihalten von Wegen
Für wandernde Zellen hält die Hyaluronsäure die „Verkehrswege“ frei. Durch Erweiterung der Zellzwischenräume (Abstände zwischen den Zellen) wird die Migration (Wanderung) der Zellen unterstützt.
Biochemische Funktion
Während sich die bisher genannten Funktionen auf frei vorliegende Hyaluronsäure beziehen, ist sie auch an der Bildung weiterer, noch größerer Riesenmoleküle beteiligt, den Proteoglycanen. Insbesondere verknüpft sie bestimmte Proteoglycane (Aggrecan im hyalinen Knorpel) zu riesigen Proteoglycan-Aggregaten.
Funktion im Gehirn
Neben wichtiger Strukturfunktion im Gehirn konnte gezeigt werden, dass Hyaluronan den Wiederaufbau von Markscheiden um Axone (Remyelinisierung) beeinflussen kann. Eine weitere inhibitorische Funktion scheint vor allem bei der Multiplen Sklerose eine Rolle zu spielen.[4]
Interaktion mit Rezeptoren
Eine Reihe von Zelloberflächenrezeptoren interagieren mit Hyaluronsäure und lösen bestimmte Reaktionen der Zelle aus, vor allem die Zellteilung und die Wanderung. In der Embryonalentwicklung sind diese Stimulationen notwendig, bei Kontakt mit Tumorzellen können sie allerdings auch entsprechend für den Organismus nachteilige Auswirkungen haben.
Antikarzinogene Wirkung bei Nacktmullen
Nacktmulle werden bis zu 30 Jahre alt und entwickeln praktisch keine Tumore. Langkettige Hyaluronsäure ist als Ursache erkannt worden. Es wird angenommen, dass die Tiere diese zur Pflege ihrer Haut bilden sowie dass die krebsverhindernde Eigenschaft ein Nebeneffekt sei. Die normale, kürzere Version der Hyaluronsäure wird am Menschen angewendet und ist gut verträglich. Die langkettige ist nicht erprobt.[5]
Chemischer Aufbau
Die Hyaluronsäure ist eine makromolekulare Kette aus Disacchariden, die wiederum aus je zwei Glucosederivaten bestehen: D-Glucuronsäure und N-Acetyl-D-glucosamin. Beide unterscheiden sich von der β-D-Glucose nur durch eine Substitution am sechsten beziehungsweise am zweiten Kohlenstoffatom. Im Disaccharid wird die Glucuronsäure glycosidisch β(1→3) an das N-Acetyl-D-glucosamin geknüpft, das wiederum mit der nächsten Glucuronsäure in der polymeren Kette glycosidisch β(1→4) verbunden ist. Eine Kette besteht typischerweise aus 250 bis 50.000 Disaccharideinheiten.
In neutraler wässriger Lösung bilden sich Wasserstoffbrückenbindungen hauptsächlich zwischen den Carboxyl- und den N-Acetylgruppen aus.
Biosynthese
Im Gegensatz zu allen anderen Glycosaminoglycanen wird die Hyaluronsäure nicht im endoplasmatischen Retikulum oder Golgi-Apparat zusammengesetzt, sondern von integralen Membranproteinen. Von diesen HA-Synthasen besitzen Wirbeltiere drei Typen: HAS1, HAS2 und HAS3. Diese Enzyme übertragen in der Zelle die wachsende Kette auf immer neue Monosaccharidbausteine, die so immer länger wird und durch ABC-Transporter durch die Membran aus der Zelle heraustransportiert wird. Dies gilt nicht für alle HA-Synthasen.[6][7]
Einsatz in der Humanmedizin
Medizinisch verwendet wird das Natrium-Salz der Hyaluronsäure (Natriumhyaluronat oder Sodium Hyaluronate). Hyaluronsäure wird aus tierischem Ausgangsmaterial (z. B. Hahnenkamm[8][9]) oder biotechnologisch aus Streptokokken-Kulturen gewonnen. Eine spezielle Modifikation stellen stabilisierte Hyaluronsäuren – beispielsweise mittels der sogenannten NASHA-Technologie (NASHA steht für „Nicht-animalische stabilisierte Hyaluronsäure“) – dar, die je nach Hersteller zwischen weniger als ein Prozent und bis zu ca. 20 bis 30 Prozent verändert werden. Für die Haltbarkeit der Produkte spielt der Prozentsatz der Stabilisierung keine große Rolle, wichtig ist die Art der Stabilisierung. Bei aus Hahnenkämmen gewonnenen Hyaluronsäureprodukten kann es zu allergischen Reaktionen kommen, wenn eine Allergie gegen Vogelproteine besteht.
Hyaluronsäurepräparate werden in arthrosegeschädigte Gelenke gespritzt, um das Gelenk zu schmieren und als „Stoßdämpfer“ zu wirken (sogenannte Viscosupplementation).[10][11] Die Halbwertszeit von Hyaluronsäure-Produkten ist abhängig von der molaren Masse und liegt zwischen 17 und 60 Stunden.[12] Derzeit verfügbare Hyaluronsäuren unterscheiden sich in der Anzahl der notwendigen Injektionen – je nach Produkt 1, 3 oder 5 Injektionen. Ein direkter Zusammenhang zwischen der Anzahl der Injektionen und der Wirksamkeit besteht dabei nicht, so können Produkte mit weniger Injektionen durchaus wirksamer sein als Produkte mit mehr Injektionen.[13] Sie wirken vergleichbar wie NSAR-Einnahme oder Cortison-Injektionen, jedoch war die Wirksamkeit in verschiedenen Studien unterschiedlich,[14] oft war die Nutzen-Schaden-Bilanz negativ.[15] Ein therapeutischer Stellenwert bei Arthrose ist nach dem Stand der Metaanalyse 2003/04 nicht belegt.[16] Dem widerspricht eine Studie über die Behandlung der Facettengelenksarthrose mit Hyaluronsäure aus dem Beobachtungszeitraum Oktober 2007 bis Juli 2009.[17][18] Die gesetzlichen Krankenkassen übernehmen die Behandlungskosten in der Regel nicht. Der Medizinische Dienst des Spitzenverbandes der Krankenkassen (IGeL-Monitor) bewertete 2014 nach einer Sichtung der verfügbaren Studien eine Hyaluronsäure-Injektion bei Kniearthrose als „tendenziell negativ“. Im Vergleich zu Placebo und keinen Injektionen habe sich gezeigt, dass sich zwar Schmerzen damit etwas reduzieren lassen und sich die Funktion des Gelenks leicht verbessert. Jedoch treten nach einer Hyaluronsäure-Injektion häufig leichte unerwünschte Ereignisse an der Injektionsstelle auf. Auch schwerwiegende Nebenwirkungen kämen vor – deren Häufigkeit sei wegen einer mangelhaften Berichterstattung in den Studien unklar.[19]
Eine Verwendung von Hyaluronsäure in Hydrogelen zur Wundversorgung[20] und in der Behandlung von chronischen Lungenerkrankungen wird untersucht.[21]
Hyaluronsäure wird auch in Kombination mit Chondroitinsulfat und Poloxamer 407 in der Behandlung von Sodbrennen eingesetzt[22], wobei ausgenutzt wird, dass bei Körpertemperatur dieses vom flüssigen zu einem semi-festen Hydrogel wird und eine physikalische Barriere bildet, das sich an der Speiseröhrenschleimhaut festsetzt[23][24] und sie vor Schäden durch Magensäure und Pepsin schützt.[22] Hyaluronsäure und Chondroitinsulfat sorgen für eine rasche Linderung der Reflux-Beschwerden[22][24][25] und tragen auch zur Regeneration und Wundheilung[26][27][28] der beschädigten Schleimhaut bei.
Einige Nasensprays enthalten Hyaluronsäure, um der Austrocknung der Nasenschleimhäute entgegenzuwirken. Hyaluronsäure wird in Halstabletten zum Schutz der Mund- und Rachenschleimhaut eingesetzt. Auch in Augentropfen zur Behandlung des „trockenen Auges“ findet die Hyaluronsäure Verwendung. Die viskoelastische Eigenschaft der Hyaluronsäure sorgt für einen stabilen und langanhaltenden Tränenfilm ohne Beeinträchtigung des Sehens. Daher wird Hyaluron auch in Reinigungs- und Pflegelösungen für Kontaktlinsen verwendet. Sie soll das Auge auch bei längerem Tragen formstabiler und weicher Linsen vor dem Austrocknen bewahren, was den Tragekomfort erhöhen soll. In der Ophthalmochirurgie werden viskoelastische Natriumhyaluronat-Lösungen zur Auffüllung des Glaskörpers sowie zur Stabilisierung der Vorderkammer und zum Schutz der hochsensiblen Endothelzellschicht der Hornhaut während einer Operation an den vorderen Augenabschnitten, vor allem der Operation der Katarakt (Grauer Star), verwendet.
Seit einigen Jahren sind Produkte auf dem Markt, die Patienten mit Belastungsharninkontinenz eine Behandlung mit stabilisierter Hyaluronsäure ermöglichen. Hier werden vier Hyaluronsäure-Depots um die Harnröhre injiziert. Die Prozedur führt innerhalb des ersten Jahres bei etwa der Hälfte der Patienten zu einer Verbesserung, der Langzeiterfolg dieser Behandlung ist allerdings gering und die Komplikationsrate hoch.[29]
Für Kinder mit vesikorenalem Reflux (VUR) sind schon seit längerem Präparate auf Basis stabilisierter Hyaluronsäure auf dem Markt, die eine gute Alternative zur medikamentösen Langzeittherapie abgeben. Die Ergebnisse hier sind vielversprechend.
Hyaluronan wird auch als Nahrungsergänzungsmittel angeboten. Im Lebensmittelbereich werden vor allem enzymatische Hydrolysate aus Hühnerbrustbeinen oder Hahnenkämmen verwendet. Diese unterscheiden sich in der Menge und Art der – teils als erwünscht deklarierten – Beistoffe: andere Glycosaminoglycane wie Chondroitinsulfat bzw. Proteine und in der molaren Masse, z. B. „HCK“ 250 kDa, Injuv (aus Hahnenkämmen) 50–200 kDa, Hyal-Joint (ebenfalls aus Hahnenkämmen) 6.000–9.000 kDa.
Der Großteil der in Deutschland angebotenen hyaluronsäurehaltigen Supplemente wird für die Gelenkfunktion vermarktet; es sind Multipräparate mit anderen Nährstoffen, die oft wissenschaftlich besser dokumentiert sind. Es werden geringe Mengen von 50 bis 250 mg täglich über die Präparate zugeführt.[30] Eine In-vivo-Resorptionsstudie nach oraler Gabe mit einer molaren Masse von 1000 kDa (also einer relativ hohen molaren Masse) zeigte eine gewisse orale Verfügbarkeit.[31] Die im Plasma nach oraler Gabe auftretende Hyaluronsäure weist eine niedrigere molare Masse (beispielsweise von etwa 30 bis > 80 kDa) auf.[32]
In der Biochemie wird Hyaluronsäure als Wachstumsgrundlage beim Tissue Engineering verwendet.[33][34]
Einsatz in der Kosmetik
Hyaluronsäure wird in Kosmetika eingesetzt. Da die Hyaluronsäure in voller Größe jedoch nur wenig von der Haut aufgenommen wird, können Abbaufragmente von Hyaluronsäure eingesetzt werden. Diese HAF genannten Bestandteile besitzen ein geringeres molekulares Gewicht (z. B. 50 oder 130 Kilodalton),[35] wodurch die einzelnen Fragmente leichter in die Haut eindringen können.
Handelsnamen
KD Intra-Articular Gel (D), Curavisc (D), Durolane (CH), RenehaVis (D), Fermavisc (CH), Hyalart (D), Hyalubrix (D), Hyalur (CH), HYGAG (D), Ial (CH), Ialugen (CH), Lacri-Vision (CH), Lacrycon (CH), Laservis (CH), Ostenil (D, CH), Recosyn (D), Rhinogen (CH), Sinovial (CH), Suplasyn (D, CH), Synvisc (D, CH), Unike-Injekt (D), Viscontour (D), Viscoseal (CH), Hylo-Vision (D), Visiol (CH), Vislube (CH), Vismed (CH), Xidan (D), zahlreiche Generika (D, CH)
Alphastria (CH), Ialugen Plus (CH, mit Silbersulfadiazin), Hyalofemme (D)
Literatur
- Per Hedén, Gabriella Sellman, Mats von Wachenfeldt, Michael Olenius, Dan Fagrell: Body Shaping and Volume Restoration: The Role of Hyaluronic Acid. In: Aesthetic Plastic Surgery. 33, 2009, S. 274, doi:10.1007/s00266-008-9303-y. PMID 19280248. PMC 2693799 (freier Volltext).
Weblinks
- Eintrag zu Hyaluronsäure bei Vetpharm, abgerufen am 23. November 2011.
Einzelnachweise
- Eintrag zu Hyaluronic Acid from Cockscomb bei TCI Europe, abgerufen am 21. November 2021.
- Robert Stern: Hyaluronan in cancer biology. 1. Auflage. Academic Press/Elsevier, San Diego 2009, ISBN 978-0-12-374178-3, (online)
- D. Vigetti, E. Karousou, M. Viola, S. Deleonibus, G. De Luca, A. Passi: Hyaluronan: biosynthesis and signaling. In: Biochimica et Biophysica Acta. Band 1840, Nummer 8, August 2014, S. 2452–2459, doi:10.1016/j.bbagen.2014.02.001. PMID 24513306.
- S. Back u. a.: Hyaluronan accumulates in demyelinated lesions and inhibits oligodendrocyte progenitor maturation (Abstract). In: Nature Medicine. 11, 2005, S. 966–972.
- Marieke Degen: Alter vor Schönheit – Hyaluronsäure schützt Nacktmulle vor Krebs. In: dradio Forschung Aktuell. 20. Juni 2013.
- T. Schulz, U. Schumacher, P. Prehm: Hyaluronan export by the ABC transporter MRP5 and its modulation by intracellular cGMP. In: J. Biol. Chem. 282, S. 20999–21004.
- C. Hubbard, J. T. McNamara u. a.: The hyaluronan synthase catalyzes the synthesis and membrane translocation of hyaluronan. In: Journal of molecular biology. Band 418, Nummer 1–2, April 2012, S. 21–31, doi:10.1016/j.jmb.2012.01.053. PMID 22343360.
- FOCUS Online: Hyaluronsäure soll verschlissene Gelenke füllen. In: FOCUS Online. (focus.de [abgerufen am 13. Mai 2017]).
- HYALURONSÄURE (SUPLASYN U.A.): WAS IST BELEGT?- arznei telegramm. Abgerufen am 13. Mai 2017.
- D. Trigkilidas, A. Anand: The effectiveness of hyaluronic acid intra-articular injections in managing osteoarthritic knee pain. In: Annals of the Royal College of Surgeons of England. Band 95, Nummer 8, November 2013, S. 545–551, doi:10.1308/003588413X13629960049432. PMID 24165334.
- E. C. Rodriguez-Merchan: Intra-articular Injections of Hyaluronic Acid and Other Drugs in the Knee Joint. In: HSS journal : the musculoskeletal journal of Hospital for Special Surgery. Band 9, Nummer 2, Juli 2013, S. 180–182, doi:10.1007/s11420-012-9320-x. PMID 24426865. PMC 3757486 (freier Volltext).
- Arznei-Telegramm 2002, Nr. 4 (PDF; 27 kB).
- R. Raman, A. Dutta, N. Day, H. K. Sharma, C. J. Shaw, G. V. Johnson: Efficacy of Hylan G-F 20 and Sodium Hyaluronate in the treatment of osteoarthritis of the knee – a prospective randomized clinical trial. In: Knee. 15(4), Aug 2008, S. 318–324. Epub 2008 Apr 21.
- N. Bellamy, J. Campbell, V. Robinson, T. Gee, R. Bourne, G. Wells: Viscosupplementation for the treatment of osteoarthritis of the knee. In: Cochrane Database of Systematic Reviews. Issue 2, 2006, Art. No.:CD005321. doi:10.1002/14651858.CD005321.pub2 PMID 16625635
- Arznei-Telegramm 2002, Nr. 4, Fazit (PDF; 27 kB).
- Arznei-Telegramm 1/2004
- Studie über die Behandlung der Facettengelenksarthrose mit Hyaluronsäure
- Chirurgen-Magazin für den niedergelassenen Chirurgen : offizielles Verbandsorgan des Berufsverbandes Niedergelassener Chirurgen (BNC), Heft 57, Ausgabe 3.2012, S. 46–47.
- IGeL-Monitor Hyaluronsäure-Injektion bei Kniearthrose. Erstellt am: 14. Mai 2014, abgerufen am 31. Oktober 2018.
- R. D. Price, M. G. Berry, H. A. Navsaria: Hyaluronic acid: the scientific and clinical evidence. In: Journal of plastic, reconstructive & aesthetic surgery : JPRAS. Band 60, Nummer 10, 2007, S. 1110–1119, doi:10.1016/j.bjps.2007.03.005. PMID 17466613.
- L. Allegra, S. Della Patrona, G. Petrigni: Hyaluronic acid : perspectives in lung diseases. In: Handbook of experimental pharmacology. Nummer 207, 2012, S. 385–401, doi:10.1007/978-3-642-23056-1_17. PMID 22566234.
- V. Savarino, F. Pace, C. Scarpignato, the Esoxx Study Group: Randomised clinical trial: mucosal protection combined with acid suppression in the treatment of non-erosive reflux disease – efficacy of Esoxx, a hyaluronic acid-chondroitin sulphate based bioadhesive formulation. In: Alimentary Pharmacology & Therapeutics. Band 45, Nr. 5, März 2017, S. 631–642, doi:10.1111/apt.13914, PMID 28116754, PMC 5347926 (freier Volltext).
- Massimo P Di Simone, Fabio Baldi, Valentina Vasina, Fabrizio Scorrano, Maria Laura Bacci: Barrier effect of Esoxx® on esophageal mucosal damage: experimental study on ex-vivo swine model. In: Clinical and Experimental Gastroenterology. Band 5, 11. Juni 2012, S. 103–107, doi:10.2147/CEG.S31404, PMID 22767997, PMC 3387832 (freier Volltext).
- B. Palmieri, A. Merighi, D. Corbascio, V. Rottigni, G. Fistetto: Fixed combination of hyaluronic acid and chondroitin-sulphate oral formulation in a randomized double blind, placebo controlled study for the treatment of symptoms in patients with non-erosive gastroesophageal reflux. In: European Review for Medical and Pharmacological Sciences. Band 17, Nr. 24, Dezember 2013, S. 3272–3278, PMID 24379055.
- Cancer Therapy and Oncology International Journal (CTOIJ). Abgerufen am 29. September 2019 (englisch).
- Patrick du Souich, Antonio G. García, Josep Vergés, Eulàlia Montell: Immunomodulatory and anti-inflammatory effects of chondroitin sulphate. In: Journal of Cellular and Molecular Medicine. Band 13, 8a, 2009, S. 1451–1463, doi:10.1111/j.1582-4934.2009.00826.x, PMID 19522843, PMC 3828858 (freier Volltext).
- M. Schnabelrauch, D. Scharnweber, J. Schiller: Sulfated Glycosaminoglycans As Promising Artificial Extracellular Matrix Components to Improve the Regeneration of Tissues. 2013, abgerufen am 29. September 2019 (englisch).
- Kessiena L. Aya, Robert Stern: Hyaluronan in wound healing: Rediscovering a major player. In: Wound Repair and Regeneration. Band 22, Nr. 5, 2014, S. 579–593, doi:10.1111/wrr.12214.
- F. Lone, A. H. Sultan, R. Thakar: Long-term outcome of transurethral injection of hyaluronic acid/dextranomer (NASHA/Dx gel) for the treatment of stress urinary incontinence (SUI). In: International urogynecology journal and pelvic floor dysfunction. Band 21, Nummer 11, November 2010, S. 1359–1364, doi:10.1007/s00192-010-1211-4. PMID 20571764.
- Vita Naturals: FAQ – Frequently asked Questions – Häufig gestellte Fragen über Hyaluron. Abgerufen am 31. Dezember 2020.
- Lajos Balogh, Andras Polyak, Domokos Mathe, Reka Kiraly, Juliana Thuroczy, Marian Terez, Gyozo Janoki, Yaoting Ting, Luke R. Bucci, Alexander G. Schauss: Absorption, Uptake and Tissue Affinity of High-Molecular-Weight Hyaluronan after Oral Administration in Rats and Dogs. In: J. Agric. Food Chem. 56 (22), 2008, S. 10582–10593; doi:10.1021/jf8017029.
- Patentschrift der Hyal Pharmaceutical Corp.
- M. N. Collins, C. Birkinshaw: Hyaluronic acid based scaffolds for tissue engineering–a review. In: Carbohydrate Polymers. Band 92, Nummer 2, Februar 2013, S. 1262–1279, doi:10.1016/j.carbpol.2012.10.028. PMID 23399155.
- A. Fakhari, C. Berkland: Applications and emerging trends of hyaluronic acid in tissue engineering, as a dermal filler and in osteoarthritis treatment. In: Acta Biomaterialia. Band 9, Nummer 7, Juli 2013, S. 7081–7092, doi:10.1016/j.actbio.2013.03.005. PMID 23507088. PMC 3669638 (freier Volltext).
- T. Pavicic, G. G. Gauglitz, P. Lersch, K. Schwach-Abdellaoui, B. Malle, H. C. Korting, M. Farwick: Efficacy of cream-based novel formulations of hyaluronic acid of different molecular weights in anti-wrinkle treatment. In: Journal of Drugs in Dermatology. Band 10, Nummer 9, September 2011, S. 990–1000. PMID 22052267.