Glucagon
Glucagon (auch Glukagon) ist ein Peptidhormon, dessen Hauptwirkung die Erhöhung des Blutzuckerspiegels durch Anregung der Bildung von energiereicher Glucose aus Glykogen in der Leber ist. Es ist bedeutsam für die Glukosehomöostase. Es wird aus den Präkursoren Präglucagon und Präproglucagon in den Langerhans-Inseln der Bauchspeicheldrüse (α-Inselzellen) gebildet. Bei Blutzuckerabfall, aber auch nach einer proteinreichen Mahlzeit wird Glucagon von der Bauchspeicheldrüse in die Blutbahn abgegeben und dort frei transportiert. Dieses Hormon ist in seiner Wirkung auf den Glucose-, Protein- und Fettsäurestoffwechsel ein Gegenspieler des Insulins. Glucagon wird von der Leber aufgenommen und durch Spaltung inaktiviert.
| Glucagon | ||
|---|---|---|
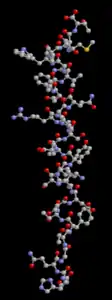
| ||
| Strukturmodel von Glucagon (Kugel-Stab-Modell) | ||
|
Vorhandene Strukturdaten: 1bh0, 1d0r, 1nau | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 29 Aminosäuren, 3483 Da | |
| Präkursor | Preproglucagon | |
| Bezeichner | ||
| Gen-Namen | GCG ; GLP1; GLP2; GRPP | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | H04AA01 | |
| DrugBank | DB00040 | |
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 2641 | 14526 |
| Ensembl | ENSG00000115263 | ENSMUSG00000000394 |
| UniProt | P01275 | P55095 |
| Refseq (mRNA) | NM_002054 | NM_008100 |
| Refseq (Protein) | NP_002045 | NP_032126 |
| Genlocus | Chr 2: 162.71 – 162.71 Mb | Chr 2: 62.28 – 62.28 Mb |
| PubMed-Suche | 2641 | 14526 |
Geschichte
Die Existenz des Pankreashormons Glucagon als hyperglykämischer Faktor wurde 1923 zum ersten Mal von John Raymund Murlin postuliert. Doch erst im Jahre 1953 konnte Anne-Marie Staub die Reinsubstanz gewinnen. Die unten aufgezeichnete Sequenzierung erschloss 1956 William Wallis Bromer. Positive Effekte auf die Herzleistung wurden 1960 von Ronald Ralph Tuttle und Alfed Emil Farah erforscht sowie belegt. In der Vergangenheit wurde das Glucagon vor allem bei einem kardiogenen Schock angewendet.[1]
Struktur
Aus dem Glucagon-Vorläuferprotein von 180 Aminosäuren werden neben Glucagon auch 7 weitere Peptide gebildet - Glicentin, Glicentin-related polypeptide (GRPP), Oxyntomodulin, Glucagon-like peptide 1 (GLP-1, Inkretin-Hormon), Glucagon-like peptide 1 (7-37), Glucagon-like peptide 1 (7-36), Glucagon-like peptide 2 (GLP-2).[2] Die Primärstruktur des humanen Glucagons besteht aus 29 Aminosäuren mit einer Molekülmasse von 3483 Da. Die Primärstruktur lautet: His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Asn-Thr.[2]
Glucagonsekretion
Bei normaler Ernährung bleibt die Sekretion von Glucagon im Vergleich zu der von Insulin relativ konstant. Die Stimuli für eine erhöhte Ausschüttung sind hauptsächlich Hypoglykämie (zu niedriger Blutzuckerspiegel), proteinreiche Mahlzeiten, Infusion von Aminosäuren (z. B. Arginin, Alanin), länger dauernde starke körperliche Arbeit und Stress. Bei Hypoglykämie kann die Glucagonsekretion auf das bis zu Vierfache gesteigert werden. Stimulation erfolgt durch β-Adrenorezeptoren. Seine Freisetzung wird von Insulin, Somatostatin und GLP1 gehemmt. GIP steigert die Glukagonfreisetzung.[3]
Wirkungsmechanismus
Glucagon ist der Gegenspieler zu Insulin. Während Insulin die Glykogensynthese fördert, resultiert die Freisetzung von Glucagon in einem Abbau von Glykogen. Die Wirkung von Glucagon beruht auf der Bindung an einen G-Protein-gekoppelten Rezeptor. Das dadurch aktivierte Gs-Protein stimuliert die Adenylatcyclase (EC 4.6.1.1). Durch cAMP werden die Enzyme für den Glucose- und Fettstoffwechsel aktiviert. Als vorrangiger Effekt wird die Glykogenphosphorylase (EC 2.4.1.1) phosphoryliert, die den Glykogenabbau stimuliert und die Glykogensynthese hemmt.
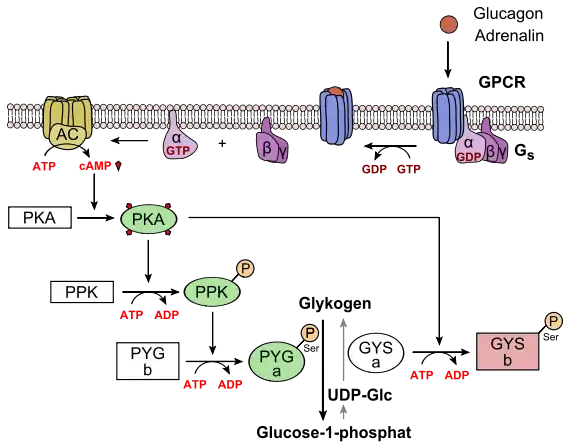
Glucagon stimuliert nicht nur die Glykogenolyse, sondern auch die Neusynthese von Glucose (Gluconeogenese) aus Aminosäuren. Glucagon hat also eine proteinkatabole Wirkung, was zum Anstieg von Harnstoff im Blut führt. Außerdem werden über cAMP fettverdauende Enzyme (Lipasen) aktiviert, woraus eine Erhöhung der Fettsäuren im Blut resultiert.
Verwendung
Glucagon wird zur Ruhigstellung des Darmes eingesetzt und wird in dieser Funktion auch als intravenös zu verabreichendes Medikament verwendet. Als Gegenmittel bei Vergiftungen mit Betablockern und Calciumkanalblockern wird der Wirkstoff ebenfalls angewendet. Es wird auch beim Magenröntgen verwendet, um die Schleimhaut besser beurteilen zu können.[4]
Am Herzen bewirkt Glucagon neben einer Herzfrequenzsteigerung auch eine kurzfristige Zunahme der Kontraktionskraft des Herzmuskels.[5]
Außerdem besitzen viele insulinpflichtige Diabetiker ein Notfall-Set mit Glucagon und einem Lösungsmittel, das bei einer schweren Hypoglykämie mit Bewusstlosigkeit nach Auflösung der Pulversubstanz von einem eingewiesenen Helfer subkutan oder intramuskulär gespritzt wird und über den oben beschriebenen Wirkungsmechanismus eine Erhöhung des Blutzuckerspiegels erreichen soll. Glucagon wird vom Hersteller Novo Nordisk unter dem Handelsnamen GlucaGen vertrieben.
Im Dezember 2019 ließ die EU-Kommission auf Empfehlung der Europäische Arzneimittel-Agentur (EMA) unter dem Namen Baqsimi (Eli Lilly) eine vollkommen neuartige Glucagon-haltige Darreichungsform zu, bei der das Hormon durch die Nase verabreicht werden kann.[6]
Für eine im Jahr 2010 durchgeführte Studie wurde eine Insulinpumpe entwickelt, die neben der Insulinampulle eine Glucagonampulle beinhaltete. Durch eine beständige Glucose-Messung in einem Closed-Loop-System (Blutglukosemessung und Dosisabgabe erfolgen automatisch) wurde bei Unterzuckerungsgefahr Glucagon über die Pumpe abgegeben. In einer Studie aus dem Jahr 2020 konnte ein Dual-Hormon-Regelsystem (Insulin und Glucagon) im Vergleich mit einem Singe-Hormon-System bei und nach Sport Hypoglykämien reduzieren unter gleichzeitiger Inkaufnahme gering vermehrter Hyperglykämien. Zudem erwies sich die für ein solches System verwendete Glucagon-Fomulierung als stabil.[7]
Eine chemische Variante des Glucagons ist Dasiglucagon, das nicht als Pulver für die Rekonstitution, sondern als gebrauchsfertige Lösung für die subkutane Injektion vorliegt.
Glucagon-Test (C-Peptid)
Es gibt einen Glucagontest, der im medizinischen Alltag allerdings nur selten verwendet wird. Er dient der Prüfung der Stimulierbarkeit der β-Zellen des Pankreas (Funktionsreserve) zur Unterscheidung von Diabetes Typ I und Typ II.
Durchführung
- Blutentnahme zur Bestimmung von C-Peptid basal. Gabe von 1 mg Glucagon i.v.
- Blutentnahme 6 min. nach Glucagon zur Messung des stimulierten C-Peptid-Spiegels (β-Zell-Funktionsreserve).
Beurteilung
- Ein Anstieg des C-Peptids um mindestens 0,5 nmol/l und/oder auf mehr als 1,0 nmol/l deutet auf funktionsfähige β-Zellen.
- Blutglucose sollte immer mitbestimmt werden, um den Grad der Vorstimulation der β-Zellen zu erkennen.
Siehe auch
Weblinks
- Glucagon and Glucagon Like Peptides Overview. Bachem Catalogue
Einzelnachweise
- Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarb. und erw. Auflage. Wiss. Verl-Ges., Stuttgart 2005, ISBN 3-8047-2113-3, S. 164.
- GCG – Glucagon precursor – Homo sapiens (Human) – GCG gene & protein. In: uniprot.org. 20. Juni 2018, abgerufen am 24. Mai 2018 (englisch).
- Mikkel Bring Christensen: Glucose-dependent insulinotropic polypeptide: effects on insulin and glucagon secretion in humans. In: Danish Medical Journal. Band 63, Nr. 4, April 2016, ISSN 2245-1919, PMID 27034187.
- Schweizerisches Toxikologisches Informationszentrum, Antidot-Monographie für Glucagon; pharmavista.net (PDF; 39 kB)
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg / New York u. a. 1999, ISBN 3-540-65024-5, S. 57.
- Baqsimi EMA, abgerufen am 8. April 2021.
- Leah M. Wilson et al.: Dual-Hormone Closed-Loop System Using a Liquid Stable Glucagon Formulation Versus Insulin-Only Closed-Loop System Compared With a Predictive Low Glucose Suspend System: An Open-Label, Outpatient, Single-Center, Crossover, Randomized Controlled Trial. In: Diabetes Care. Band 43, Nr. 11, 1. November 2020, S. 2721–2729, doi:10.2337/dc19-2267.