Mutarotation
Als Mutarotation (von lateinisch mutare, dt. ‚ändern‘) bezeichnet man die spontane Änderung des Drehwinkels einer Lösung eines optisch aktiven Stoffes vom Zeitpunkt des Ansetzens der Lösung bis zum Erreichen eines festen Wertes.[1] An diesem Punkt ist das thermodynamische Gleichgewicht erreicht. Ursache für die Mutarotation kann Epimerisierung oder eine sonstige asymmetrische Umwandlung sein.
Mutarotation bei Kohlenhydraten
Viele Kohlenhydrate sind optisch aktiv, d. h., sie drehen linear polarisiertes Licht um einen für jede Struktur spezifischen Drehwinkel. Löst man z. B. kristalline D-Glucose in Wasser, so beobachtet man im Polarimeter bei der frisch zubereiteten Lösung eine kontinuierliche Änderung des Drehwinkels, bis schließlich ein konstanter Wert erreicht ist. Die Geschwindigkeit der Gleichgewichtseinstellung ist temperatur- und pH-abhängig.
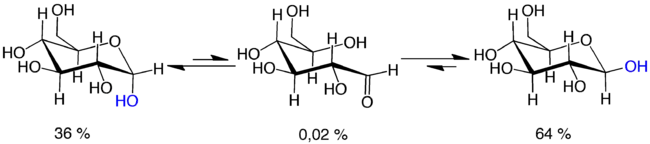
Ursache ist, dass Aldopentosen, Aldohexosen und längerkettige Kohlenhydrate (Zuckermoleküle mit einer Aldehydgruppe und fünf, sechs bzw. mehr Kohlenstoffatomen) in wässriger Lösung im Wesentlichen nicht offenkettig, sondern ringförmig als Halbacetal vorliegen, d. h., die Aldehydgruppe geht eine Bindung mit der vorletzten Hydroxygruppe ein. Hier entsteht ein neues Chiralitätszentrum und zwei mögliche Isomere (genauer: Diastereomere), das α- oder β-Anomer, die sich entsprechend auch in ihrem optischen Drehwinkel unterscheiden. Nun liegt die offenkettige Form mit der Ringform in einem dynamischen Gleichgewicht, das allerdings sehr auf Seiten der Ringform liegt. Weil bei jeder Ringbildung die α- oder β-Form entstehen kann, liegen also auch diese beiden in einem Gleichgewicht mit einer ganz bestimmten Konstante. Eine solche chemische Umwandlung, bei der die Konfiguration nur eines stereogenen Zentrums eines Diastereomers geändert wird, bezeichnet man als Epimerisierung.
Zum Beispiel liegt die Glucose im Gleichgewicht ihrer offenkettigen Form (0,02 % in neutraler Lösung), der α-D-Glucopyranose und der β-D-Glucopyranose vor.[2] Eine Lösung von α-D-Glucopyranose (Drehwinkel +109°) wird also durch kontinuierliche Ringspaltung zu einem Gemisch mit der β-D-Glucopyranose (Drehwinkel +20°), und der Drehwinkel der Lösung erreicht nach einiger Zeit, wenn das Gleichgewicht herrscht, den Wert von +52°.[3] Es liegt offensichtlich kein 1:1-Gemisch vor, das Epimerenverhältnis α:β ist vielmehr 36:64.
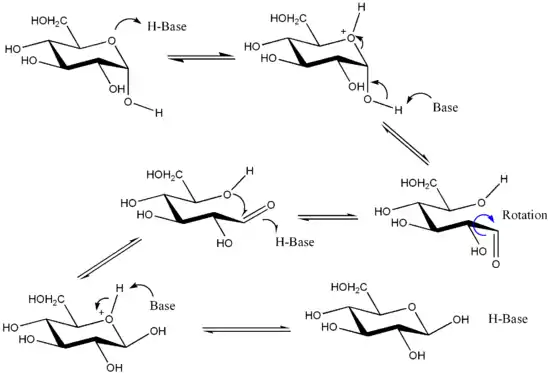
Andere Beispiele
D-Gluconsäure ([α]20D = −6,72°) liegt im Gleichgewicht mit γ-Glucono-1,5-lacton ([α]20D = +67,8°) und δ-Glucono-1,6-lacton vor ([α]20D = +63,5°).[4] Im Gleichgewicht liegt die optische Drehung bei +12°.[5] Die Gleichgewichtseinstellung erfolgt in diesem Fall über eine Lakton-Bildung.
Einzelnachweise
- S. Ebel, H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 450.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, ISBN 978-3-906390-29-1, S. 322–324.
- Reinhard Mattisek, Gabriele Steiner, Markus Fischer: Lebensmittelanalytik. 4. Auflage. Springer, Berlin 2010, ISBN 978-3-540-92205-6, S. 400–401.
- K. Rehorst: Zur Kenntnis einiger Oxy‐säuren der Zuckergruppe, I.: d‐Zuckersäure und d‐Glykonsäure. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). Band 61, Nr. 1, 1928, S. 163–171, doi:10.1002/cber.19280610126.
- W. Bähr, H. Theobald: Organische Stereochemie. Springer-Verlag, 1973.