Monogerman
Monogerman (GeH4) ist die einfachste chemische Verbindung aus der Gruppe der Germane (eine Verbindung aus Germanium und Wasserstoff). Es ist ein sehr reaktionsfreudiges, giftiges, leicht zersetzliches Gas mit unangenehmem Geruch. Es findet Anwendung in der Halbleitertechnologie.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
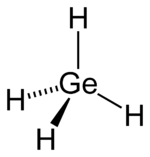 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Monogerman | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | GeH4 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit unangenehmem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 76,62 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−88,5 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,451 (16,85 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,2 ml·m−3 bzw. 0,6 mg·m−3[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
Monogerman wurde in der Jupiteratmosphäre nachgewiesen.[4]
Gewinnung und Darstellung
Monogerman entsteht bei der Zersetzung salzartiger Germanide (Germanium-Metallverbindungen) in Säuren, wie zum Beispiel Magnesiumgermanid in verdünnter Chlorwasserstoffsäure:[5]
- .
Monogerman kann auch durch direkte Reaktion von Germanium mit Wasserstoff dargestellt werden, wobei auch andere Germaniumhydride (Germane) wie Germaniumhexahydrid/Digerman (Ge2H6) und Germaniumoctahydrid/Trigerman (Ge3H8) entstehen. Leichter und mit hoher Reinheit gelingt die Synthese von Monogerman durch die Reaktion von Germaniumtetrachlorid mit Methan und Palladium als Katalysator. Die Ausbeute beträgt dabei 98 %, als Nebenprodukt entsteht Tetrachlormethan:
Im Labormaßstab kann Monogerman auch durch Reaktion von Germanium(IV)-Verbindungen mit Hydriden gewonnen werden. Eine typische Synthese dieser Art ist Natriumgermanat Na2GeO3 mit Natriumborhydrid
Eigenschaften
Monogerman hat eine kritische Temperatur von 34,85 °C, einen kritischen Druck von 55,5 Bar und eine kritische Dichte von 0,598 kg·l−1.
Verwendung
Monogerman wird in der Elektronik-Industrie zur Epitaxie und zum Dotieren verwendet.
Sicherheitshinweise
Schon ab einem Anteil von ca. 10,1 % bildet Monogerman stark explosionsfähige Gemische mit Luft. Da das Gas sehr schwer ist und sich normalerweise nur bis zu 5 % in der Luft anreichert, ist es nur als hochentzündlich einzustufen.
Monogerman ist sehr giftig. Bei einer akuten Vergiftung mit großen Mengen Monogerman treten die folgenden Symptome auf:
Ursache hierfür ist die Unterbrechung des Sauerstofftransports, da Monogerman mit dem im Blut transportierten Sauerstoff zu Germanium(IV)-oxid und Wasser reagiert:
Verhindert werden kann dies durch Gabe von Komplexbildnern wie beispielsweise EDTA.
Einzelnachweise
- Eintrag zu Germaniumwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- P. G. Sennikov, V. E. Shkrunin, D. A. Raldugin, K. G. Tokhadze: Weak Hydrogen Bonding in Ethanol and Water Solutions of Liquid Volatile Inorganic Hydrides of Group IV-VI Elements (SiH4, GeH4, PH3, AsH3, H2S, and H2Se). 1. IR Spectroscopy of H Bonding in Ethanol Solutions in Hydrides. In: The Journal of Physical Chemistry. Band 100, Nr. 16, Januar 1996, S. 6415–6420, doi:10.1021/jp953245k.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7782-65-2 bzw. Monogerman), abgerufen am 2. November 2015.
- nasa.gov: Jupiter, abgerufen am 10. Januar 2021 (englisch).
- L. M. Dennis: Germanium. Zusammenfassung der Untersuchungen im Department of Chemistry, Cornell University, 1921-1927. In: Zeitschrift für anorganische und allgemeine Chemie. Band 174, Nr. 1, 2. August 1928, S. 97, doi:10.1002/zaac.19281740114.


