Germanium(II)-iodid
Germanium(II)-iodid ist eine anorganische chemische Verbindung des Germaniums aus der Gruppe der Iodide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
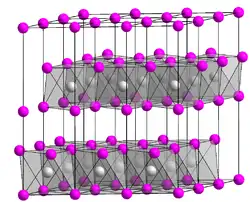 | ||||||||||||||||
| _ Ge2+ _ I− | ||||||||||||||||
| Raumgruppe |
P3m1 (Nr. 164)[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Germanium(II)-iodid | |||||||||||||||
| Andere Namen |
Germaniumdiiodid | |||||||||||||||
| Verhältnisformel | GeI2 | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 326,45 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
5,37 g·cm−3 (25 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
550 °C (Zersetzung)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Germanium(II)-iodid kann durch Reaktion von Germanium(IV)-iodid in Iodwasserstoffsäure mit Phosphinsäure und Wasser gewonnen werden.[2]
Ebenfalls möglich ist die Darstellung durch Reaktion von Germanium(II)-sulfid oder Germanium(II)-oxid mit Iodwasserstoffsäure bzw. aus Germanium mit Iod bei 200 – 400 °C.[2]
Eine weitere Darstellungsmöglichkeiten ist:[5]
Eigenschaften
Germanium(II)-iodid ist ein gelber kristalliner Feststoff, der in trockener Luft bei Raumtemperatur beständig ist, jedoch in Gegenwart von Feuchtigkeit langsam zu Germanium(II)-hydroxid hydrolysiert. Er ist unlöslich in Kohlenwasserstoffen, aber wenig löslich in Trichlormethan und Tetrachlorkohlenstoff. Die Verbindung besitzt eine Kristallstruktur des Polytyps 2H des Cadmium(II)-iodid-Typs (a = 413 pm; c = 679 pm).[2] Sie disproportioniert bei 550 °C in Germanium(IV)-iodid und Iod.[6] Mit Ethin reagiert sie zu einem dimeren Komplex mit zyklischer Struktur.[7]
Verwendung
Germanium(II)-iodid bildet stabile ionische Addukte mit Carbenen.[3] Es wird auch in der Elektronikindustrie zur Herstellung von Germaniumschichten per Epitaxie durch Disproportionierung verwendet.[8]
Einzelnachweise
- Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 472 (eingeschränkte Vorschau in der Google-Buchsuche).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 727.
- Datenblatt Germanium(II) iodide, ≥99.9% trace metals basis bei Sigma-Aldrich, abgerufen am 19. Januar 2014 (PDF).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–65 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Kirmse: Carbene Chemistry 2e. Elsevier, 2013, ISBN 0-323-16145-6, S. 540 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 959.
- Balaram Sahoo: Inorganic Chemistry. PHI Learning Pvt. Ltd., 2012, ISBN 81-203-4308-5, S. 321 (eingeschränkte Vorschau in der Google-Buchsuche).
- A.G. Milnes: Heterojunctions and Metal Semiconductor Junctions. Elsevier, 1972, ISBN 0-323-14136-6, S. 104 (eingeschränkte Vorschau in der Google-Buchsuche).
