Diels-Alder-Reaktion
Die Diels-Alder-Reaktion ist eine chemische Reaktion, bei der Bindungen zwischen Kohlenstoff-Atomen aufgebaut werden. Sie wurde nach ihren Entdeckern Otto Diels und Kurt Alder aus Kiel benannt, die für ihre Arbeit 1950 mit dem Nobelpreis ausgezeichnet wurden.[1][2][3][4]
Bei dieser Umsetzung wird ein Ring aus sechs Kohlenstoffatomen gebildet, wobei ein konjugiertes Dien und ein substituiertes Alken verknüpft werden. Das substituierte Alken wird auch Dienophil genannt; um eine akzeptable Ausbeute zu erreichen, müssen Dien und Dienophil besondere elektronische Eigenschaften aufweisen.[5][6][7][8] Die besondere Bedeutung der Diels-Alder-Reaktion liegt darin, dass C-C-Bindungen mit hoher Stereoselektivität aufgebaut werden können. Diels-Alder-Reaktionen spielen insbesondere bei der Synthese von Naturstoffen (u. a. Aufbau von Steroiden wie z. B. dem weiblichen Sexualhormon Estradiol) eine große Rolle. Die Atomökonomie der Diels-Alder-Reaktion ist durchgängig hervorragend.
Allgemeines
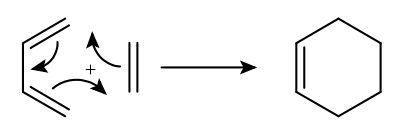
Bei der Diels-Alder-Reaktion handelt es sich um eine [4+2]-Cycloaddition. Dies bedeutet, dass 4 bzw. 2 π-Elektronen der beiden Moleküle an der Reaktion beteiligt sind. Ein typisches Beispiel ist die Reaktion von Maleinsäureanhydrid mit 1,3-Butadien.
Die in diesem Zusammenhang oft als Beispiel gezeigte Reaktion von 1,3-Butadien mit Ethen unter Bildung von Cyclohexen kann nur als schematisch verstanden werden, denn ohne elektronenziehende Substituenten am Dienophil ist dessen niedrigstes, unbesetztes Orbital (LUMO) energetisch zu hoch, um mit dem höchsten besetzten Orbital (HOMO) des Diens in bindende Wechselwirkung zu treten.[9]
Es kommt dabei zu einer konzertierten Umlagerung von drei π-Elektronenpaaren, die zwei neue σ-Bindungen zwischen einem Dienophil und einem Dien sowie eine Doppelbindung im entstandenen Diels-Alder-Produkt bilden. Die Reaktion kann sowohl thermisch als auch photochemisch initiiert werden.
Die Stereochemie der Reaktion kann dabei durch die Anwendung der Woodward-Hoffmann-Regeln verstanden werden.
Mechanismus
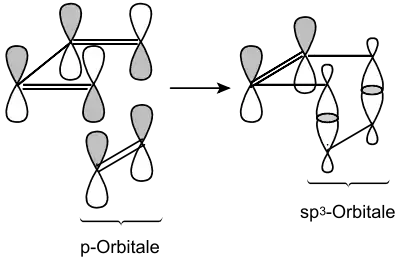
Schematisch verläuft eine Diels-Alder-Reaktion nach folgendem Mechanismus:
Dabei überlagern sich im Übergangszustand die p-Orbitale von Dien und Dienophil so, dass es zur Ausbildung von neuen chemischen Bindungen kommt. Die Pfeile sind hier lediglich schematisch aufzufassen und stellen keine Wechselwirkungen zwischen elektrophilen und nucleophilen Zentren dar.
Kinetische Betrachtung
Die Reaktionsgeschwindigkeit kann durch die Einführung von funktionalen Gruppen am Dien und/oder Dienophil (Kombination eines elektronenarmen Diens und elektronenreichen Dienophils (inverser Elektronenbedarf) bzw. eines elektronenreichen Diens und elektronenarmen Dienophils (normaler Elektronenbedarf)) erheblich erhöht werden. Die stereochemische Anordnung dieser funktionalen Gruppen im Produkt (cis oder trans) ist abhängig von der Art der Reaktion (thermisch oder photolytisch; conrotatorischer oder disrotatorischer Ringschluss) sowie der Elektronendichte der Reaktanten. Vorhersagen sind auf Basis der energetischen Lage der jeweiligen HOMO/LUMO-Orbitale (MO-Theorie) möglich.
Stereochemie und endo-Regel
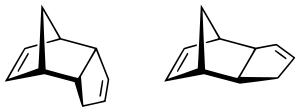
Es ist grundsätzlich die Bildung eines exo- und eines endo-Produktes denkbar. Die thermodynamisch (da sterisch) günstigere Variante ist das exo-Produkt, bei dem das Dienophil vom Dien „weggeklappt“ ist. Für den Übergangszustand der Anlagerung des Diens an das Dienophil wird allgemein angenommen, dass der endo-Übergangszustand aufgrund sekundärer Orbitalwechselwirkungen bevorzugt wird. Eine abschließende Erklärung steht jedoch noch aus. Durch eine kinetische Kontrolle der Reaktion (z. B. durch tiefe Temperatur, welche die reversible Reaktion unterdrückt oder verlangsamt) wird die bevorzugte Bildung des endo-Produkts gefördert.
Chemie der Diene
Die Dien-Komponente in der Diels-Alder-Reaktion kann sowohl offenkettig als auch cyclisch vorliegen und viele verschiedene Substituenten haben.[11] Die einzige Einschränkung ist, dass das offenkettige Dien für die Reaktion in der s-cis-Konfiguration vorliegen muss.[12] Diese wird aber durch ein Gleichgewicht zwischen dem s-cis- und s-trans-Isomer erreicht. Unter normalen Bedingungen liegt vorwiegend die s-trans-Modifikation vor; da die s-cis-Form dem Gleichgewicht aber entzogen wird, verschiebt es sich entsprechend dem Prinzip von Le Chatelier. Cyclische Diene liegen fast immer in der s-cis-Konfiguration vor, weil das Umklappen nach s-trans durch den Ring nicht mehr möglich ist. Sie sind außergewöhnlich reaktiv. Ein Beispiel hierfür ist etwa Cyclopentadien; es reagiert trotz fehlender elektronenziehender oder elektronenschiebender Substituenten auch mit sich selbst zum Dicyclopentadien.
Chemie der Dienophile
In einer typischen Diels-Alder-Reaktion besitzt das Dienophil eine elektronenziehende Gruppe in Konjugation zur Doppelbindung. Dienophile können durch Lewis-Säuren aktiviert werden.[13]
Cyclopentadien reagiert zum Beispiel nicht mit Cyclohexenon in Ethylacetat, wenn keine Lewis-Säure die Reaktion aktiviert. α,β-ungesättigte Carbonylverbindungen können die Lewis-Säure deaktivieren.
Werden als Dienophil Aldehyde, Ketone, Imine, Thioketone oder andere Verbindungen mit Hetero-Atomen eingesetzt, spricht man auch von Hetero-Diels-Alder-Reaktionen.
Retro-Diels-Alder-Reaktion
Einige Diels-Alder-Reaktionen sind reversibel. Der Zerfall eines Diels-Alder-Addukts in die Ausgangskomponenten wird als Retro-Diels-Alder-Reaktion bezeichnet. Ein Beispiel ist der thermische Zerfall des dimeren Cyclopentadiens in Gegenwart eines Eisen-Katalysators.
In der Massenspektrometrie kann es nach Elektronenstoßionisation zu einer ebenfalls als Retro-Diels-Alder-Reaktion bezeichneten Fragmentierung kommen. Der Mechanismus dieser Reaktion läuft jedoch nicht konzertiert, sondern radikalisch ab.
Literatur
- Francesco Fringuelli, Aldo Taticchi: Dienes in the Diels-Alder Reaction. Wiley, New York 1990, ISBN 0-471-85549-9.
- Nguyên Trong Anh: Die Woodward-Hoffmann-Regeln und ihre Anwendung. Chemie, Weinheim 1972, ISBN 3-527-25430-7.
Weblinks
- Ausführliche Rezension auf Deutsch (Memento vom 6. November 2011 im Internet Archive)
- Rezension auf Englisch (Memento vom 29. Mai 2009 im Internet Archive)
- Rezension auf Englisch mit vielen Beispielen und Literaturzitaten
- Recent Advances in Asymmetric Diels-Alder Reactions
Einzelnachweise
- O. Diels, K. Alder: Synthesen in der hydroaromatischen Reihe. In: Justus Liebigs Annalen der Chemie. 460, Nr. 1, 1928, S. 98–122. doi:10.1002/jlac.19284600106.
- Otto Diels, Kurt Alder: Synthesen in der hydroaromatischen Reihe. III. Mitteilung: Synthese von Terpenen, Camphern, hydroaromatischen und heterocyclischen Systemen. Mitbearbeitet von den Herren Wolfgang Lübbert, Erich Naujoks, Franz Querberitz, Karl Röhl, Harro Segeberg. In: Justus Liebigs Annalen der Chemie. 470, Nr. 1, 1929, S. 62–103, doi:10.1002/jlac.19294700106.
- Otto Diels, Kurt Alder: Synthesen in der hydroaromatischen Reihe, IV. Mitteilung: Über die Anlagerung von Maleinsäure-anhydrid an arylierte Diene, Triene und Fulvene (Mitbearbeitet von Paul Pries). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 62, Nr. 8, 1929, S. 2081–2087, doi:10.1002/cber.19290620829.
- Otto Diels, Kurt Alder: Synthesen in der hydroaromatischen Reihe, V. Mitteilung: Über Δ4-Tetrahydro-o-phthalsäure (Stellungnahme zu der Mitteilung von E. H. Farmer und F. L. Warren: Eigenschaften konjugierter Doppelbindungen (VII). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 62, Nr. 8, 1929, S. 2087–2090, doi:10.1002/cber.19290620830.
- Milton C. Kloetzel: The Diels-Alder Reaction with Maleic Anhydride. In: Organic reactions. 4, Nr. 1, 1948, S. 1–59, doi:10.1002/0471264180.or004.01.
- H. L. Holmes: The Diels-Alder Reaction Ethylenic and Acetylenic Dienophiles. In: Organic Reactions. 4, Nr. 2, 2004, S. 1007–1019, doi:10.1002/0471264180.or004.02.
- Henri B. Kagan, Olivier Riant: Catalytic asymmetric Diels Alder reactions. In: Chemical Reviews. 92, Nr. 5, 1992, S. 1007–1019, doi:10.1021/cr00013a013.
- K. C. Nicolaou, Scott A. Snyder, Tamsyn Montagnon, Georgios Vassilikogiannakis: The Diels–Alder Reaction in Total Synthesis. In: Angewandte Chemie International Edition. 41, Nr. 10, 2002, S. 1668–1698, doi:10.1002/1521-3773(20020517)41:10<1668::AID-ANIE1668>3.0.CO;2-Z.
- Charles E. Mortimer, Ulrich Müller: Chemie: das Basiswissen der Chemie. 9. Auflage. Georg Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-484309-5, S. 539 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin/Heidelberg 2013, ISBN 978-3-642-34715-3, S. 970.
- S. A. Kozmin, S. He, V. H. Rawal,: [4+2] Cycloaddition of 1-Dimethylamino-3-tert-Butyldimethylsiloxy-1,3-Butadiene with Methyl Acrylate: 4-Hydroxymethyl-2-Cyclohexen-1-one In: Organic Syntheses. 78, 2002, S. 160, doi:10.15227/orgsyn.078.0160; Coll. Vol. 10, 2004, S. 442 (PDF).
- E. B. Hershberg, J. R. Ruhoff,: 1,3-Butadiene In: Organic Syntheses. 17, 1937, S. 25, doi:10.15227/orgsyn.017.0025; Coll. Vol. 2, 1943, S. 102 (PDF).
- Mauricio Gomes Constantino, Valdemar Lacerda Júnior, Gil Valdo José Da Silva: Niobium Pentachloride Activation of Enone Derivatives: Diels-Alder and Conjugate Addition Products. In: Molecules. Band 7, Nr. 5, 2002, S. 456–464, doi:10.3390/70500456 (freier Volltext).