Cer(III)-chlorid
Cer(III)-chlorid ist eine chemische Verbindung von Cer und Chlor.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
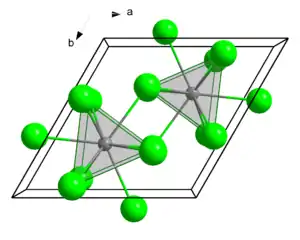 | ||||||||||
| _ Ce3+ _ Cl− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P63/m (Nr. 176) | |||||||||
| Koordinationszahlen |
Ce[9], Cl[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Cer(III)-chlorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | CeCl3 | |||||||||
| Kurzbeschreibung |
weißer, hygroskopischer, geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 246,48 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,92 g·cm−3 (20 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1727 °C[1] | |||||||||
| Löslichkeit |
leicht in Wasser (486 g·l−1 bei 25 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Eigenschaften

Es nimmt an feuchter Luft schnell Wasser auf und bildet verschiedene Hydrate wie Cer(III)-chlorid-Heptahydrat (CeCl3·7 H2O). Dieses kristallisiert triklin, Raumgruppe P1 (Raumgruppen-Nr. 2), mit den Gitterparametern a = 790,2 pm, b = 821,0 pm, c = 918,8 pm, α = 70,52°, β = 73,14° und γ = 81,66°.[2]
Verwendung
Cer(III)-chlorid kann als Ausgangsstoff zur Synthese anderer Cerverbindungen eingesetzt werden. Es kann ebenfalls als Lewis-Säure dienen, zum Beispiel als Katalysator für Friedel-Crafts-Acylierungen und zur Alkylierung von Ketonen. Möglich ist außerdem der Einsatz bei der Luche-Reduktionen[3] und als Bestandteil von Detektor-Kristallen.[4]
Weblinks
- Nobuhiro Takeda, Tsuneo Imamoto: Use of Cerium(III) chloride in the Reactions of Carbonyl Compounds with Organolithiums or Grignard Reagents for the Suppression of Abnormal Reactions: 1-Butyl-1,2,3,4-tetrahydro-1-naphthol In: Organic Syntheses. 76, 1999, S. 228, doi:10.15227/orgsyn.076.0228 (PDF).
Einzelnachweise
- Eintrag zu Cer(III)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- W. Levason, M. Webster: Di-μ-chloro-bis[heptaaquacerium(III)] tetrachloride. In: Acta Crystallographica, E58, 2002, S. i76–i78, doi:10.1107/S1600536802014794.
- Hintermann, Lukas: Katalytische enantioselektive Fluorierung, Dissertation, ETH Zürich, 2000. doi:10.3929/ethz-a-004062829
- Saint-Gobain: BrilLanCe™ 380 crystal (Memento des Originals vom 9. Juni 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.

