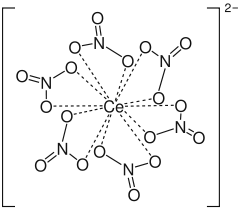
Ammoniumcer(IV)-nitrat
Ammoniumcer(IV)-nitrat (auch Cer(IV)-ammoniumnitrat, abgekürzt CAN) ist eine anorganische Verbindung mit der Formel (NH4)2[Ce(NO3)6]. Es ist ein orange-roter kristalliner Feststoff und ist gut in Wasser löslich. Die Verbindung wird als Oxidationsmittel in der organischen Synthese und in der quantitativen Analyse (Oxidimetrie) eingesetzt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | ||||||||||||||||
| Kristallsystem |
monoklin[1] | |||||||||||||||
| Raumgruppe |
P21/n (Nr. 14, Stellung 2)[1] | |||||||||||||||
| Gitterparameter |
a = 1306,1±0,7 pm, | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumcer(IV)-nitrat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | (NH4)2[Ce(NO3)6] | |||||||||||||||
| Kurzbeschreibung |
oranger Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 548,26 g·mol−1 | |||||||||||||||
| Aggregatzustand |
Feststoff | |||||||||||||||
| Dichte |
2,490 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung

Der anionische Komplex [Ce(NO3)6]2− wird durch die Umsetzung von Ce3+-Ionen z. B. durch Oxidation mit siedender Salpetersäure erhalten. In Anwesenheit von Ammoniumnitrat bildet sich Ammoniumcer(IV)-nitrat.[6] Das Ammonium-Kation ist nicht an den Oxidationsprozessen von Ammoniumcer(IV)-nitrat beteiligt.
Eigenschaften
Ce4+ ist ein starkes oxidierendes Reagenz (E° ~ 1,61 V gegen die Normalwasserstoffelektrode) und ist noch stärker als elementares Chlor (E° ~ 1,36 V). Während der Redoxreaktion wird Ce(IV) zum Ce(III) durch eine Einelektronenübertragung reduziert und die Farbe der wässrigen Lösung wechselt von orange zu einer blassgelben Farbe (natürlich unter der Voraussetzung, dass die Reaktionspartner keine Eigenfärbung besitzen).
Verwendung
Oxidationsmittel
Ammoniumcer(IV)-nitrat ist ein häufig gebrauchtes Oxidationsmittel zur Oxidation von vielerlei funktioneller Gruppen. Dazu gehören Alkohole, Phenole und Ether. Auch C–H-Bindungen können z. B. in Benzylstellungen oxidiert werden. Die Oxidation von Catecholen und Hydrochinonen ergeben die entsprechenden Chinone.[7][8]
Schutzgruppen-Chemie
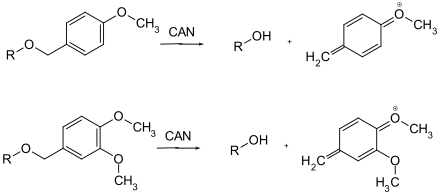
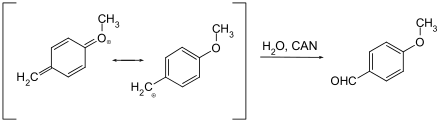
In der Schutzgruppen-Chemie findet Ammoniumcer(IV)-nitrat eine Anwendung beim Spalten von p-Methoxy- und 3,4-Dimethoxybenzyl-Ethern. Dabei wird der Aromat über eine Chinomethin-Zwischenstufe vom geschützten Alkohol abgespalten.
Der Reaktionsmechanismus ist vermutlich der gleiche wie bei der Entschützung mit DDQ als Oxidationsmittel. Das Oxidationsmittel (CAN oder DDQ) wird durch die Aufnahme von insgesamt zwei Elektronen (beim CAN sind zwei Moleküle CAN beteiligt) reduziert und der Benzylether reagiert dabei unter Oxidation und Wasseranlagerung zum entsprechenden Aldehyd.[9]
Ätzen von Chrom
Bei der Strukturierung von dünnen Filmen wird Ammoniumcer(IV)-nitrat zum selektiven Ätzen von Chrom verwendet[10]. Dabei wird das Chrom durch das Cer oxidiert und dadurch in Lösung gebracht. Eine Lösung von ca. 10 % Ammoniumcer(IV)-nitrat in einer Säure (Salpeter-, Perchlor- oder Essigsäure) hat eine Ätzrate von ca. 50–150 nm/min.
Einzelnachweise
- Thomas A. Beineke, J. Delgaudio: Crystal structure of ceric ammonium nitrate. In: Inorganic Chemistry. Band 7, Nr. 4, 1968, S. 715–721, doi:10.1021/ic50062a020.
- Preetam Singh, M.S. Hegde: Controlled synthesis of nanocrystalline CeO2 and Ce1−xMxO2−δ (M=Zr, Y, Ti, Pr and Fe) solid solutions by the hydrothermal method: Structure and oxygen storage capacity. In: Journal of Solid State Chemistry. Band 181, Nr. 12, 2008, S. 3248–3256, doi:10.1016/j.jssc.2008.08.018.
- Datenblatt Ammoniumcer(IV)-nitrat (PDF) bei Merck, abgerufen am 3. Januar 2012.
- Veli T. Kasumov, Ali İ. Öztürk, Fevzi Köksal: Synthesis, characterization and redox behavior of bis(N-1-adamantanyl- and N-2-adamantanyl-3,5-tBu2-salicylaldiminato)copper(II) complexes. In: Polyhedron. Band 26, Nr. 13, 2007, S. 3129–3135, doi:10.1016/j.poly.2007.02.012.
- Eintrag zu Diammoniumhexanitratocerat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- G. Brauer: Handbook of Preparative Inorganic Chemistry, Vol. 2, Academic, New York 1965.
- Vijay Nair, Lakshmi Balagopal, Roshini Rajan, Jessy Mathew: "Recent Advances in Synthetic Transformations Mediated by Cerium(IV) Ammonium Nitrate", in: Acc. Chem. Res., (2004), 37, S. 21–30 (doi:10.1021/ar030002z).
- Vijay Nair, Sreeletha B. Panicker, Latha G. Nair, Tesmol G. George, Anu Augustine: "Carbon-Heteroatom Bond-Forming Reactions Mediated by Cerium(IV) Ammonium Nitrate: An Overview", in: Synlett, (2003), S. 156–165 (doi:10.1055/s-2003-36775).
- Phillip J. Kocieński: Protecting Groups, 1. Auflage, Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-135601-4.
- Microchemicals: Ätzen von Chrom (PDF).