Cer(III)-fluorid
Cer(III)-fluorid ist ein Salz des Seltenerd-Metalls Cer mit Fluorwasserstoff.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
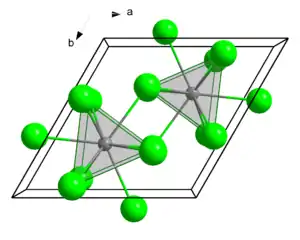 | ||||||||||||||||
| _ Ce3+ _ F− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
P63/mcm (Nr. 193)[1] | |||||||||||||||
| Koordinationszahlen |
Ce[9], F[3] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cer(III)-fluorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | CeF3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 197,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
6,16 g·cm−3 (20 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, löslich in starken Säuren (z. B. Schwefelsäure[4]) | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Cer(III)-fluorid wird gewonnen durch Umsetzung von löslichem Cer(III)-chlorid CeCl3 mittels Fluorwasserstoff HF und anschließendem Abrauchen des CeF3 mit Ammoniumfluorid im Platintiegel, oder alternativ aus Cer(IV)-oxid mit einem Überschuss an Flusssäure.[5]
Eigenschaften
Physikalische Eigenschaften
Cer(III)-fluorid hat einen Brechungsindex von 1,62 (bei 500 nm) und ist transparent im Bereich von 300 bis 5000 nm.
Chemische Eigenschaften
Cer(III)-fluorid ist unlöslich, hydrolysiert in Wasser jedoch langsam zum Ceroxidfluorid CeOF.
Verwendung
Cer(III)-fluorid ist ein Zwischenprodukt bei der Herstellung von reinem Cer (Abtrennung von anderen Seltenerdmetallen).
Es wird verwendet:
- in Sauerstoff-sensitiven Anwendungen, wie zum Beispiel der Metallverarbeitung
- als Bestandteil von feuerfester Keramik
- in der Elektronikindustrie zum Sputtern
- als Zusatzstoff in Graphit-Elektroden von Kohlebogenlampen zur Steigerung von deren Helligkeit (Scheinwerfer von Heinrich Beck)[6]
- als Ausgangsmaterial für Poliermittel und Spezialgläser
- als Szintillator (mit Europium dotiert) für Teilchendetektoren in der Hochenergiephysik
- als Material für reflexionsmindernde Schichten[7]
- In extrem geringer Konzentration (ppm) werden Fluoridverbindungen in der Medizin verwendet.[8]
Siehe auch
- Cer(II)-fluorid CeF2, CAS-Nummer: 22655-57-8
- Cer(IV)-fluorid CeF4
Einzelnachweise
- M. L. Afanasiev, S. P. Habuda, A. G. Lundin: The symmetry and basic structures of LaF3, CeF3, PrF3 and NdF3, in: Acta Cryst., 1972, B28, S. 2903–2905, doi:10.1107/S0567740872007198.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1942.
- Datenblatt Cer(III)-fluorid bei Sigma-Aldrich, abgerufen am 10. Dezember 2012 (PDF).
- Datenblatt Cerium Fluoride bei espimetals.com
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 247.
- treibacher.com: Produktinformation Cerfluorid (Memento vom 12. Mai 2008 im Internet Archive)
- testbourne.com: Cerium Fluoride CeF3 (Memento vom 28. September 2007 im Internet Archive)
- americanelements.com:Cerium Fluoride
