Plasmodium
Die Gattung Plasmodium gehört zu den Haemosporida innerhalb der Gruppe der Apicomplexa. Plasmodien sind einzellige Parasiten, die große medizinische Bedeutung haben, da die Krankheitserreger der Malaria zu dieser Gattung gehören. Die zirka 200 Arten der Gattung parasitieren bei einer Vielzahl von landlebenden Säugetieren, Reptilien und Vögeln. Alle Arten machen einen Wirtswechsel durch, sie werden in der Regel von blutsaugenden Stechmücken auf die Wirbeltiere übertragen. Plasmodien kommen praktisch weltweit vor, die für den Menschen gefährlichen Malariaerreger beschränken sich heute allerdings auf tropische und subtropische Länder.
| Plasmodium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
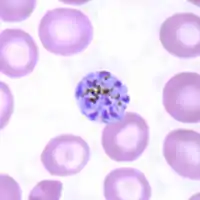
Schizont von Plasmodium malariae, der Typusart der Gattung, im gefärbten Blutausstrich | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Plasmodien | ||||||||||||
| Marchiafava & Celli, 1885 |
Geschichte und Beschreibung
Plasmodien als Erreger der Malaria wurden erstmals 1880 in Algerien von Alphonse Laveran unter der Bezeichnung Oscillaria malariae beschrieben. Kurz darauf wurden von Danilewsky in der Ukraine verschiedene Blutparasiten, darunter auch Plasmodien, bei Vögeln entdeckt. Die heute anerkannte Gattungsbezeichnung Plasmodium wurde 1885 von den Italienern Marchiafava und Celli vorgeschlagen.
Wie alle Haemospororida parasitieren die Plasmodien im Laufe des Lebenszyklus erst im Gewebe, dann in Blutzellen von Wirbeltieren. Dort bilden sie auch Geschlechtsformen, sogenannte Gametozyten aus, wobei Mikrogametozyten und Makrogametozyten zu unterscheiden sind. Lediglich Mikrogameten tragen während ihrer kurzen Existenz eine einzelne Geißel. Plasmodien haben wie die meisten Apicomplexa einen nur im Elektronenmikroskop erkennbaren Apicoplasten, einen Plastiden ohne Chlorophyll, der zwar nicht zur Photosynthese fähig ist, in dem aber andere essentielle Stoffwechselvorgänge ablaufen.
Die Gattung Plasmodium unterscheidet sich von anderen Gattungen der Haemospororida dadurch, dass die Parasiten sich im Blut der Wirbeltiere in Erythrozyten ungeschlechtlich durch eine Vielfachteilung, die sogenannte Schizogonie, vermehren, während andere Parasiten dort nur Gametozyten ausbilden. Bei der Schizogonie entwickelt sich in den Erythrozyten aus einem erst ringförmigen, später amöboiden Trophozoiten ein Schizont mit einer für die jeweilige Art typischen Zahl von Merozoiten, die am Ende ins Blut freigesetzt werden und dort weitere Erythrozyten infizieren. Ein weiteres Merkmal, das die Plasmodien von vielen anderen Haemospororida unterscheidet, ist die Bildung eines Pigments in den Erythrozyten, dem sogenannten Hämozoin. Dieses Pigment ist ein Abbauprodukt des Hämoglobins, das durch eine unvollständige Verdauung durch die Parasiten entsteht. Die Plasmodien ernähren sich in den Erythrozyten im Wesentlichen von Hämoglobin und Glucose.
- Entwicklungsformen verschiedener Plasmodienarten
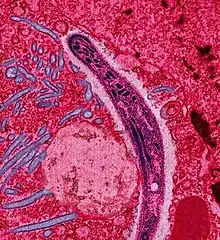 Spindelförmiger Plasmodium-Sporozoit in Darm-Epithelzellen von Anopheles stephensi. Falschfarben-EM-Aufnahme
Spindelförmiger Plasmodium-Sporozoit in Darm-Epithelzellen von Anopheles stephensi. Falschfarben-EM-Aufnahme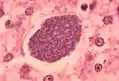 Histopathologie der exoerythrozytären Form eines Plasmodium-Parasiten in der Leber.
Histopathologie der exoerythrozytären Form eines Plasmodium-Parasiten in der Leber.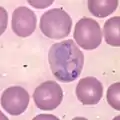 Trophozoit von P. vivax im Blutausstrich
Trophozoit von P. vivax im Blutausstrich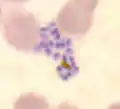 Aufplatzender Schizont von P. falciparum im Blutausstrich. Einzelne Merozoiten erkennbar.
Aufplatzender Schizont von P. falciparum im Blutausstrich. Einzelne Merozoiten erkennbar.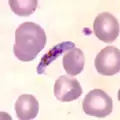 Sichelförmiger Gametozyt von P. falciparum im Blutausstrich.
Sichelförmiger Gametozyt von P. falciparum im Blutausstrich.
Verbreitung und Wirte
Plasmodien kommen mit Ausnahme der Polarregionen auf allen Kontinenten vor. Infiziert werden verschiedene Säugetiere, Vögel und Reptilien. Die Vektoren sind fast ausschließlich weibliche Stechmücken, andere Vektoren wurden lediglich bei Reptilien infizierenden Arten gefunden.
Säugetiere infizierende Plasmodien
Eine Vielzahl von Säugetieren werden von Plasmodien infiziert, vor allem Primaten und Nagetiere. Bei anderen Säugetieren sind Plasmodien sehr selten. Die meisten Parasiten zeigen eine hohe Wirtsspezifität. Ihr Verbreitungsgebiet sind heute die Tropen und Subtropen; allerdings war die Malaria beim Menschen bis ins 20. Jahrhundert auch in Europa und Nordamerika verbreitet.
Eine Monographie aus dem Jahr 1971 nennt 24 beschriebene Arten, die Primaten (ohne Lemuren) infizieren.[1] Die klassischen Malariaerreger beim Menschen sind Plasmodium falciparum, Plasmodium malariae, Plasmodium ovale und Plasmodium vivax. Für diese Arten wird der Mensch als einziges epidemiologisch relevantes Reservoir angesehen. Aber auch Plasmodium knowlesi, ein Malariaerreger bei Makaken in Südostasien, ist als Krankheitserreger beim Menschen von Bedeutung. Weitere Erreger von Affenmalaria, die den Menschen infizieren können, ohne medizinische Bedeutung zu haben, sind P. brasilianum, P. cynomolgi und P. inui. Zu den Malariaerregern des Menschen gibt es teils nah verwandte, teils praktisch identische Erreger in Affen, so P. falciparum und das Schimpansen infizierende P. reichenowi, P. malariae und das brasilianische Neuweltaffen infizierende P. brasilianum sowie P. vivax und das ebenfalls brasilianische Neuweltaffen infizierende P. simium.
Neben diesen wegen ihrer medizinischen Bedeutung umfassend beschriebenen Plasmodien der Primaten gibt es eine Reihe weiterer, teils wenig untersuchter Arten aus der Untergattung Vinckeia mit im Jahr 1978 21 beschriebenen Arten.[2] Diese infizieren etliche zu den Mäuseartigen, Gleithörnchen und Stachelschweinen zählende Nagetierarten, ferner Fledermäuse und Lemuren. Auch einige wenige Wiederkäuer werden befallen, so der Wasserbüffel, der Ducker, das Hirschferkel und der Weißwedelhirsch.[3] Verschiedene afrikanische Dickichtratten und Akazienmäuse infizierende Plasmodien sind seit den 1950er Jahren wichtige Modellorganismen für die Malariaforschung, da mit P. berghei, P. chabaudi und P. yoelii im Labor auch die Hausmaus, teilweise auch die Laborratte infiziert werden kann. Als Krankheitserreger bei Haus- und Nutztieren spielt keine der Säugetiere infizierenden Plasmodien eine Rolle.
Die Säugetiere infizierenden Plasmodien werden ausschließlich durch weibliche Stechmücken der Gattung Anopheles übertragen.
Vögel infizierende Plasmodien
Plasmodien sind Erreger der Vogelmalaria bei einer Vielzahl von Vogelarten weltweit. Die Wirtsspezifität vieler Arten ist oft deutlich geringer als bei den Säugetiere infizierenden Plasmodien, manche Parasiten können Dutzende von verschiedenen Vogelarten infizieren. Vogelplasmodien sind auf allen Kontinenten verbreitet. Die meisten Infektionen von Wildvögeln sind leicht und verlaufen symptomlos. Allerdings können beispielsweise Infektionen durch das weit verbreitete Plasmodium relictum zu zahlreichen Todesfällen führen. Eine Monografie aus dem Jahr 2005 nennt 38 beschriebene Arten, die Vögel infizieren.[4]
In der Geflügelzucht in tropischen Ländern kann die Geflügelmalaria, hervorgerufen durch P. gallinaceum, P. juxtanucleare und P. durae, zu hohen Verlusten bei Hühnern oder Truthühnern führen.[5] Vögel infizierende Plasmodien waren lange Zeit wichtige Modelle für die Malariaforschung. Ronald Ross identifizierte 1898 den Lebenszyklus der Plasmodien in Stechmücken am Beispiel eines Vogelparasiten. Bis in die 1940er Jahre waren verschiedene Vögel infizierende Plasmodien wichtige Modellorganismen für die Erforschung von neuen Arzneimitteln zur Behandlung der Malaria beim Menschen.[6]
Vögel infizierende Plasmodien werden überwiegend von Mücken der Gattungen Culex, Culiseta und Aedes, teilweise auch durch Anopheles, Psorophora, und Mansonia übertragen.
Reptilien infizierende Plasmodien
Viele verschiedene Plasmodienarten infizieren Reptilien. Die weitaus meisten Wirte dieser Parasiten sind Echsen, lediglich drei Arten wurden bei Schlangen gefunden. Die Wirtsspezifität ist hoch. Eine Literaturübersicht aus dem Jahr 1988 nennt 69 beschriebene Arten.[7] Die meisten Arten wurden in Lateinamerika und Afrika gefunden, einige wenige auch in den USA, in Südostasien, Australien und Neuseeland.
Für viele dieser Parasiten sind die Vektoren nicht bekannt. Neben Stechmücken wie Culex, die beispielsweise P. floridense übertragen, wurden auch andere Zweiflügler als Vektoren untersucht. So konnte gezeigt werden, dass P. mexicanum von Sandmücken der Gattung Lutzomyia übertragen werden kann.
Lebenszyklus
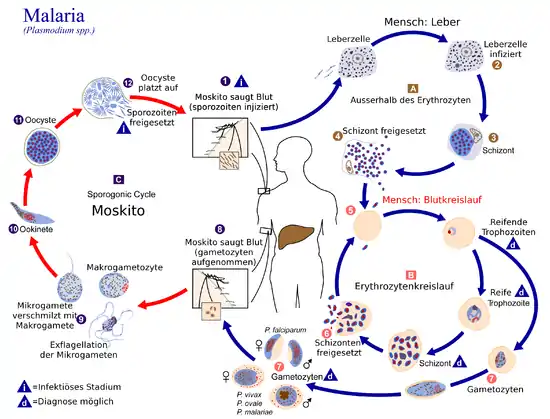
Alle Plasmodien haben einen komplexen Lebenszyklus mit einem obligaten Wirtswechsel zwischen Insekten, in denen eine geschlechtliche Vermehrung stattfindet, und Wirbeltieren, in denen eine ungeschlechtliche Vermehrung stattfindet. Dabei ist in den Wirbeltieren eine erste, meist symptomlose Phase der exoerythrozytären Vermehrung im Gewebe von einer zweiten, von Krankheitserscheinungen begleiteten Vermehrungsphase in den Erythrozyten im Blut zu unterscheiden.
Vermehrung im Wirbeltier: Exoerythrozytäre Phase
Der Lebenszyklus beginnt mit Sporozoiten, die durch infizierte Stechmücken mit dem Speichel in den Körper eines Wirbeltiers gelangen. Die spindelförmigen Sporozoiten dringen in Wirtszellen ein und vermehren sich zuerst im Gewebe in einer exoerythrozytären Phase durch Schizogonie. Bei Säugetieren werden die Parasiten durch die Mücke in die Dermis injiziert, von dort wandern sie aktiv zu Blutgefäßen und werden durch diese innerhalb von Minuten zur Leber transportiert. Dort wandern sie vermutlich über Kupffer-Zellen in Hepatozyten ein, in denen sie sich je nach Art in zwei bis 16 Tagen massiv vermehren.[8] Bei Primaten können Gewebeschizonten über 80 Mikrometer groß werden und mehrere zehntausend Merozoiten enthalten. Einige der Plasmodium-Arten können Ruheformen in der Leber ausbilden, sogenannte Hypnozoiten, aus denen nach Abheilung der Krankheit Rückfälle entstehen können. Dies ist beispielsweise für P. cynomolgi, P. fieldi, P. ovale, P. simiovale und P. vivax bekannt. Vogelparasiten und Reptilienparasiten werden in dieser Phase in einer Reihe von Geweben gefunden. Der Vogelparasit P. relictum beispielsweise vermehrt sich exoerythrozytär in der Haut, der Leber, der Milz und im Knochenmark. Andere Arten, auch Reptilien infizierende wie P. mexicanum, wurden in Endothelzellen und in hämatopoietischen Zellen gefunden. Bei vielen Vogel- und Reptilienparasiten ist allerdings der Ort der exoerythrozytären Vermehrung nicht bekannt. Bei Säugetieren ist die exoerythrozytäre Phase in der Regel symptomlos, bei Vogelparasiten kann es schon in diesem Stadium zu schweren Erkrankungen kommen. So kann ein massiver Befall des Knochenmarks mit P. elongatum ebenso zu Todesfällen führen wie eine exoerythrozytäre Schizogonie von P. gallinaceum im kapillaren Endothel verschiedener Organe, insbesondere des Gehirns.
Vermehrung im Wirbeltier: Erythrozytäre Phase
Die Gewebeschizonten produzieren jeweils große Zahlen von kleinen Merozoiten, die freigesetzt werden und in einer zweiten Phase der Infektion im Blut Erythrozyten befallen, in denen eine weitere ungeschlechtliche Vermehrung durch Schizogonie stattfindet. Diese Vermehrung im Blut, die je nach Art einen bis drei Tage dauert, ist ursächlich für die Krankheitssymptome der Malaria. In Primaten findet die Vermehrung in dieser Phase oft synchronisiert statt, sodass viele reife Blutschizonten gleichzeitig Merozoiten freisetzen, was von der Ausschüttung toxischer Substanzen begleitet wird. Dies führt zur bekannten Periodizität der Fieberschübe bei der Malariaerkrankung. Bei anderen Säugetieren und bei Vögeln ist die Synchronizität der Entwicklung weniger ausgeprägt, bei Reptilien gar nicht zu beobachten.
Einige wenige Plasmodien entwickeln sich in den Erythrozyten zu Geschlechtsformen, den Gametozyten. Diese sind essentiell, um den Lebenszyklus zu vollenden und die weitere Verbreitung durch Mücken zu ermöglichen.
Vermehrung in den Insekten
Die Gametozyten können von Mücken bei einer Blutmahlzeit aufgenommen werden und im Darm des Insekts einen neuen Entwicklungszyklus in Gang setzen.[9] Die Mikrogametozyten teilen sich im Darm der Mücke in einem Exflagellation genannten Vorgang innerhalb weniger Minuten zu Mikrogameten, die eine einzelne Geißel tragen und entsprechend beweglich sind. Durch die Verschmelzung eines Mikrogameten mit einem Makrogameten wird eine Zygote gebildet, in der anschließend eine meiotische Teilung stattfindet. Die Zygote entwickelt sich im Darm zu einem beweglichen Ookineten, der sich in der Darmwand zu einer Oozyste umwandelt. In dieser werden je nach Art und Temperatur innerhalb zirka einer bis vier Wochen durch vielfache Zellteilung viele neue Sporozoiten gebildet. Diese wandern schließlich in die Speicheldrüse der Mücke, wobei sie zu hochinfektiösen Formen reifen.[10] Von dort können sie auf einen neuen Wirbeltierwirt übertragen werden.
Molekulare Eigenschaften
Aufgrund der großen medizinischen Bedeutung wurden vor allem die Säugetiere infizierenden Plasmodien intensiv mit Methoden der Molekularbiologie studiert, um neue Ansätze zur Prophylaxe und zur Therapie der Malaria zu erhalten.
Plasmodien haben komplexe Mechanismen entwickelt, um eine erworbene Immunität des Wirtes zu unterlaufen.[11] Dazu zählen in hohem Maße repetitive Proteinsequenzen sowie Mechanismen der Antigenvariabilität, mit denen die Parasiten Antigene auf der Zelloberfläche regelmäßig austauschen. Dies verhindert nicht nur eine vollständige Immunität nach Erkrankungen, sondern erschwert auch die Entwicklung von Impfstoffen.
Der Stoffwechsel der Plasmodien hat eine Reihe von Besonderheiten, die als Angriffspunkte für Arzneistoffe genutzt werden. So hemmen Chloroquin und verwandte Stoffe die Bildung des Hämozoins, Atovaquon und verwandte Stoffe hemmen die mitochondriale Atmung, Folat-Antagonisten wie Proguanil hemmen die Folat-Biosynthese im Zytoplasma und verschiedene Antibiotika wie Tetracycline hemmen Stoffwechselvorgänge im Apicoplasten. Große therapeutische Bedeutung haben derzeit vom Artemisinin abgeleitete Stoffe, die sich alle durch eine Endoperoxidgruppe auszeichnen. Diese Substanzen könnten sowohl über die Generierung freier Radikale als auch über eine Hemmung einer Ca2+-ATPase der Parasiten wirken.[12]
Von einer wachsenden Zahl von Plasmodien wurden vollständige Genomsequenzen bestimmt, so von P. falciparum, P. vivax, P. knowlesi und von verschiedenen Mäusemalariaerregern. Alle bisher untersuchten Genome bestehen aus 14 Chromosomen mit 23–27 Millionen Basenpaaren und ungefähr 5.500 Genen.[13] Die Funktion von fast der Hälfte der Gene ist allerdings unbekannt.
Systematik
Äußere Systematik
In der Systematik der Eukaryoten nach Adl et al. ist die Gattung Plasmodium unmittelbar den Haemospororida untergeordnet.[14] Die einzige andere in dieser Systematik neben Plasmodium erwähnte Gattung Mesnilium parasitiert in Fischen. Die Haemospororida wiederum gehören mit den Piroplasmorida als Schwestergruppe zu den Aconoidasida. Die Unterteilung der Aconoidasida wie bei Adl et al. wird durch verschiedene molekulare Analysen einschließlich der vollständig sequenzierter Genome gestützt.[15] Die Systematik nach Adl et al., 2005 im Überblick:
- Apicomplexa Levine, 1980, emend. Adl et al., 2005
- Aconoidasida Mehlhorn, Peters & Haberkorn, 1980
- Haemospororida Danilewsky, 1885
- Plasmodium Marchiafava & Celli, 1885
- Mesnilium Misra, Haldar & Chakravarty, 1972
- Piroplasmorida Wenyon, 1926
- Haemospororida Danilewsky, 1885
- Aconoidasida Mehlhorn, Peters & Haberkorn, 1980
Allerdings ist die Systematik von Adl et al. unvollständig, da viele seit langem unzweifelhaft den Haemospororida zugeordnete Gattungen nicht erwähnt werden. In älteren Systematiken wurde den Haemospororida die Familie Plasmodiidae mit zehn Gattungen untergeordnet, zu denen neben Plasmodium auch Haemoproteus, Hepatocystis und Leucocytozoon zählen.[16] Diese vier Gattungen machen 95 % aller Arten innerhalb der Haemospororida aus. Die nahe Verwandtschaft dieser Gattungen ist durch molekulare Untersuchungen gut abgesichert,[17] von weiteren Gattungen liegen bisher keine DNA-Sequenzen vor.
Innere Systematik
Traditionell basiert die Taxonomie der Plasmodien auf Morphologie, Lebenszyklus und Wirtsspezifität, eine neue Systematik nach phylogenetischen Kriterien steht aus. Derzeit umfasst die Gattung zirka 200 Arten,[17] die in bis zu 15 Untergattungen unterschieden werden, von denen drei Säugetiere, fünf Vögel und sieben Reptilien infizieren. Diese Systematik nebst medizinisch, tiermedizinisch und für die Forschung bedeutenden Arten hat folgende Struktur:
- Gattung Plasmodium Marchiafava & Celli, 1885
- Untergattung Asiamoeba Telford, 1988 (Echsen)
- Untergattung Bennettinia Valkiūnas, 1997 (Vögel)
- Plasmodium juxtanucleare Versiani & Gomes, 1941; Erreger der Hühnermalaria in Asien, Afrika und Südamerika
- Untergattung Carinamoeba Garnham, 1966 (Echsen)
- Untergattung Garnia Lainson, Landau & Shaw, 1971 (Echsen)
- Untergattung Giovannolaia Corradetti, Garnham & Laird, 1963 (Vögel)
- Plasmodium durae Herman, 1941; Erreger der Malaria bei Truthühnern in Afrika
- Untergattung Haemamoeba Grassi und Feletti, 1890 (Vögel)
- Plasmodium gallinaceum Brumpt, 1935; Erreger der Hühnermalaria in Asien und Afrika
- Untergattung Huffia Corradetti, Garnham & Laird, 1963 (Vögel)
- Untergattung Lacertaemoba Telford, 1988 (Echsen)
- Untergattung Laverania Bray, 1963 (Menschen und Schimpansen)
- Plasmodium falciparum (Welch, 1897); Erreger der Malaria tropica beim Menschen
- Untergattung Novyella Corradetti, Garnham & Laird, 1963 (Vögel)
- Untergattung Ophidiella Garnham, 1966 (Schlangen)
- Untergattung Plasmodium Bray, 1963 emend. Garnham, 1964 (Primaten)
- Plasmodium knowlesi Sinton & Mulligan, 1932; Erreger der Malaria bei Makaken und Menschen in Südostasien
- Plasmodium malariae (Grassi & Feletti, 1890); Erreger der Malaria quartana beim Menschen
- Plasmodium ovale Stephens, 1922; Erreger der Malaria tertiana beim Menschen
- Plasmodium vivax (Grassi & Feletti, 1890); Erreger der Malaria tertiana beim Menschen
- Untergattung Paraplasmodium Telford, 1988 (Echsen)
- Untergattung Sauramoeba Garnham, 1966 (Echsen)
- Untergattung Vinckeia Garnham, 1964 (Säugetiere)
- Plasmodium berghei Vincke & Lips, 1948
- Plasmodium chabaudi Landau, 1965
- Plasmodium yoelii Landau, Michel & Adam, 1968
Die Phylogenese der Plasmodien und anderer Apicomplexa wird seit Jahren mit Methoden der DNA-Sequenzanalyse untersucht, ohne dass sich bisher ein abschließendes Bild ergeben hätte. Nach dem derzeitigen Stand ist die Gattung Plasmodium vermutlich paraphyletisch zur wenig untersuchten Gattung Hepatocystis,[17] obwohl Hepatocystis einen deutlich anderen Lebenszyklus hat und auch von anderen Insekten übertragen wird als Plasmodium.
Innerhalb der Gattung bilden die Säugetiere infizierenden Parasiten zusammen mit Vertretern der Gattung Hepatocystis eine Klade. Es gilt als gesichert, dass der Übergang auf Säugetiere nur einmal in der Evolution erfolgte. Die seit den 1990er Jahren diskutierte These, die Untergattung Laverania mit dem wichtigen Malariaerreger P. falciparum sei in jüngerer Zeit aus einem Vogelmalariaparasiten entstanden, wird nicht mehr vertreten.[17] Die Reptilien und Vögel infizierenden Parasiten bilden zusammen eine weitere Klade, und es gibt Hinweise auf mehrfache Wechsel von Parasiten zwischen Reptilien und Vögeln als Wirt. Bei den Vögel infizierenden Untergattungen sind Haemamoeba, Huffia und Bennettinia vermutlich monophyletisch, Giovannolaia und Novyella dagegen nicht.[18] Insgesamt liegen derzeit noch zu wenige molekulare Daten vor, um die Taxonomie der Plasmodien oder der Haemospororida überhaupt auf dieser Grundlage zu revidieren.
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von Plasmodium sp. nichtnamentlich meldepflichtig nach § 7 Absatz 3 des Infektionsschutzgesetzes (IfSG). Meldepflichtig sind hinsichtlich des Nachweises des Erregers die Labore usw. (§ 8 IfSG).
In der Schweiz ist der positive laboranalytische Befund zu Plasmodium spp. für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Einzelnachweise
- G. Robert Coatney, William E. Collins, McWilson Warren und Peter G. Contacos: The primate malarias. Bethesda: U.S. National Institute of Allergy and Infectious Diseases, 1971. Online.
- R. Killick-Kendrick, W. Peters (Hrsg.): Rodent Malaria. London: Academic Press, 1978. ISBN 0-12-407150-3.
- Garnham PC, Kuttler KL. A malaria parasite of the white-tailed deer (Odocoileus virginianus) and its relation with known species of Plasmodium in other ungulates. In: Proc R Soc Lond B Biol Sci. 1980 Jan 17;206(1165):395-402. PMID 6102388.
- Gediminas Valkiūnas: Avian Malaria Parasites and Other Haemosporidia. Boca Raton: CRC Press, 2005. ISBN 0-415-30097-5.
- The Merck Veterinary Manual: Plasmodium Infection.
- Slater LB. Malarial birds: modeling infectious human disease in animals. In: Bull Hist Med. 2005;79(2):261-94. PMID 15965289.
- Sam R. Telford, Jr.: A Contribution to the Systematics of the Reptilian Malaria Parasites, Family Plasmodiidae (Apicomplexa: Haemospororina). In: Bulletin of the Florida State Museum, Biological Sciences 1988;34(2):67-98.
- Prudêncio M, Rodriguez A, Mota MM.The silent path to thousands of merozoites: the Plasmodium liver stage. In: Nat Rev Microbiol. 2006 4(11):849-856. PMID 17041632.
- Beier JC. Malaria parasite development in mosquitoes. In: Annu Rev Entomol. 1998. 43:519–43. PMID 9444756.
- Matuschewski K. Getting infectious: formation and maturation of Plasmodium sporozoites in the Anopheles vector. In: Cell Microbiol. 2006 8(10), 1547–1556. PMID 16984410.
- Ferreira MU, da Silva Nunes M, Wunderlich G. Antigenic Diversity and Immune Evasion by Malaria Parasites In: Clin. Diagn. Lab. Immuno. 2004, 11(6) S. 987–995. PMID 15539495.
- Fidock DA, Rosenthal PJ, Croft SL, Brun R, Nwaka S. "Antimalarial drug discovery: efficacy models for compound screening." In: Nat Rev Drug Discov. 2004 3(6), 509–520. PMID 15173840.
- Winzeler EA. Malaria research in the post-genomic era. In: Nature 2008 455: 751-756. PMID 18843360.
- Adl SM, Simpson AG, Farmer MA, Andersen RA, Anderson OR, Barta JR, Bowser SS, Brugerolle G, Fensome RA, Fredericq S, James TY, Karpov S, Kugrens P, Krug J, Lane CE, Lewis LA, Lodge J, Lynn DH, Mann DG, McCourt RM, Mendoza L, Moestrup O, Mozley-Standridge SE, Nerad TA, Shearer CA, Smirnov AV, Spiegel FW, Taylor MF. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. In: J Eukaryot Microbiol. 2005 Bd. 52(5):399-451. PMID 16248873.
- Kuo CH, Wares JP, Kissinger JC. The Apicomplexan whole-genome phylogeny: an analysis of incongruence among gene trees. In: Mol Biol Evol. 2008 Dec;25(12):2689-98. PMID 18820254.
- Levine ND. Progress in taxonomy of the Apicomplexan protozoa. In: J Protozool. 1988 Nov;35(4):518-20. PMID 3143826/.
- Martinsen ES, Perkins SL, Schall JJ. A three-genome phylogeny of malaria parasites (Plasmodium and closely related genera): evolution of life-history traits and host switches. In: Mol Phylogenet Evol. 2008 Apr;47(1):261-73. PMID 18248741.
- Martinsen ES, Waite JL, Schall JJ. Morphologically defined subgenera of Plasmodium from avian hosts: test of monophyly by phylogenetic analysis of two mitochondrial genes. In: Parasitology. 2007 Apr;134(Pt 4):483-90. PMID 17147839.
Literatur
- Percy Cyril Claude Garnham: Malaria Parasites and other Haemosporidia. Oxford: Blackwell Scientific Publications, 1966. ISBN 0-632-01770-8.
Weblinks
- Zilversmit, Martine and Susan Perkins. 2008. Plasmodium. Malaria Parasites. Version 05 May 2008. In The Tree of Life Web Project, http://tolweb.org/