Borrelia burgdorferi
Borrelia burgdorferi sensu lato (lat. sensu lato [s. l.] = im weiteren Sinne) ist eine Gruppe eng verwandter Arten der Spirochäten-Gattung Borrelia. Als Erreger der Lyme-Borreliose beim Menschen und bei Hunden gelten vor allem drei Arten: Borrelia burgdorferi sensu stricto (lat. [s. s.] = im engeren Sinne), B. garinii und B. afzelii.[1] Die Benennung geht auf Willy Burgdorfer zurück, der das Bakterium 1982 isolierte.[2] Zum Infektionszyklus des Erregers gehören zwei Wirte: Schildzecken der Gattung Ixodes und kleine Säugetiere. Durch Zeckenstiche infizierte Menschen sind für das Bakterium eine Sackgasse, d. h., beim Menschen endet die Infektkette.
| Borrelia burgdorferi | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
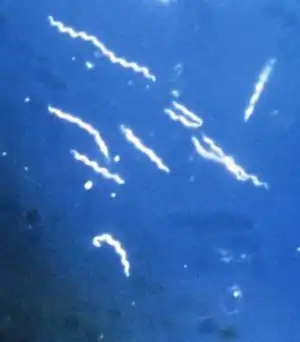
B. burgdorferi bei 400-facher Vergrößerung, Dunkelfeldmikroskopie | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Borrelia burgdorferi | ||||||||||||
| Johnson et al. 1984, Baranton et al. 1992 |
Merkmale
Wie andere Spirochäten ist Borrelia burgdorferi ein aktiv bewegliches, schraubenförmiges, gramnegatives Bakterium mit relativ wenigen Windungen oder Umdrehungen. Es hat einen Durchmesser von etwa 0,3 Mikrometern und kann 10 bis 20 Mikrometer lang werden.[3] Zur Fortbewegung setzt es umhüllte Flagellenbündel ein.[1] Die Zusammensetzung der Zellwand bzw. der äußeren Membran verändert sich je nach Phase des Infektionszyklus.
In In-vitro-Versuchen kann das Bakterium unter bestimmten Bedingungen – zum Beispiel Nährstoffmangel oder Antibiotika-Gaben – seine Gestalt verändern und im Inneren von Säugetierzellen und eventuell auch in der extrazellulären Matrix als kugelige L-Form überleben.[4] L-Form-Bakterien (1935 am Lister Institute entdeckt, daher der Name)[5] haben keine oder defizitäre Zellwände und sind daher schwer zu identifizieren. Die Teilungsfähigkeit und der Einfluss auf die Pathogenese der Borrelia-L-Form in vivo ist umstritten,[6][7][8] in Zellkulturen bleibt die Teilungsfähigkeit erhalten.[9]
Sensu lato und sensu stricto
Als Borrelia burgdorferi s. l. wird eine Reihe nah verwandter Borrelien bezeichnet, die in Zecken und in Säugetieren leben. 2011 umfasste die Gruppe neben einigen noch unbenannten Borrelien die Arten B. afzelii, B. americana, B. andersonii, B. bavariensis, B. bissettii, Borrelia burgdorferi s. s., B. californiensis, B. carolinensis, B. garinii, B. japonica, B. kurtenbachii, B. lusitaniae, B. sinica, B. spielmanii, B. tanukii, B. turdi, B. valaisiana und B. yangtze.[10]
Mindestens drei der Arten führen beim Menschen zur Lyme-Borreliose: Borrelia garinii, B. afzelii und B. burgdorferi sensu stricto. Die Arten rufen leicht unterschiedliche Immunreaktionen und Krankheitsbilder hervor, allerdings ohne klare Abgrenzung. So geht eine Infektion mit B. burgdorferi s. s. häufig mit Arthritis einher, während bei B. garnii neurologische Symptome und bei B. afzelii Hautveränderungen typisch sind. Da der Bakterienstamm B31 der Art B. burgdorferi s. s. als Erster sequenziert wurde, gilt er als Referenz.[1]
Nicht zum Komplex Borrelia burgdorferi sensu lato zählen Borrelien, die andere Erkrankungen hervorrufen, beispielsweise B. recurrentis, der Erreger des Rückfallfiebers.
Verbreitungsgebiete
Borrelia burgdorferi s. l. kommen in Europa, Asien und den USA überall dort vor, wo sowohl ihr Zeckenwirt als auch ihr Säugetierwirt lebt.
In den USA dominiert B. burgdorferi sensu stricto. In Europa sind B. afzelii und B. garinii am häufigsten, wobei sowohl die Durchseuchung der Zecken als auch die Verteilung der Arten regional stark variiert.[11] Alle bekannten europäischen Arten von B. burgdorferi s. l. wurden auch in Deutschland nachgewiesen.
Während B. burgdorferi in den USA vor allem von den Schildzecken Ixodes scapularis (Hirschzecke, Nordosten und mittlerer Westen) und Ixodes pacificus (Westküste) übertragen wird, infizieren sich Menschen in Europa vor allem durch Stiche des Gemeinen Holzbocks (I. ricinus) und in Asien durch Stiche der Taigazecke (Ixodes persulcatus).[1]
Infektionszyklus und Übertragung
Kleine Nagetiere wie Ratten und Mäuse sowie Rotwild sind die Reservoirwirte von Borrelia burgdorferi; sie zeigen im Allgemeinen keine Krankheitssymptome. Schildzecken dienen als Vektoren, d. h., sie übertragen die Bakterien in neue Reservoirwirte. Zecken und Säugetiere sind in vieler Hinsicht (Körpertemperatur, pH-Wert usw.) deutlich unterschiedliche Lebensräume. Um in beiden zu überleben und sich zu vermehren, passt B. burgdorferi ihre Genexpression und damit das Spektrum der synthetisierten Proteine an die jeweilige Umgebung an.
Die Zeckenlarven nehmen die Bakterien mit ihrer ersten Blutmahlzeit an einem infizierten Nagetier auf und übertragen sie nach ihrer Weiterentwicklung zu Nymphen bei ihren nächsten Mahlzeiten auf weitere Wirte. Die Bakterien suchen den Mitteldarm der Nymphen auf, in dem sie sich mithilfe des Lipoproteins OspA in ihrer äußeren Membran festsetzen. Während der ersten Mahlzeit der Nymphe lösen das Blut und die ansteigende Temperatur Veränderungen der Proteinsynthese und eine Chemotaxis aus: Die Borrelien vermehren sich, stellen statt OspA das Lipoprotein OspC her und wandern vom Darm in die Speicheldrüsen. Von dort gelangen sie in ihren nächsten Säugetierwirt. Nach einer erneuten Häutung saugen die nunmehr adulten Zecken ausschließlich das Blut größerer Säugetiere, die keine geeigneten Reservoirwirte für B. burgdorferi und somit Sackgassen in deren Zyklus sind.
Sowohl Nymphen als auch adulte Zecken wählen gelegentlich Menschen für ihre Blutmahlzeiten. Da die kleinen Nymphen schwer zu entdecken sind, dauert ihre Mahlzeit häufig lang genug, um Spirochäten zu übertragen. Sie sind daher der Hauptvektor für die Infektion von Menschen. Die Erkrankung des Menschen geht – anders als bei vielen anderen Bakterieninfektionen – nicht auf Virulenzfaktoren wie Toxine oder spezialisierte Sekretionssysteme zurück, denn B. burgdorferi ist evolutionär nicht an den Befall von Menschen angepasst. Stattdessen lösen bakterielle Produkte, die der Vermehrung und dem Überleben der Borrelien in ihren Reservoirwirten dienen, bzw. die Reaktionen des Immunsystems auf diese Stoffe die Lyme-Borreliose aus.[1]
Genetik
Das Genom des Stamms B31 von B. burgdorferi sensu stricto war das dritte sequenzierte Mikrobengenom überhaupt; die Sequenz wurde 1997 veröffentlicht.[12] Das Genom ist – wie bei vielen obligaten Parasiten, die auf den Stoffwechsel ihrer Wirte angewiesen sind – relativ klein. Zugleich ist es hochkomplex und außergewöhnlich aufgebaut, vermutlich in Anpassung an die stark unterschiedlichen Umweltbedingungen während des Infektionszyklus: Während die meisten Bakterien ein ringförmiges Chromosom sowie ebenfalls ringförmige Plasmide haben, ist das 910 Kilobasenpaare große Chromosom hier linear, ebenso wie viele der 9 bis 62 Kilobasenpaare großen Plasmide,[13] welche zusammen weitere 533.000 Basenpaare aufweisen.[12]
Jedes der linearen Plasmide ist anders aufgebaut. Alle enthalten neben nichtcodierender DNA und Pseudogenen (d. h. durch Mutationen inaktivierten Genen) zahlreiche Kopien paraloger (d. h. durch Duplikation entstandener homologer) Gene. Anzahl und Größe der Plasmide sowie die Anordnung der Gene auf ihnen unterscheiden sich innerhalb des Komplexes B. burgdorferi sensu lato von Art zu Art und von Stamm zu Stamm. All das deutet darauf hin, dass das Genom von B. burgdorferi im Fluss ist.[13]
Sowohl zwischen den Stämmen als auch zwischen den Arten von B. burgdorferi sensu lato gibt es horizontalen Gentransfer. Die Gene werden vermutlich durch Transduktion des Plasmids cp32 ausgetauscht, das ein Prophage ist. Jeder bislang untersuchte Stamm von B. burgdorferi enthält zahlreiche ähnliche cp32-Versionen. Da cp32 zahlreiche Gene für Oberflächen-Lipoproteine wie OspC trägt, die an Proteine im Säugetierwirt binden, bringt die Akkumulation unterschiedlicher cp32-Varianten vermutlich einen Überlebensvorteil mit sich, da die Borrelien so mehrere Säugetierarten besiedeln können. Durch den horizontalen Gentransfer können sich vorteilhafte Mutationen in den Lipoprotein-Genen rasch in den Borrelien-Populationen ausbreiten.[13]
Viele der offenen Leserahmen des Genoms, insbesondere auf den Plasmiden, weisen keine Homologie zu bekannten Genen aus anderen Bakterien auf; die Funktion ihrer Produkte ist oftmals unbekannt. Die meisten bekannten Gene für den Grundstoffwechsel sind auf dem Chromosom, die meisten Gene für Lipoproteine in der äußeren Bakterienmembran dagegen auf Plasmiden angesiedelt. Fast 8 % aller offenen Leserahmen codieren Lipoproteine; viele davon werden nur in bestimmten Phasen des Infektionszyklus exprimiert. So tragen die Borrelien in Zecken-Nymphen, die noch kein Blut gesaugt haben, OspA in der äußeren Zellmembran, um sich im Mitteldarm festzuheften. Bei der ersten Blutmahlzeit der Zecken wird es durch OspC ersetzt, das der Übertragung in ein Säugetier und dem Widerstand gegen dessen angeborene Immunantwort dient. Während der dauerhaften oder persistenten Infektion des Reservoirwirts wird VlsE exprimiert, mit dessen Hilfe die Borrelien sich im Gewebe (z. B. in den Gelenken) des Wirts vor dem Immunsystem verbergen und Nährstoffe aufnehmen können.[13]
Stoffwechsel
B. burgdorferi hat im Lauf der Coevolution mit seinen Wirten die Fähigkeit eingebüßt, selbst Aminosäuren, Nukleotide, Fettsäuren und Enzym-Cofaktoren herzustellen, und nimmt die benötigten Kohlenwasserstoffe, Peptide und Aminosäuren stattdessen aus dem Wirt auf. Energie gewinnt das Bakterium durch Glykolyse (Abbau von Einfachzuckern) und Milchsäuregärung (Fermentation von Zuckern zu Milchsäure); für den Citratzyklus oder die oxidative Phosphorylierung fehlen ihm die nötigen Gene. Wegen ihres eingeschränkten Stoffwechsels ist B. burgdorferi nur in reichhaltigen, nicht klar definierten Nährmedien zu kultivieren, die aus seinen Wirten gewonnen werden.[13]
Wie andere Borrelien auch kommt B. burgdorferi ohne Eisen aus; in ihren Metalloenzymen wird als Cofaktor stattdessen Mangan verbaut. Nur so kann das Bakterium in einer phasenweise sehr eisenarmen Umgebung in seinen Wirten überleben.[14] Gut 6 % der chromosomalen Gene codieren Produkte, die zur Beweglichkeit und Chemotaxis der Bakterien beitragen und es ihnen so ermöglichen, in jeder Phase des Infektionszyklus die richtige Nische in ihren Wirten aufzusuchen.[1]
Immunreaktion und Persistenz
An der Immunreaktion der Säugetiere auf eine Borrelien-Infektion beteiligen sich sowohl die angeborene Abwehr (insbesondere das Komplementsystem) als auch die erworbene Abwehr (insbesondere die humorale Immunantwort, also von Plasmazellen produzierte spezifische Antikörper – weniger die zelluläre Immunantwort). Beide Formen der Abwehr dämmen die Zahl der Bakterien ein, können sie aber nicht auslöschen. Ebenso kann man sich mehrmals mit B. burgdorferi infizieren.[15]
Diese Persistenz der Infektion geht vermutlich auf mehrere Mechanismen zurück. Zum einen können die Bakterien im Bindegewebe überdauern, wo sie zwischen den extrazellulären Kollagenfasern für das Immunsystem schwer zu erreichen sind. In Experimenten drangen sie auch in Fibroblasten ein und überlebten in deren Innerem, aber in vivo ist eine solche Internalisierung selten.[16] Zum anderen verändern die Bakterien im Zuge einer Immunevasion von Generation zu Generation ihre Oberflächen-Lipoproteine und damit ihre Antigenstruktur, so dass sie von den spezifischen Antikörpern schlecht erkannt werden. Die Antigen-Variation kommt durch Genkonversion im vlsE-Genort zustande, eine nicht reziproke Form der homologen Rekombination, durch die Teile der DNA-Sequenz in diesem Gen immer wieder neu angeordnet werden. Die Genkonversion wird durch ein noch unbekanntes Signal im Reservoirwirt ausgelöst; in Borrelien-Kulturen und in den Zecken findet sie nicht statt.[13] Die Bildung von langlebigen antikörperproduzierenden B-Zellen ist schwach ausgeprägt und verzögert.[17]
Im Tierversuch wird die ursprüngliche vlsE-Sequenz innerhalb von 28 Tagen nach Beginn der Infektion vollständig durch neue Varianten ersetzt; rekombinante B. burgdorferi haben also einen starken Selektionsvorteil gegenüber dem Ausgangs-Klon.[13] In immundefizienten Mäusen variieren die vslE-Sequenzen langsamer als in immunkompetenten Mäusen; der Selektionsdruck wird demnach von VslE-spezifischen Antikörpern vermittelt, die an neue Varianten schlechter binden.[1]
Polymorphismus
Von einigen Genen und Genprodukten, die für die Infektion und die Persistenz (also das Überdauern) in den Säugetier-Wirten wichtig sind, wurden zahlreiche Varianten nachgewiesen. So gibt es allein im Nordosten der USA 16 Haupt-Allele des ospC-Gens. Dieser Polymorphismus, der den Borrelien das Überleben in unterschiedlichen Wirten sowie in unterschiedlichen Nischen innerhalb eines Wirts erleichtert, wird durch balancierte Selektion erhalten.
Zwei einander ergänzende Mechanismen sorgen für den Erhalt dieser Vielfalt. Zum einen verschafft die Immunreaktion der Wirte den selteneren Varianten einen Selektionsvorteil, denn ein bereits von Borrelien befallener Wirt ist durch die Reaktion seiner erworbenen Abwehr gegen weitere Borrelien mit demselben ospC-Allel immun. Ein Stamm mit einem anderen ospC-Allel kann den Wirt aber noch infizieren. Zum anderen sorgt die heterogene Umwelt der Borrelien in den verschiedenen Wirten und Zyklusphasen dafür, dass keines der Allele unter allen Bedingungen die größte Fitness hat. Je nach Nische, also nach Wirtsart und -gewebe, ist eine andere OspC-Variante von Vorteil. Dieser Polymorphismus erschwert, ebenso wie die Genkonversion, die Entwicklung eines wirksamen Impfstoffs gegen B. burgdorferi.[13]
Literatur
- D Scott Samuels, Justin D Radolf: Borrelia: Molecular Biology, Host Interaction and Pathogenesis. Caister Academic Press, Norfolk UK 2010, ISBN 978-1-904455-58-5, Chapter 6: Structure, Function and Biogenesis of the Borrelia Cell Envelope.
Einzelnachweise
- K. Tilly, P. A. Rosa, P. E. Stewart: Biology of infection with Borrelia burgdorferi. In: Infectious disease clinics of North America. Band 22, Nummer 2, Juni 2008, S. 217–34, v, ISSN 0891-5520, doi:10.1016/j.idc.2007.12.013, PMID 18452798, PMC 2440571 (freier Volltext) (Review).
- W. Burgdorfer, A. G. Barbour, S. F. Hayes, J. L. Benach, E. Grunwaldt, J. P. Davis: Lyme disease-a tick-borne spirochetosis? In: Science Band 216, Nummer 4552, Juni 1982, S. 1317–1319, ISSN 0036-8075, PMID 7043737.
- M. A. Motaleb, L. Corum, J. L. Bono u. a.: Borrelia burgdorferi periplasmic flagella have both skeletal and motility functions. In: Proceedings of the National Academy of Sciences. Band 27, Nummer 20, September 2000, S. 10899–904, ISSN 0027-8424, doi:10.1073/pnas.200221797, PMID 10995478. PMC 27121 (freier Volltext).
- Ø. Brorson, S. H. Brorson, J. Scythes u. a.: Destruction of spirochete Borrelia burgdorferi round-body propagules (RBs) by the antibiotic tigecycline. In: Proceedings of the National Academy of Sciences, Band 106, Nummer 44, November 2009, S. 18656–61, ISSN 0027-8424, doi:10.1073/pnas.0908236106, PMID 19843691, PMC 2774030 (freier Volltext).
- E. Klieneberger: The natural occurrence of pleuropneumonia like organisms in apparent symbiosis with Streptobacillus moniliformis and other bacteria. In: J Pathol Bacteriol. (1935), Band 40, S. 93–105.
- G. P. Wormser, R. J. Dattwyler, E. D. Shapiro, J. J. Halperin, A. C. Steere, M. S. Klempner, P. J. Krause, J. S. Bakken, F. Strle, G. Stanek, L. Bockenstedt, D. Fish, J. S. Dumler, R. B. Nadelman: The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. In: Clinical Infectious Diseases. Band 43, Nummer 9, November 2006, S. 1089–1134, ISSN 1537-6591, doi:10.1086/508667, PMID 17029130.
- J. Miklossy, S. Kasas, A. D. Zurn, S. McCall, S. Yu, P. L. McGeer: Persisting atypical and cystic forms of Borrelia burgdorferi and local inflammation in Lyme neuroborreliosis. In: Journal of neuroinflammation. Band 5, 2008, S. 40, ISSN 1742-2094, doi:10.1186/1742-2094-5-40, PMID 18817547, PMC 2564911 (freier Volltext).
- P. M. Lantos, P. G. Auwaerter, G. P. Wormser: A systematic review of Borrelia burgdorferi morphologic variants does not support a role in chronic Lyme disease. In: Clinical Infectious Diseases. Band 58, Nummer 5, März 2014, S. 663–671, ISSN 1537-6591, doi:10.1093/cid/cit810, PMID 24336823, PMC 3922218 (freier Volltext).
- O. Brorson, S. H. Brorson: Transformation of cystic forms of Borrelia burgdorferi to normal, mobile spirochetes. In: Infection. Band 25, Nummer 4, 1997 Jul-Aug, S. 240–246, ISSN 0300-8126, PMID 9266264.
- N. Rudenko, M. Golovchenko u. a.: Updates on Borrelia burgdorferi sensu lato complex with respect to public health. In: Ticks and Tick-Borne Diseases Band 2, Nr. 3, September 2011, S. 123–128, ISSN 1877-959X, doi:10.1016/j.ttbdis.2011.04.002, PMID 21890064, PMC 3167092 (freier Volltext).
- C. Rauter, T. Hartung: Prevalence of Borrelia burgdorferi sensu lato genospecies in Ixodes ricinus ticks in Europe: a metaanalysis. In: Applied and environmental microbiology. Band 71, Nummer 11, November 2005, S. 7203–16, ISSN 0099-2240, doi:10.1128/AEM.71.11.7203-7216.2005, PMID 16269760, PMC 1287732 (freier Volltext).
- C. M. Fraser, S. Casjens, W. M. Huang, G. G. Sutton, R. Clayton, R. Lathigra, O. White, K. A. Ketchum, R. Dodson, E. K. Hickey, M. Gwinn, B. Dougherty, J. F. Tomb, R. D. Fleischmann, D. Richardson, J. Peterson, A. R. Kerlavage, J. Quackenbush, S. Salzberg, M. Hanson, R. van Vugt, N. Palmer, M. D. Adams, J. Gocayne, J. Weidman, T. Utterback, L. Watthey, L. McDonald, P. Artiach, C. Bowman, S. Garland, C. Fuji, M. D. Cotton, K. Horst, K. Roberts, B. Hatch, H. O. Smith, J. C. Venter: Genomic sequence of a Lyme disease spirochaete, Borrelia burgdorferi. In: Nature. Band 390, Nummer 6660, Dezember 1997, S. 580–586, ISSN 0028-0836, doi:10.1038/37551, PMID 9403685.
- D. Brisson, D. Drecktrah u. a.: Genetics of Borrelia burgdorferi. In: Annual review of genetics. Band 46, 2012, S. 515–536, ISSN 1545-2948, doi:10.1146/annurev-genet-011112-112140, PMID 22974303, PMC 3856702 (freier Volltext) (Review).
- J. E. Posey, F. C. Gherardini: Lack of a role for iron in the Lyme disease pathogen. In: Science. Band 288, Nummer 5471, Juni 2000, S. 1651–1653, ISSN 1095-9203, doi:10.1126/science.288.5471.1651, PMID 10834845.
- J. Nowakowski, I. Schwartz, R. B. Nadelman, D. Liveris, M. Aguero-Rosenfeld, G. P. Wormser: Culture-confirmed infection and reinfection with Borrelia burgdorferi. In: Annals of Internal Medicine. Band 127, Nummer 2, Juli 1997, S. 130–132, ISSN 0003-4819, PMID 9230002.
- J. Wu, E. H. Weening u. a.: Invasion of eukaryotic cells by Borrelia burgdorferi requires β1 integrins and Src kinase activity. In: Infection and Immunity. Band 79, Nummer 3, März 2011, S. 1338–1348, ISSN 1098-5522, doi:10.1128/IAI.01188-10, PMID 21173306, PMC 3067508 (freier Volltext).
- C. J. Hastey, R. A. Elsner, S. W. Barthold, N. Baumgarth: Delays and diversions mark the development of B cell responses to Borrelia burgdorferi infection. In: Journal of Immunology (Baltimore, Md. : 1950). Band 188, Nummer 11, Juni 2012, S. 5612–5622, ISSN 1550-6606, doi:10.4049/jimmunol.1103735, PMID 22547698, PMC 3358496 (freier Volltext).