Influenzaimpfstoff
Ein Influenzaimpfstoff (synonym Grippeimpfstoff) ist ein Impfstoff gegen das Influenzavirus. Influenzaimpfstoffe werden zur Grippeimpfung (Influenzaimpfung) eingesetzt.
Eigenschaften
Influenzaimpfstoffe sind gereinigte Antigene, Spaltimpfstoffe, inaktivierte Viren oder attenuierte Viren. Aufgrund der vergleichsweise hohen genetischen Variabilität durch Antigenshift und Antigendrift (als Mechanismen der Immunevasion) der Influenzaviren sind die in einem Impfstoff wirksamen Epitope oftmals nicht in den Influenzaviren der folgenden Saison vorhanden. Daher ist die Wirksamkeit der zugelassenen Influenzaimpfstoffe auf Viren begrenzt, die dem Impfstamm ähneln, und es besteht nur eine geringe Immunität gegen andere Influenzastämme. Weiterhin gibt das Paul-Ehrlich-Institut jedes Jahr gemäß den aktuellen Empfehlungen der Weltgesundheitsorganisation und des Ausschusses für Humanarzneimittel bei der Europäischen Arzneimittelagentur aktuelle Referenzstämme für saisonale Influenzaimpfstoffe in Deutschland heraus, auf deren Grundlage die Impfstoffherstellung angepasst wird. Aufgrund der Variabilität ändern sich diese Empfehlungen nahezu in jedem Jahr, bezüglich eines oder mehrerer Stämme. Die Referenzstämme umfassen für die üblichen dreiwertigen (trivalenten) Impfstoffe zwei Influenza-A-Viren und ein Influenza-B-Virus, für vierwertige (quadrivalente, tetravalente) Impfstoffe ein zweites Influenza-B-Virus. Dagegen enthalten pandemische Influenzaimpfstoffe wie diejenigen gegen eine hochpathogene Variante des Influenza-A-Virus H5N1, als Auslöser der Vogelgrippe H5N1, oder gegen den Stamm A/California/7/2009 (H1N1)pdm09 des Influenza-A-Virus H1N1, als Auslöser der Pandemie H1N1 2009/10, nur einen Impfstamm. Da die ursprünglich pandemischen H1N1-Virusstämme seit 2010 (mit der üblichen Variabilität) weltweit als saisonale Grippe zirkulieren, gehören sie seit 2010 zu den Referenzstämmen für saisonale Influenzaimpfstoffe. Influenza-Impfstoffe befinden sich auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.[1]
Immunologie
Influenzaimpfstoffe erzeugen neutralisierende Antikörper, die eine erneute Infektion von Zellen mit demselben Virusstamm verhindern.[2] In geringem Umfang sind diese Antikörper kreuzreaktiv mit anderen Influenzastämmen.[3] Die Antikörper werden vor allem gegen das humoral immundominante Hämagglutinin und die Neuraminidase gebildet. Diese Antikörper können im Zuge einer virologischen Diagnostik zur Bestimmung des Titers im Geimpften oder des Impfstoff-Serotyps verwendet werden. Gereinigte Antigene, gespaltene oder inaktivierte Influenzaimpfstoffe werden nicht in Zellen aufgenommen, weshalb keine ausgeprägte zelluläre Immunantwort entsteht.[4]
Nebenwirkungen
Unerwünschte Arzneimittelwirkungen von Influenzaimpfstoffen umfassen Schmerzen und Schwellung an der Einstichstelle und eintägiges Fieber.[5] Der Schweinegrippeimpfstoff Pandemrix in der von 2009 bis 2010 verabreichten Zusammensetzung konnte vermutlich, in seltenen Fällen, zu Narkolepsie führen, während die Konkurrenz-Impfstoffe wie Focetria nicht betroffen waren.[6][7][8]
Herstellung des Impfstoffs
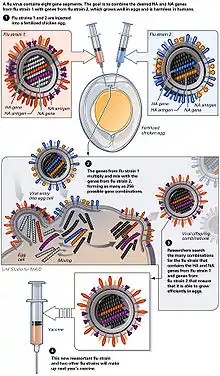
Nährmedien
Die Anzucht und Vermehrung der Viren zur Grippeimpfung erfolgt in unterschiedlichen Medien:
Hühnereier
Die Vermehrung des Virus erfolgt derzeit überwiegend in speziellen bebrüteten Hühnereiern, den „specific pathogen free eggs“, deren Alter 10–11 Tage beträgt. Im Februar des jeweiligen Jahres entscheidet die WHO über die Zusammensetzung des saisonalen Winter-Impfstoffes. Das sogenannte „Saatvirus“ der ausgewählten Virusstämme wird an die Hersteller gesandt. Der Hersteller führt, um optimale Ausbeuten zu erhalten, eine HG(High-Growth)-Reassortierung durch. Diese dauert ungefähr sechs Wochen. Das Influenzavirus vermehrt sich in der Chorio-Allantois-Membran. Die mit dem Influenzavirus beimpften (inokulierten) Eier werden drei Tage bei 32 °C bebrütet (inkubiert). In diesem Zeitraum vermehrt sich das Virus sehr stark. Die Eier werden geöffnet, und pro Ei werden 6–7 ml virushaltige Allantois-Flüssigkeit geerntet. Allerdings hat diese Art der Produktion Nachteile: Die Herstellung des Impfstoffes dauert ca. 6 Monate, der fertige Impfstoff liegt im Juni/Juli vor und wird jährlichen klinischen Studien unterzogen. Im Fall einer Influenza-Pandemie ist die großtechnische Produktion in Eiern durch den Bedarf an Millionen von Eiern nicht zu realisieren, da die Planung der hierfür nötigen logistischen Kapazitäten etwa 2 Jahre im Voraus benötigt. Zudem erfordern Ei-Impfstoffe eine komplizierte Aufreinigung und verursachen Nebenwirkungen, bei denen Ei-Protein-Allergien ein besonderes Problem darstellen. Ein weiteres Manko ist die Anfälligkeit des Produktionsprozesses für Kontaminationen und der deshalb nötige Einsatz großer Mengen Antibiotika. Pandemische Influenza-Stämme sind zudem sehr aggressiv; insbesondere Stämme aviären Ursprungs lassen sich nicht auf Hühner-Embryonen vermehren.
Zellkulturen
Eine Alternative ist die Produktion des Impfstoffs in Vero-Zellen oder MDCK-Zellen (englisch Madin-Darby Canine Kidney cells).[9] Die Vorteile dieser Technologie liegen in der Kürze des Produktionsprozesses (durch Wegfallen der HG-Reassortierung) und den großen Produktionskapazitäten. Hierdurch kann auf schnell ansteigenden Bedarf kurzfristig reagiert werden. Die Kultivierung von Vero-Zellen erfolgt großtechnisch in Bioreaktoren mit einigen 1000 Litern Fassungsvermögen. Pandemische Stämme können mit hohen Ausbeuten vermehrt werden. Die Steriltechnik (Technik unter dem Gesichtspunkt der Sterilisierbarkeit und Reinigbarkeit der Anlagen, wie auch dem Rückhaltevermögen gegenüber Mikroorganismen oder biologisch aktiven Wirkstoffen) ermöglicht ein sicheres Design der Produktionsstätte. Das Hantieren mit pandemischen Influenzastämmen erfordert die Biologische Schutzstufe 3 (BSL-3; Bio safety level), welche für Ei-Facilities aufgrund des Prozessablaufes (schwierig zu automatisieren) nicht zu realisieren ist. Der von der Industrie zur Verfügung gestellte Grippeimpfstoff deckt gerade den durchschnittlich zu erwartenden jährlichen Verbrauch ab, sodass die WHO am 19. August 2005 für den Fall einer neuerlichen Pandemie ernsthafte Bedenken bezüglich einer drohenden Unterversorgung zum Ausdruck brachte.[10]
Experimentelle Verfahren
Erforscht wird beispielsweise die Herstellung des Grippeimpfstoffes mit Hilfe von Wimperntierchen. Die Methode soll schneller und risikoärmer sein als der bisherige Standard.[11][12]
Tot- und Lebendimpfstoffe
Je nach Art der weiteren Impfstoffzubereitung unterscheidet man wie bei Impfstoffen gegen andere Erreger auch beim Influenzaimpfstoff zwischen Totimpfstoffen und Lebendimpfstoffen.
Totimpfstoffe
Totimpfstoffe unterscheiden sich in der Zusammensetzung viraler Proteine, im Antigengehalt und der Art der eingesetzten Adjuvanzien.[13] Sie werden unterteilt in:
- Inaktivierte Ganzpartikelimpfstoffe (auch: Vollvirusimpfstoff): Inaktivierung (Abtötung) der Viren mittels chemischer Stoffe/Stoffkombinationen, z. B. Formaldehyd, beta-Propiolacton und Psoralen. Die Virushülle bleibt dabei erhalten.
- (Inaktivierte) Teilpartikelimpfstoffe (auch: Spaltimpfstoff): Zerstörung (Spaltung) der Virushülle mit Detergentien oder starken organischen Lösungsmitteln. Die Viren können auch zusätzlich mit chemischen Stoffen inaktiviert (abgetötet) werden.
- Untereinheitimpfstoffe: die Oberfläche wird vollständig aufgelöst und spezifische Komponenten (Hämagglutinin- und Neuraminidase-Proteine) herausgereinigt. Eine andere Möglichkeit besteht darin, die Untereinheiten rekombinant herzustellen. Untereinheitimpfstoffe sind nur wenig immunogen, besitzen dafür aber geringe Nebenwirkungen.
Sogenannte „Hochdosis-Impfstoffe“ zählen zu den Spaltimpfstoffen und enthalten die vierfache Menge an Hämagglutinin-Antigen (60 µg), die Kultivierung der Viren erfolgte in Hühnereiern.[13]
Lebendimpfstoffe
Bei der Herstellung von Lebendimpfstoffen gegen Influenzaviren werden Viren verwendet, die zwar attenuiert, aber noch vermehrungsfähig („vital“) sind: (englisch Live Attenuated Influenza Vaccine, LAIV ‚lebend-attenuierte Influenzaimpfstoffe‘). Hier wird unterschieden in
- kälte-adaptierte Stämme: diese Stämme sind nur bei Temperaturen um 25 °C zu Vermehrung fähig, was die Viren auf die oberen Atemwege beschränkt. Durch die fehlende Replikation in den unteren Atemwegen entwickeln sich nur milde Symptome, keine vollständige Influenza. Ein Beispiel ist der Stamm A/Leningrad/134/47/57 (H2N2)
- temperatur-sensitive Stämme: die Replikation dieser Stämme ist auf einen Temperaturbereich von 38–39 °C limitiert, es kommt auch hier nicht zum Befall der unteren Atemwege.
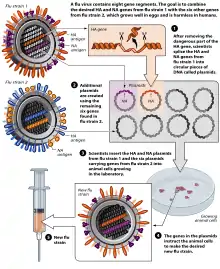
Diese Impfstoffe werden intranasal angewendet. Ihr Vorteil gegenüber den bisher gebräuchlichen Totimpfstoffen ist, dass die vitalen Viren das Immunsystem länger stimulieren und nicht nur eine humorale Immunantwort, sondern auch eine zelluläre Immunantwort bewirkt wird. Der Nachteil von Influenzaimpfstoffen aus noch vermehrungsfähigen Erregern ist, dass die Nebenwirkungen häufiger oder schwerer sind.[14][15][16] So musste das Schweizer Zulassungsverfahren eines attenuierten Influenzavirus (Nasaflu) im Jahr 2001 aufgrund von Paresen der Gesichtsmuskulatur abgebrochen werden.[17] Die in Deutschland verfügbaren Lebendimpfstoffe sind nur für Kinder zugelassen (Stand 2021).[13]
Zukünftige Influenzaimpfstoffe
Die bisher zugelassenen Impfstoffe setzen an den Ausbuchtungen („Köpfen“, engl. heads) der Hämagglutinin-Moleküle auf der Oberfläche der Viren an. Diese Molekül-Region ändert sich aber durch Antigen-Shift und Antigen-Drift in weniger als einer Influenza-Saison. Das führt zu schwankender und durchschnittlich nur geringer Wirksamkeit der Impfstoffe und der Notwendigkeit, diese jedes Jahr neu zu testen, in Massen zu produzieren und an alle Ziel-Personen zu verimpfen. Die Gesundheitsbehörden der USA und der Europäischen Union unterstützen daher die Entwicklung eines „Universal-Impfstoffs“ gegen Influenza, der ähnlich wie die Impfstoffe gegen nahezu alle anderen Erreger nur noch selten angepasst und nachgeimpft werden müsste, sondern über mehrere Saisons hinweg ausreichend wirksam wäre.[18][19] Ein Ansatz dazu sind Impfstoffe, die breitneutralisierende Anti-IAV-Antikörper gegen die extrazelluläre Domäne des Matrixproteins 2 (M2e) oder gegen einen bestimmten Bereich des Hämagglutinins (englisch stalk region, „Stiel-Region“ zwischen Kopf und Transmembrandomäne) induzieren. Sowohl die extrazelluläre Domäne des M2 als auch die Stielregion des Hämagglutinins sind zwischen den Subtypen der Influenzaviren wenig variabel (hoch konserviert). Daher wird ein hoher Selektionsdruck auf den Erhalt dieser Aminosäuresequenzen und deren Funktion vermutet, wodurch die Möglichkeiten zur Immunevasion der Influenzaviren eingeschränkt werden. An der Stielregion des Hämagglutinins ansetzende Impfstoffe werden seit 2018 an Versuchspersonen in Phase III untersucht. Weitere Ansätze zur Steigerung der Breitenwirksamkeit umfassen die Induktion von zytotoxischen T-Zellen und T-Helferzellen gegen konservierte Epitope mehrerer Stämme der Influenzaviren oder deren Konsensussequenz mit Hilfe von Vektoren, da zytotoxische T-Zellen von den Spaltimpfstoffen nur in geringem Umfang induziert werden.[20][21] Ein weiterer Ansatz sind Influenzaimpfstoffe aus Boten-RNA, in der Europäischen Union beispielsweise unterstützt durch CORDIS[22] und das UniVax-Projekt von Einrichtungen aus sieben EU-Staaten.[23] Über RNA-Impfstoffe soll einerseits bewirkt werden, dass das Influenzavirus im Körper der geimpften Personen keine vermehrungsfähigen Abkömmlinge mehr produziert. Zum andern soll das Immunsystem auf zukünftige Varianten des Influenzavirus besser vorbereitet werden.[24]
WHO: Empfehlung zur saisonalen Zusammensetzung der Impfstoffe seit 1998/1999
Influenzaimpfstoffe müssen jede Saison neu an die zirkulierenden Influenzaviren angepasst werden. Referenzlaboratorien auf der ganzen Welt – in Deutschland das am Robert Koch-Institut angesiedelte Nationale Referenzzentrum für Influenza – untersuchen dafür kontinuierlich die zirkulierenden Influenzaviren und übermitteln ihre Ergebnisse an die WHO. Die WHO empfiehlt dann üblicherweise für die Nordhalbkugel jeweils im Februar/März, für die Südhalbkugel jeweils im September eines Jahres auf Grund dieser Meldungen bestimmte Antigen-Kombinationen.[25]
| Nordhalbkugel der Erde | Südhalbkugel der Erde | ||
|---|---|---|---|
| Saison | Zusammensetzung | Saison | Zusammensetzung |
| 2021/2022[26][27] | Hühnereikulturen-basierte bzw. lebend-attenuierte Influenza-Impfstoffe:
zellbasierte Influenza-Impfstoffe:
|
2022 | Hühnereikulturen-basierte bzw. lebend-attenuierte Influenza-Impfstoffe:
|
| 2020/2021[28] | Hühnereikulturen-basierte bzw. lebend-attenuierte Influenza-Impfstoffe:[29]
im Vierfachimpfstoff als zweites B-Antigen:
zellbasierte Influenza-Impfstoffe:
im Vierfachimpfstoff als zweites B-Antigen:
|
2021[30] | Hühnereikulturen-basierte bzw. lebend-attenuierte Influenza-Impfstoffe:
im Vierfachimpfstoff als zweites B-Antigen:
zellbasierte Influenza-Impfstoffe:
im Vierfachimpfstoff als zweites B-Antigen:
|
| 2019/2020 | A/Brisbane/02/2018 (H1N1), pdm09-ähnlicher Stamm A/Kansas/14/2017 (H3N2)-ähnlicher Stamm B/Colorado/06/2017-ähnlicher Stamm (B/Victoria/2/87-Linie) im Vierfachimpfstoff außerdem Variante von B/Phuket/3073/2013-ähnlichem Stamm (B/Yamagata/16/88-Linie)[31][32] |
2020 | A/Brisbane/02/2018 (H1N1)pdm09-ähnlicher Stamm A/South Australia/34/2019 (H3N2)-ähnlicher Stamm B/Washington/02/2019-ähnlicher Stamm (B/Victoria-Linie) im Vierfachimpfstoff außerdem B/Phuket/3073/2013-ähnlicher Stamm (B/Yamagata-Linie)[33] |
| 2018/2019 | A/Michigan/45/2015 (H1N1)pdm09-like A/Singapore/INFIMH-16-0019/2016 (H3N2)-like B/Colorado/06/2017-like (B/Victoria/2/87-Linie) im Vierfachimpfstoff außerdem B/Phuket/3073/2013-like (B/Yamagata/16/88-Linie)[34] |
2018 | A/Michigan/45/2015 (H1N1)pdm09 A/Singapore/INFIMH-16-0019/2016 (H3N2) B/Phuket/3073/2013 im Vierfachimpfstoff außerdem B/Brisbane/60/2008[35] |
| 2017/2018 | A/Michigan/45/2015 (H1N1)pdm09 A/Hong Kong/4801/2014 (H3N2) B/Brisbane/60/2008 im Vierfachimpfstoff außerdem B/Phuket/3073/2013[36] |
2017 | A/Michigan/45/2015 (H1N1)pdm09 A/Hong Kong/4801/2014 (H3N2) B/Brisbane/60/2008 im Vierfachimpfstoff außerdem B/Phuket/3073/2013[37] |
| 2016/2017 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Hong Kong/4801/2014 (H3N2) B/Brisbane/60/2008 im Vierfachimpfstoff außerdem B/Phuket/3073/2013[38] |
2016 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Hong Kong/4801/2014 (H3N2) B/Brisbane/60/2008 im Vierfachimpfstoff außerdem B/Phuket/3073/2013[39] |
| 2015/2016 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Switzerland/9715293/2013 (H3N2) B/Phuket/3073/2013 im Vierfachimpfstoff außerdem B/Brisbane/60/2008[40] |
2015 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Switzerland/9715293/2013 (H3N2) (drei ähnliche werden genannt) B/Phuket/3073/2013 im Vierfachimpfstoff außerdem B/Brisbane/60/2008[41] |
| 2014/2015 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Texas/50/2012 (H3N2) B/Massachusetts/2/2012[42] |
2014 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Texas/50/2012 (H3N2) B/Massachusetts/2/2012[43] |
| 2013/2014 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Victoria/361/2011 (H3N2) B/Massachusetts/2/2012[44] |
2013 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Victoria/361/2011 (H3N2) B/Wisconsin/1/2010[45] |
| 2012/2013 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Victoria/361/2011 (H3N2) B/Wisconsin/1/2010[46] |
2012 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Perth/16/2009 (H3N2) B/Brisbane/60/2008[47] |
| 2011/2012 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Perth/16/2009 (H3N2) (Stämme wie A/Wisconsin/15/2009) B/Brisbane/60/2008[48][49] |
2011 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Perth/16/2009 (H3N2) B/Brisbane/60/2008 |
| 2010/2011 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Perth/16/2009 (H3N2) (Stämme wie A/Wisconsin/15/2009) B/Brisbane/60/2008 |
2010 | A/California/7/2009 (H1N1)pdm09 (sog. „Schweinegrippe“) A/Perth/16/2009 (H3N2) B/Brisbane/60/2008 |
| 2009/2010 | A/Brisbane/59/2007 (H1N1) A/Brisbane/10/2007 (H3N2) B/Brisbane/60/2008 |
2009 | A/Brisbane/59/2007 (H1N1) (Stämme wie A/South Dakota/6/2007) A/Brisbane/10/2007 (H3N2) (wie A/Brisbane/10/2007 oder A/Uruguay/716/2007) B/Florida/4/2006 (Stämme wie B/Brisbane/3/2007) |
| 2008/2009 | A/Brisbane/59/2007 (H1N1) A/Brisbane/10/2007 (H3N2) B/Florida/4/2006 (B/Brisbane/3/2007)[50] |
2008 | A/Solomon Islands/3/2006 (H1N1) A/Brisbane/10/2007 (H3N2) B/Florida/4/2006 |
| 2007/2008 | A/Solomon Islands/3/2006 (H1N1) A/Wisconsin/67/2005 (H3N2) (wie A/Hiroshima/52/2005) B/Malaysia/2506/2004 |
2007 | A/New Caledonia/20/99 (H1N1) A/Wisconsin/67/2005 (H3N2) B/Malaysia/2506/2004 |
| 2006/2007 | A/New Caledonia/20/99 (H1N1) A/Wisconsin/67/2005 (H3N2) (A/Wisconsin/67/2005 o. A/Hiroshima/52/2005) B/Malaysia/2506/2004 (wie B/Ohio/1/2005 oder B/Victoria/2/87)[51] |
2006 | A/New Caledonia/20/99 (H1N1) A/California/7/2004 (H3N2) (auch A/New York/55/2004) B/Malaysia/2506/2004[52] |
| 2005/2006 | A/New Caledonia/20/1999 (H1N1) A/California/7/2004 (H3N2) (wie A/New York/55/2004) B/Jiangsu/10/2003[53][54] |
2005 | A/New Caledonia/20/99 (H1N1) A/Wellington/1/2004 (H3N2) B/Shanghai/361/2002 (B/Shanghai/361/2002, B/Jilin/20/2003 oder B/Jiangsu/10/2003)[55][56] |
| 2004/2005 | A/New Caledonia/20/99 (H1N1) A/Fujian/411/2002 (H3N2) (wie A/Wyoming/3/2003 oder A/Kumamoto/102/2002) B/Shanghai/361/2002 (wie die Stämme B/Shanghai/361/2002 oder B/Jilin/20/2003). Wegen der starken Verbreitung wurden ebenfalls B/Jiangsu/10/2003 Stämme verwendet.[57][58] |
2004 | A/New Caledonia/20/99 (H1N1) A/Fujian/411/2002 (H3N2) (A/Kumamoto/102/2002 und A/Wyoming/3/2003 waren in Hühnereiern gezüchtete ähnliche Virusisolate) B/Hong Kong/330/2001 (B/Shandong/7/97, B/Hong Kong/330/2001 und B/Hong Kong/1434/2002; B/Brisbane/32/2002 war ebenfalls verfügbar)[59][60] |
| 2003/2004 | A/New Caledonia/20/99 (H1N1) A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) B/Hong Kong/330/2001 (Stämme wie B/Shandong/7/97, B/Hong Kong/330/2001, B/Hong Kong/1434/2002) [61] |
2003 | A/New Caledonia/20/99 (H1N1) A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) B/Hong Kong/330/2001 (Stämme wie B/Shandong/7/97, B/Hong Kong/330/2001, B/Hong Kong/1434/2002)[62] |
| 2002/2003 | A/New Caledonia/20/99 (H1N1) A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) B/Hong Kong/330/2001[63] |
2002 | A/New Caledonia/20/99 (H1N1) A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) B/Sichuan/379/99 (Stämme wie B/Guangdong/120/2000, B/Johannesburg/5/99 oder B/Victoria/504/2000)[64] |
| 2001/2002 | A/New Caledonia/20/99 (H1N1) A/Moscow/10/99 (H3N2)(Stämme wie A/Panama/2007/99) B/Sichuan/379/99 (Stämme wie B/Johannesburg/5/99 und B/Victoria/504/2000)[65] |
2001 | A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) A/New Caledonia/20/99 (H1N1) B/Sichuan/379/99(Stämme wie B/Guangdong/120/2000, B/Johannesburg/5/99 oder B/Victoria/504/2000)[66] |
| 2000/2001 | A/Moscow/10/99 (H3N2) (Stämme wie A/Panama/2007/99) A/New Caledonia/20/99 (H1N1) B/Beijing/184/93[67] |
2000 | A/Moscow/10/99 (H3N2) A/New Caledonia/20/99 (H1N1) B/Beijing/184/93(Stämme wie B/Shangdong/7/97)[68] |
| 1999/2000 | A/Sydney/5/97 (H3N2) A/Beijing/262/95 (H1N1) B/Beijing/184/93(Stämme wie B/Shangdong/7/97)[69] |
1999 | A/Sydney/5/97 (H3N2) A/Beijing/262/95 (H1N1) B/Beijing/184/93(Vakzine wie B/Harbin/7/94)[70] |
| 1998/1999 | A/Sydney/5/97(H3N2) A/Beijing/262/95(H1N1) B/Beijing/184/93(Vakzine wie B/Harbin/7/94)[71] |
1998 | |
In Deutschland zugelassene Impfstoffe
Saison 2020/2021 Impfstoffe mit Stammanpassung für 2020/2021[72]
| Bezeichnung | Krankheit / Stoff-Indikationsgruppe | Zulassungsinhaber | Impfstoffart | Zulassungsnummer | Zulassungsdatum | Weitere Informationen |
|---|---|---|---|---|---|---|
| Afluria Tetra 2020/2021 | Influenza Spaltimpfstoff (Virusimpfstoff, inaktiviert) intramuskulär
Verwendung ab einem Lebensalter von 18 Jahren |
Seqirus Netherlands B.V.
Paasheuvelweg 28 1105 BJ Amsterdam Niederlande |
Mono | PEI.H.12019.01.1 | 27.05.2020 | PharmNet.Bund
Hersteller des Impfstoffs: Seqirus Pty Ltd. 63 Poplar Road Parkville 3052, Victoria AU - Australien
|
| Begripal 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert) intramuskulär Verwendung ab einem Lebensalter von 6 Monaten |
Seqirus, S.r.l., Via Fiorentina 1, 53100 Siena (SI), Italien | Mono | PEI.H.00968.01.1 | 04.06.1999 | PharmNet.Bund
Hersteller des Impfstoffs: Seqirus Vaccines Ltd. Gaskill Road Speke Liverpool L24 9GR UK |
| Fluad 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert, adjuvantiert) intramuskulär Verwendung ab einem Lebensalter von 65 Jahren |
Seqirus, S.r.l.,
Via Fiorentina 1, 53100 Siena (SI), Italien |
Mono | PEI.H.01444.01.1 | 05.07.2000 | PharmNet.Bund
Hersteller des Impfstoffs: Seqirus Vaccines Ltd. Gaskill Road Speke Liverpool L24 9GR UK |
| Flucelvax Tetra 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff aus Zellkulturen, inaktiviert, frei von Hühnereiweiß), intramuskulär Verwendung ab einem Lebensalter von 2 Jahren |
Seqirus Netherlands B.V.
Hullenbergweg 89 1101 CL Amsterdam Niederlande |
Mono | EU/1/18/1326/001 | 12.12.2018 | EPAR: Flucelvax Tetra
Hersteller des Impfstoffes: Seqirus Inc. 475 Green Oaks Parkway Holly Springs NC 27540 USA
|
| Fluenz Tetra 2020/2021 | Influenza-Impfstoff
(Virusimpfstoff, lebend-attenuiert), nasal Verwendung ab einem Lebensalter von 2 Jahren bis einschließlich 17 Jahren |
AstraZeneca AB, SE-151 85 Södertälje, Schweden | Mono | EU/1/13/887 | 04.12.2013 | EPAR: Fluenz Tetra
Hersteller des Impfstoffs: MedImmune UK Limited, Plot 6 Renaissance Way, Boulevard Industry Park, Speke, Liverpool L249JW UK Wird in Saison 2020/2021 in Deutschland vermarktet |
| Influsplit Tetra 2020/2021 | Influenza-Spaltimpfstoff
(Virusimpfstoff, inaktiviert), intramuskulär Verwendung ab einem Lebensalter von 6 Monaten / Use from an age of 6 months |
GlaxoSmithKline GmbH & Co. KG, München | Mono | PEI.H.11629.01.1 | 04.03.2013 | PharmNet.Bund
Hersteller des Impfstoffs: GlaxoSmithKline Biologicals NL der SmithKline Beecham Pharma GmbH & Co. KG Zirkusstr. 40 01069 Dresden, Deutschland
|
| Influvac 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert) intramuskulär Verwendung ab einem Lebensalter von 6 Monaten / Use from an age of 6 months |
Mylan Healthcare GmbH,
Freundallee 9A, 30173 Hannover, Deutschland |
Mono | PEI.H.00191.01.1 | 17.08.1998 | PharmNet.Bund
Hersteller des Impfstoffs: Abbott Biologicals B.V. C. J. van Houtenlaan 36 1381 CP Weesp Niederlande |
| Influvac Tetra 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert) intramuskulär oder tief subkutan Verwendung ab einem Lebensalter von 3 Jahren |
Mylan Healthcare GmbH,
Freundallee 9A, 30173 Hannover, Deutschland |
Mono | PEI.H.11881.01.1 | 31.07.2017 | PharmNet.Bund
Hersteller des Impfstoffs: Abbott Biologicals B.V. C. J. van Houtenlaan 36 1381 CP Weesp Niederlande Wird in Saison 2020/2021 in Deutschland vermarktet |
| Vaxigrip Tetra 2020/2021 | Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert)
intramuskulär oder subkutan Injektionssuspension in einer Fertigspritze Verwendung ab einem Lebensalter von 6 Monaten |
Sanofi Pasteur
14 Espace Henry Vallée 69007 Lyon Frankreich |
Mono | PEI.H.11808.01.1 | 14.07.2016 | PharmNet.Bund
Hersteller des Impfstoffs: Sanofi Pasteur 14 Espace Henry Vallée 69007 Lyon Frankreich Influenza-Impfstoff "Vaxigrip Tetra 2020/2021" aus Frankreich eingeführt
|
| Xanaflu Tetra 2020/2021 | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert) intramuskulär oder tief subkutan Verwendung ab einem Lebensalter von 3 Jahren |
Mylan Healthcare GmbH,
Freundallee 9A, 30173 Hannover, Deutschland |
Mono | PEI.H.11882.01.1 | 31.07.2017 | PharmNet.Bund
Hersteller des Impfstoffs: Abbott Biologicals B.V. C. J. van Houtenlaan 36 1381 CP Weesp Niederlande Wird in Saison 2020/2021 in Deutschland vermarktet |
Saison 2020/2021 Impfstoffe ohne Stammanpassung für 2020/2021[72]
| Bezeichnung | Krankheit / Stoff-Indikationsgruppe | Zulassungsinhaber | Impfstoffart | Zulassungsnummer | Zulassungsdatum | Weitere Informationen |
|---|---|---|---|---|---|---|
| Afluria | Influenza-Spaltimpfstoff
(Virusimpfstoff, inaktiviert) intramuskulär Verwendung ab einem Lebensalter von 5 Jahren |
Seqirus GmbH, Emil-von-Behring-Str. 76, 35041 Marburg, Deutschland | Mono | PEI.H.03523.01.1 | 08.06.2007 | PharmNet.Bund
Hersteller des Impfstoffs: Seqirus Pty Ltd. 45 Poplar Road, Parkville, Victoria 3052 AU - Australien |
| Efluelda | Influenza Spaltimpfstoff
(Virusimpfstoff, inaktiviert, 60 Mikrogramm HA/Stamm) intramuskulär oder subkutan Verwendung ab einem Lebensalter von 65 Jahren |
Sanofi Pasteur
14 Espace Henry Vallée 69007 Lyon Frankreich |
Mono | PEI.H.12011.01.1 | 05.05.2020 | PharmNet.Bund
Hersteller des Impfstoffs: Sanofi Pasteur Parc Industriel d'Incarville 27100 Val de Reuil Frankreich |
| Fluad Tetra | Influenza-Untereinheiten-Impfstoff aus Oberflächenantigen
(Virusimpfstoff, inaktiviert, adjuvantiert) intramuskulär Verwendung ab einem Lebensalter von 65 Jahren |
Seqirus Netherlands B.V.
Paasheuvelweg 28 1105 BJ Amsterdam Niederlande |
Mono | EU/1/20/1433 | 20.05.2020 | EPAR: Fluad Tetra
Hersteller des Impfstoffes: Seqirus Vaccines Limited Gaskill Road, Speke L24 9GR Liverpool UK |
| Fluarix | Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert)
intramuskulär Verwendung ab einem Lebensalter von 6 Monaten |
GlaxoSmithKline Biologicals S.A., Belgien - Rixensart | Mono | PEI.H.11676.01.1 | 24.01.2013 | PharmNet.Bund
Hersteller des Impfstoffs: GlaxoSmithKline Biologicals Niederlassung der SmithKline Beecham Pharma GmbH & Co. KG Zirkusstr. 40 01069 Dresden |
| Fluarix Tetra | Influenza Spaltimpfstoff (Virusimpfstoff, inaktiviert)
intramuskulär Verwendung ab einem Lebensalter von 6 Monaten |
GlaxoSmithKline GmbH & Co. KG, München | Mono | PEI.H.11991.01.1 | 03.09.2020 | Hersteller des Impfstoffs:
GlaxoSmithKline Biologicals NL der SmithKline Beecham Pharma GmbH & Co. KG Zirkusstr. 40 01069 Dresden, Deutschland |
| Vaxigrip Tetra | Influenza-Spaltimpfstoff (Virusimpfstoff, inaktiviert)
intramuskulär oder subkutan Injektionssuspension in einer Durchstechflasche zur Mehrfachentnahme Verwendung ab einem Lebensalter von 6 Monaten |
Sanofi Pasteur
14 Espace Henry Vallée 69007 Lyon Frankreich |
Mono | PEI.H.11808.02.1 | 29.01.2020 | Hersteller des Impfstoffs:
Sanofi Pasteur 14 Espace Henry Vallée 69007 Lyon Frankreich |
Saison 2017/2018
| Impfstoff | Bemerkung | Stoffgruppe | Virulenz | Mindest- alter der Impflinge |
Höchst- alter der Impflinge |
Verabreichung |
|---|---|---|---|---|---|---|
| Afluria 2017/2018 | Spalt-Vakzin | inaktiviert | 5 | — | intramuskulär | |
| Begripal 2017/2018 | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 0,5 | — | intramuskulär | |
| Fluad 2017/2018 | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 65 | — | intramuskulär | |
| Fluarix | Spalt-Vakzin | inaktiviert | 0,5 | — | intramuskulär | |
| Fluenz Tetra 2017/2018 | Influenza Virus Typen A, H1N1 / A, H3N2 / B (Victoria lineage) / B (Yamagata lineage) | ganz | lebend-attenuiert | 2 | 17 | nasal |
| Grippe-Impfstoff CSL | Spalt-Vakzin | inaktiviert | 5 | — | intramuskulär | |
| Grippe-Impfstoff STADA N 2017/2018 | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 0,5 | — | intramuskulär | |
| IDflu | Stärke: 15 µg | Spalt-Vakzin | inaktiviert | 60 | — | intradermal |
| Influsplit SSW | Spalt-Vakzin | inaktiviert | 0,5 | — | intramuskulär | |
| Influsplit Tetra 2017/2018 | Spalt-Vakzin | inaktiviert | 3 | — | intramuskulär | |
| Influvac 2017/2018 | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 0,5 | — | intramuskulär | |
| Influvac Tetra | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 18 | — | intramuskulär oder tief subkutan | |
| INTANZA | Stärke: 15 µg | Spalt-Vakzin | inaktiviert | 60 | — | intradermal |
| Optaflu | in Zellkultur hergestellt | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 18 | — | intramuskulär |
| Vaxigrip 2017/2018 | Spalt-Vakzin | inaktiviert | 0,5 | — | intramuskulär, ggf. tief subkutan | |
| Vaxigrip Tetra 2017/2018 | Spalt-Vakzin | inaktiviert | 3 | — | intramuskulär, ggf. tief subkutan | |
| Xanaflu 2017/2018 | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 0,5 | — | intramuskulär | |
| Xanaflu Tetra | Untereinheiten-Vakzin aus Oberflächenantigen | inaktiviert | 18 | — | intramuskulär oder tief subkutan |
Bei den 10 Impfstoffen mit der Angabe 2017/2018 waren die Änderungen für die Saison 2017/2018 am 24. August 2017 bereits genehmigt.[73]
Literatur
- D. M. Knipe, Peter M. Howley, D. E. Griffin, (Hrsg.): Fields Virology. 5. Auflage. Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-6060-7.
Einzelnachweise
- WHO Model List of EssentialMedicines. (PDF) In: World Health Organization. Oktober 2013, abgerufen am 22. April 2014.
- J. Wrammert, K. Smith, J. Miller, W. A. Langley, K. Kokko, C. Larsen, N. Y. Zheng, I. Mays, L. Garman, C. Helms, J. James, G. M. Air, J. D. Capra, R. Ahmed, P. C. Wilson: Rapid cloning of high-affinity human monoclonal antibodies against influenza virus. In: Nature. Band 453, Nummer 7195, Mai 2008, S. 667–671, doi:10.1038/nature06890. PMID 18449194, PMC 2515609 (freier Volltext).
- X. Cheng, M. Eisenbraun, Q. Xu, H. Zhou, D. Kulkarni, K. Subbarao, G. Kemble, H. Jin: H5N1 vaccine-specific B cell responses in ferrets primed with live attenuated seasonal influenza vaccines. In: PLOS ONE. Band 4, Nummer 2, 2009, Art. e4436, doi:10.1371/journal.pone.0004436. PMID 19209231, PMC 2635969 (freier Volltext).
- I. Leroux-Roels, G. Leroux-Roels: Current status and progress of prepandemic and pandemic influenza vaccine development. In: Expert review of vaccines. Band 8, Nummer 4, April 2009, S. 401–423, doi:10.1586/erv.09.15. PMID 19348557.
- Z. Wang, S. Tobler, J. Roayaei, A. Eick: Live attenuated or inactivated influenza vaccines and medical encounters for respiratory illnesses among US military personnel. In: JAMA. Band 301, Nummer 9, März 2009, S. 945–953, doi:10.1001/jama.2009.265. PMID 19255113.
- Grippeimpfung: Wie Pandemrix eine Narkolepsie auslöst Ärzteblatt, Stand 2. Juli 2015; abgerufen am 10. Oktober 2020
- N. Feltelius, I. Persson, J. Ahlqvist-Rastad, M. Andersson, L. Arnheim-Dahlström, P. Bergman, F. Granath, C. Adori, T. Hökfelt, S. Kühlmann-Berenzon, P. Liljeström, M. Maeurer, T. Olsson,.. Örtqvist, M. Partinen, T. Salmonson, B. Zethe: A coordinated cross-disciplinary research initiative to address an increased incidence of narcolepsy following the 2009–2010 Pandemrix vaccination programme in Sweden. In: Journal of Internal Medicine. Band 278, Nummer 4, Oktober 2015, S. 335–353, doi:10.1111/joim.12391. PMID 26123389.
- M. C. Sturkenboom: The narcolepsy-pandemic influenza story: can the truth ever be unraveled? In: Vaccine. Band 33 Suppl 2, Juni 2015, S. B6–B13, doi:10.1016/j.vaccine.2015.03.026. PMID 26022571.
- Fachinformation Flucelvax (PDF), Seqirus. Abgerufen am 26. Mai 2021.
- Weekly epidemiological record / Relevé épidémiologique hebdomadaire; 19 August 2005, 80th year / 19 août 2005, 80e année. (PDF; 220 kB) WHO; No. 33, 2005, 80, 277–288
- Neuer Grippe-Impfstoff aus Münster. Antenne Münster, 11. April 2019; abgerufen am 7. Juli 2019
- am: Grippeimpfstoff aus Wimperntierchen. In: Pharmazeutische Zeitung. 22. August 2013, abgerufen am 21. Oktober 2013.
- Beschluss und Wissenschaftliche Begründung der STIKO für die Aktualisierung der Influenza-Impfempfehlung für Personen im Alter von ≥60 Jahren. In: RKI. 7. Januar 2021, abgerufen am 11. Januar 2021.
- Robert B. Belshe, Kathryn M. Edwards, Timo Vesikari, Steven V. Black, Robert E. Walker, Micki Hultquist, George Kemble, Edward M. Connor: Live Attenuated versus Inactivated Influenza Vaccine in Infants and Young Children. In: New England Journal of Medicine. 356, 2007, S. 685, doi:10.1056/NEJMoa065368.
- Christopher S. Ambrose, Catherine Luke, Kathleen Coelingh: Current status of live attenuated influenza vaccine in the United States for seasonal and pandemic influenza. In: Influenza and Other Respiratory Viruses. 2, 2008, S. 193, doi:10.1111/j.1750-2659.2008.00056.x. PMC 2710797 (freier Volltext).
- T. Jefferson, A. Rivetti, C. Di Pietrantonj, V. Demicheli, E. Ferroni: Vaccines for preventing influenza in healthy children. In: The Cochrane Library 8: CD004879. 2012. doi:10.1002/14651858.CD004879.pub4. PMID 22895945.
- P. Sendi, R. Locher, B. Bucheli, M. Battegay: Intranasal influenza vaccine in a working population. In: Clinical Infectious Diseases. Band 38, Nummer 7, April 2004, S. 974–980, doi:10.1086/386330. PMID 15034829.
- Ashley P. Taylor: First Universal Flu Vaccine to Enter Phase 3 Trial, online 12. November 2018, Abruf 11. Juni 2019
- NIH begins first-in-human trial of a universal influenza vaccine candidate. NIH, 3. April 2019; abgerufen am 11. Juni 2019
- L. Moise, F. Terry, M. Ardito, R. Tassone, H. Latimer, C. Boyle, W. D. Martin, A. S. De Groot: Universal H1N1 influenza vaccine development: identification of consensus class II hemagglutinin and neuraminidase epitopes derived from strains circulating between 1980 and 2011. In: Human vaccines & immunotherapeutics. Band 9, Nummer 7, Juli 2013, S. 1598–1607, doi:10.4161/hv.25598. PMID 23846304.
- K. Xiang, G. Ying, Z. Yan, Y. Shanshan, Z. Lei, L. Hongjun, S. Maosheng: Progress on adenovirus-vectored universal influenza vaccines. In: Human vaccines & immunotherapeutics. Band 11, Nummer 5, 2015, S. 1209–1222, doi:10.1080/21645515.2015.1016674. PMID 25876176, PMC 4514376 (freier Volltext).
- EU-Kommission: A “Universal” Influenza Vaccine through Synthetic, Dendritic Cell-Targeted, Self-Replicating RNA Vaccines, Abruf 10. Juni 2019
- UniVax-Projekt: Selbstbeschreibung
- Francesco Berlanda Scorza1, Norbert Pardi: New Kids on the Block: RNA-Based Influenza Virus Vaccines. 1. April 2018, PMC 6027361 (freier Volltext)
- Recommendations on the composition of influenza virus vaccines. WHO; abgerufen am 2. Juli 2019
- WHO | Recommended composition of influenza virus vaccines for use in the 2021 - 2022 northern hemisphere influenza season. Abgerufen am 26. Mai 2021.
- Gelbe Liste Online: STIKO-Empfehlung für die Grippe-Saison 2021/22 | Gelbe Liste. Abgerufen am 26. Mai 2021.
- WHO | Recommended composition of influenza virus vaccines for use in the 2020 - 2021 northern hemisphere influenza season. Abgerufen am 22. Mai 2020.
- Paul-Ehrlich-Institut - Influenza-Impfstoffe. Abgerufen am 22. Mai 2020.
- WHO | Recommended composition of influenza virus vaccines for use in the 2021 southern hemisphere influenza season. Abgerufen am 30. Oktober 2020.
- Judith Koch, Sabine Vygen-Bonnet, Ole Wichmann: Ständige Impfkommission (STIKO). Die wichtigsten Änderungen im Überblick. In: Deutsche Ärzteblatt. Band 116, Heft 39, (27. September) 2019, S. B 1418 – B 1421, hier: S. B 1421 (Impfstoffzusammensetzung 2019/2020).
- Recommended composition of influenza virus vaccines for use in the 2019-2020 northern hemisphere influenza season. Update vom 21. März 2019
- Recommended composition of influenza virus vaccines for use in the 2020 southern hemisphere influenza season, 27. September 2019
- Recommended composition of influenza virus vaccines for use in the 2018-2019 northern hemisphere influenza season. WHO, 22. Februar 2018, abgerufen am 24. März 2018 (englisch).
- Recommended composition of influenza virus vaccines for use in the 2018 southern hemisphere influenza season. In: World Health Organization.
- who.int
- Recommended composition of influenza virus vaccines for use in the 2017 southern hemisphere influenza season. In: World Health Organization.
- Recommended composition of influenza virus vaccines for use in the 2016-2017 northern hemisphere influenza season. In: World Health Organization.
- Recommended composition of influenza virus vaccines for use in the 2016 southern hemisphere influenza season. In: World Health Organization.
- Recommended composition of influenza virus vaccines for use in the 2015-2016 northern hemisphere influenza season. In: World Health Organization.
- WHO – Recommended composition of influenza virus vaccines for use in the 2015 southern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2014-2015 northern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2014 southern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2013-14 northern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2013 southern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2012-2013 northern hemisphere influenza season. In: www.who.int.
- WHO – Recommended composition of influenza virus vaccines for use in the 2012 southern hemisphere influenza season. In: www.who.int.
- Recommended composition of influenza virus vaccines for use in the 2011–2012 northern hemisphere influenza season. World Health Organization (englisch)
- WHO/Europe recommendations on influenza vaccination during the 2011/2012 winter season. (PDF; 96 kB) World Health Organization (WHO), Oktober 2011 (englisch); WHO: Frequently asked questions: Recommended composition of influenza virus vaccines for use in the northern hemisphere in the 2011–2012 influenza season. (PDF; 24 kB) 17. Februar 2011 (englisch)
- who.int (PDF; 103 kB)
- who.int, phac-aspc.gc.ca (PDF; 204 kB)
- who.int (PDF; 318 kB)
- who.int,
- Centers for Disease Control and Prevention – Influenza (Flu) – Weekly Report: Influenza Summary Update 20, 2004-2005 Season. In: www.cdc.gov.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- who.int (PDF; 217 kB)
- who.int,
- Update: Influenza Activity – United States and Worldwide, 2003–04 Season, and Composition of the 2004–05 Influenza Vaccine. In: www.cdc.gov.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- http://www.who.int/csr/disease/influenza/recommendations2004/en/index.html (Memento vom 30. Mai 2004 im Internet Archive)
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- WHO – Recommendations for Influenza Vaccine Composition. In: www.who.int.
- Paul-Ehrlich-Institut - Influenza-Impfstoffe. Abgerufen am 21. Dezember 2020.
- Zugelassene Impfstoffe. (Memento vom 26. Juni 2019 im Internet Archive) PEI