Gelbfieber
Das Gelbfieber, auch Ochropyra oder Schwarzes Erbrechen (in älteren Texten auch Siamesische Krankheit und Dschungelfieber) genannt, ist eine Infektionskrankheit, die durch das Gelbfieber-Virus verursacht wird. Bei dem Virus handelt es sich um ein 40 bis 50 Nanometer großes, behülltes RNA-Virus mit positiver Polarität aus der Familie der Flaviviren.
| Klassifikation nach ICD-10 | |
|---|---|
| A95 | Gelbfieber |
| ICD-10 online (WHO-Version 2019) | |
Das Virus wird durch Stechmücken als Vektor übertragen und ist in tropischen und subtropischen Gebieten Südamerikas und Afrikas verbreitet, früher auch in Teilen Nordamerikas. Die einzigen bekannten Wirte des Virus sind Primaten und verschiedene Stechmückenarten. Der Ursprung der Krankheit wird in Afrika vermutet, von wo sie durch den Sklavenhandel und den transatlantischen Verkehr ab dem 16. Jahrhundert in Südamerika verbreitet wurde. Seit dem 17. Jahrhundert wurden mehrere große Krankheitsausbrüche in Amerika, Afrika und Europa verzeichnet. Das Gelbfieber galt im 19. Jahrhundert als eine der gefährlichsten Infektionskrankheiten.[1]
Die Krankheit äußert sich in den meisten Fällen mit Fieber, Übelkeit und Schmerzen und klingt nach einigen Tagen wieder ab. Manchmal kommt es zu schweren, mitunter tödlich endenden Verläufen mit Leberschädigung, Entwicklung einer Gelbsucht (als Ausdruck einer Hepatitis, daher der Name der Krankheit) und Störung der Blutgerinnung (verstärkter Blutungsneigung, hämorrhagische Diathese). Das Gelbfieber zählt deswegen zu den sogenannten Hämorrhagischen Fiebern. Die WHO schätzt, dass jährlich 200.000 Personen erkranken und 30.000 Personen an Gelbfieber sterben; schätzungsweise 90 % der Infektionen entfallen auf den afrikanischen Kontinent.
Gegen Gelbfieber existiert eine sehr sichere und effektive Impfung, die in den 1930er/1940er Jahren von dem südafrikanischen Virologen Max Theiler entwickelt wurde. In einigen Ländern besteht eine Impfpflicht für einreisende Personen. Da keine kausale Therapie für Gelbfieber bekannt ist, sind neben Impfprogrammen insbesondere Maßnahmen zur Kontrolle der übertragenden Gelbfiebermücke in den betroffenen Ländern von großer Bedeutung. Seit den 1980er Jahren häufen sich die Fälle von Gelbfieber wieder, weswegen Gelbfieber oft auch als sich wieder ausbreitende Krankheit (engl. reemerging disease) bezeichnet wird.[2]
Erreger
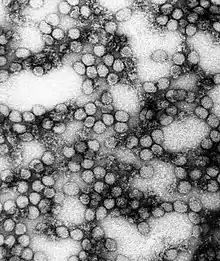
Gelbfieber wird durch das Gelbfieber-Virus verursacht, ein rundes Virus mit einem Durchmesser von 40 bis 50 nm aus der Familie der Flaviviren. Das virale Genom ist etwa 11.000 Nukleotide lang und besteht aus positivsträngiger Ribonukleinsäure (RNA), kann also von Ribosomen direkt abgelesen und somit ohne weitere Zwischenschritte zur Synthese einer Aminosäurenkette (Protein) verwendet werden. Das Genom umfasst nur einen offenen Leserahmen, der für ein Polyprotein codiert (eine lange Aminosäurekette, die nach erfolgter Synthese noch in die einzelnen funktionalen Proteine aufgespalten werden muss).[3]
Während einer Infektion heften sich die Viren über spezifische Rezeptoren an der Zelloberfläche einer Wirtszelle an und werden durch ein sich ausbildendes Endosomvesikel aufgenommen. Normalerweise dienen diese Vesikel dazu, Stoffe zu verdauen, das Virus nutzt sie aber als Transportmöglichkeit, um ins Innere der Zelle zu gelangen. Im Innern des Endosoms induziert der saure pH-Wert die Fusion von Endosommembran und Virushülle, sodass die inneren Strukturen (Kapsid und Genom) in das Zytosol freigesetzt werden. Danach wird das virale Genom mithilfe viraler RNA-Polymerasen und einer negativsträngigen RNA als Zwischenschritt repliziert. Die so vermehrten Positivstränge dienen der Synthese der viralen Strukturproteine (Hüllproteine und Kapsidproteine) im rauen ER und in so genannten vesicle packets. Nach einer Reifung im Golgi-Apparat entstehen infektiöse Viruspartikel. Diese verlassen die Zelle und infizieren weitere Wirtszellen.[3]
Übertragung
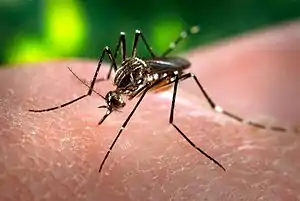
Das Gelbfieber-Virus wird hauptsächlich durch den Stich der Gelbfiebermücke (Aedes aegypti, syn. Stegomyia aegypti) übertragen, aber auch andere Mücken können als Vektor dienen. Wie bei anderen von Stechmücken übertragenen Arboviren wird das Gelbfiebervirus von einer weiblichen Stechmücke, die das Blut einer infizierten Person saugt, aufgenommen. Dabei gelangen die Viren in den Magen der Mücke und falls die Viruskonzentration hoch genug ist, können die Viren die Magenepithelzellen befallen und sich dort vermehren. Von dort gelangen sie ins Hämozöl (das Blutsystem der Mücke) und weiter in die Speicheldrüsen. Wenn die Mücke das nächste Mal Blut saugt, injiziert sie ihren Speichel in die Wunde, womit das Virus in den Blutkreislauf der gestochenen Person gelangt. Es gibt auch Hinweise für eine vertikale Infektion des Gelbfieber-Virus bei AG. aegypti, also der Übertragung von der weiblichen Mücke auf ihr Gelege und damit die Larven. Diese Infektion der Vektoren ohne vorherige Blutmahlzeit scheint bei einzelnen, plötzlichen Ausbrüchen eine Rolle zu spielen.[4]
Es existieren drei epidemiologisch unterscheidbare Infektionszyklen,[2] in denen das Virus von Mücken auf Menschen oder andere Primaten übertragen wird. Am urbanen Zyklus ist nur die Gelbfiebermücke beteiligt, welche gut an große urbane Zentren angepasst ist und dort neben Gelbfieber auch weitere Krankheiten wie Dengue- und Chikungunyafieber überträgt. Der urbane Zyklus ist hauptsächlich für größere Ausbrüche von Gelbfieber verantwortlich, wie sie in Afrika vorkommen. Einen Ausbruch 1999 in Bolivien ausgenommen, existiert dieser urbane Zyklus nicht mehr in Südamerika und wird ausschließlich in Afrika beobachtet.
Neben dem urbanen Zyklus existiert sowohl in Afrika als auch in Südamerika ein silvatischer Zyklus (Waldzyklus oder Dschungelzyklus), in dem Aedes africanus (in Afrika) oder Stechmücken der Gattungen Haemagoggus und Sabethes (in Südamerika) als Vektor dienen. Dabei werden im Dschungel hauptsächlich nicht-humane Primaten infiziert. Während die Krankheit in Afrika bei diesen Primaten mehrheitlich asymptomatisch verläuft, endet sie in Südamerika oft tödlich. In Südamerika ist der silvatische Zyklus momentan der einzige Infektionsweg für Menschen, was unter anderem die geringere Inzidenz von Gelbfieberfällen auf diesem Kontinent erklärt. Personen, die im Dschungel auf diese Weise infiziert werden, können das Virus in urbane Zentren bringen, wo die Gelbfiebermücke als Vektor auftritt. Aufgrund dieses silvatischen Zyklus kann Gelbfieber auch nicht vollständig ausgerottet werden.[2]
In Afrika existiert ein dritter Infektionszyklus, auch Savannenzyklus oder intermediärer Zyklus genannt, der zwischen Dschungel- und urbanem Zyklus auftritt. Verschiedene Mückenarten der Gattung Aedes sind beteiligt.
Verbreitung
| Endemiegebiete Afrika: |
|---|
| Geringeres Risiko Afrika: |
| Endemiegebiete Südamerika: |
Gelbfieber ist in tropischen und subtropischen Gebieten in Südamerika und Afrika endemisch. Obwohl der Hauptvektor – die Gelbfiebermücke – auch in Asien, im pazifischen Raum und im Mittleren Osten vorkommt, tritt Gelbfieber in diesen Regionen nicht auf; der Grund dafür ist unbekannt. Weltweit leben ungefähr 600 Millionen Menschen in endemischen Gebieten, und die offiziellen Schätzungen der WHO belaufen sich auf 200.000 Erkrankungen und 30.000 Todesfälle pro Jahr weltweit; die Anzahl gemeldeter Fälle liegt weit darunter. Schätzungsweise 90 % der Infektionen entfallen auf den afrikanischen Kontinent.[6]
- Übertragungsrisiko für Gelbfieber nach Daten der CDC (2010)
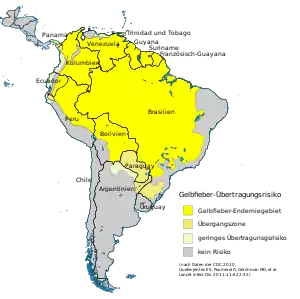 Verbreitung des Gelbfiebers in Südamerika
Verbreitung des Gelbfiebers in Südamerika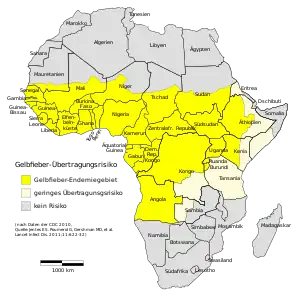 Verbreitung des Gelbfiebers in Afrika
Verbreitung des Gelbfiebers in Afrika
Phylogenetische Analysen identifizierten sieben Genotypen von Gelbfieberviren, von denen vermutet wird, dass sie unterschiedlich an den Menschen und an die Gelbfiebermücke angepasst sind. Fünf Genotypen kommen ausschließlich in Afrika vor, wobei vermutet wird, dass der Westafrika-Genotyp I besonders virulent oder infektiös ist, da er häufig bei größeren Ausbrüchen von Gelbfieber zu finden ist. In Südamerika wurden zwei Genotypen identifiziert.[2]
Krankheitserscheinungen
Gelbfieber hat eine Inkubationszeit von drei bis sechs Tagen, nach der es zu einem plötzlichen Fieberanstieg auf über 39 °C (und manchmal auch über 40 °C) kommt. Die meisten Fälle verlaufen mild, die Infektion äußert sich dann nur in einer kurzen Fieberkrankheit mit Kopfschmerzen, Schüttelfrost, Rückenschmerzen, Appetitlosigkeit, Übelkeit und Erbrechen.[7] Die Infektion kann in leichten Fällen nach drei bis vier Tagen wieder abklingen.
In ungefähr 15 % der Fälle manifestiert sich eine zweite Phase der Krankheit mit einer Wiederkehr des Fiebers, bei der eine kurzfristige Verbesserung des Gesundheitszustandes möglich ist. Ähnlich wie z. B. beim Typhus abdominalis lässt sich während dieses erneuten Fieberanstieges eine sog. „relative Bradykardie“ beobachten. Normalerweise steigt bei einer Erhöhung der Körperkerntemperatur um 1 °C der Herzschlag um ca. 10 Schläge pro Minute. Das Ausbleiben dieses Anstieges wird beim Gelbfieber als „Faget-Zeichen“ bezeichnet.[8]
Die zweite Phase wird begleitet von einer Gelbsucht infolge der Leberschädigung sowie Schmerzen im Unterleib. Als Zeichen einer erhöhten Blutungsneigung und Empfindlichkeit der Kapillargefäße tritt bei Druckbelastung der Haut das Phänomen der „Spanischen Flagge“ auf. Blutungen der Mundschleimhaut, der Augenbindehäute und der Nasenschleimhaut (Nasenbluten) sind charakteristisch. Massive Blutungen im Magen-Darm-Trakt können zu blutigem Stuhlgang[7] und blutigem Erbrechen führen, wobei das Blut durch den Kontakt mit der Magensäure schwarz gefärbt ist; daher auch der historische Name „Vomito negro“[9] (Schwarzes Erbrechen) und die Einteilung in die Hämorrhagischen Fieber. Diese zweite Phase, auch toxische Phase genannt, endet in 20 %[10] aller Fälle tödlich. Wird die Infektion überstanden, besteht lebenslange Immunität[11] und normalerweise werden keine bleibenden Organschäden davongetragen.
Pathogenese
Eine Infektion mit dem Gelbfiebervirus führt in erster Linie zu einer Schädigung von Epithelzellen (Schleimhäute, Gefäße) und Muskelzellen des Herzens. Nach der Übertragung des Erregers durch eine Mücke vermehren sich die Viren zunächst in Lymphknoten und infizieren insbesondere dendritische Zellen. Von dort verbreiten sich die Viren über eine Virämie auf den gesamten Organismus und erreichen so auch die Leber. Hier infizieren die Viren die Leberzellen, sehr wahrscheinlich indirekt über Kupffersche Zellen, was zur eosinophilen Degradation dieser Zellen und zur Ausschüttung von Zytokinen führt. Die mikroskopisch sichtbaren Ansammlungen von Pigment in Kupfferschen Zellen beim Gelbfieber werden auch als „Villela-Körperchen“ bezeichnet. Bei einem tödlichen Verlauf folgt ein kardiovaskulärer Schock und Multiorganversagen mit stark erhöhten Zytokin-Werten (ein sogenannter Zytokinsturm).[10] Histologisch sind in Leberzellen eosinophile Einschlusskörperchen („Councilman-Körperchen“) sichtbar, gelegentlich auch Einschlüsse im Zellkern („Torres-Körperchen“).
Diagnose
Gelbfieber ist überwiegend eine klinische Diagnose, die sich oft auf den Aufenthaltsort der erkrankten Personen während der Inkubationszeit stützt. Sporadische und nur milde Verläufe sind nur durch eine virologische Untersuchung sicher zu erkennen. Da auch die milden Verläufe bei regionalen Ausbrüchen eine große Rolle spielen und auch diese Patienten zur Weiterverbreitung des Virus beitragen, gilt jedes innerhalb von sechs bis längstens zehn Tagen nach Verlassen des Endemiegebietes auftretende Fieber mit Schmerzen, Übelkeit und Erbrechen als Gelbfieber-verdächtig.
Bei Verdacht auf eine Infektion kann das Gelbfiebervirus bis etwa 6–10 Tage nach Beginn der Erkrankung nachgewiesen werden. Dies kann mittels reverser Transkriptase-Polymerase-Kettenreaktion erfolgen, bei der das Erbgut des Virus vervielfältigt und damit direkt nachgewiesen wird.[6] Der direkte Erregernachweis kann auch über eine Virusisolierung mittels Anzucht in der Zellkultur erfolgen, wobei dieses Verfahren ein bis vier Wochen dauern kann. Beide Verfahren werden mit Blutplasma (Heparinblut) durchgeführt. Serologisch kann ein enzymgekoppelter Immunadsorptionstest in der akuten Phase der Krankheit Gelbfieber-spezifisches IgM nachweisen oder ein Anstieg des spezifischen IgG-Titers im Vergleich zu einer Vorprobe nachgewiesen werden. Zusammen mit einer klaren klinischen Symptomatik gelten ein Nachweis des IgM oder ein vierfacher Titeranstieg des IgG als sicherer Hinweis. Da die serologischen Testverfahren häufig auch mit anderen Flaviviren, beispielsweise dem Dengue-Virus kreuzreagieren, sind diese indirekten Verfahren jedoch nie beweisend für eine Infektion.
Die histologischen Veränderungen in der Leber treten auch bei anderen viralen, hämorrhagischen Virusinfektionen mit Leberbeteiligung auf, sie sind daher keine krankheitsbeweisenden Zeichen. Eine postmortal durchgeführte Leberbiopsie kann die Einschlusskörperchen und Nekrosen von Hepatozyten bestätigen und dem Nachweis von spezifischem, viralem Antigen dienen. Typische Entzündungszeichen fehlen oft im histologischen Bild, insbesondere bei fulminanten Verläufen. Aufgrund der erhöhten Blutungsneigung ist eine Leberbiopsie beim Patienten nicht angezeigt und dient nur der Bestätigung der Diagnose nach dem Tod.
Der Umgang mit sämtlichem Untersuchungsmaterial des Patienten, insbesondere Blut und Biopsien, unterliegt strengen Sicherheitsvorschriften und darf nur in Laboren der Schutzstufe 3 durchgeführt werden.
Differentialdiagnose
Plötzlich auftretendes Fieber mit Gelbsucht und Blutungsneigungen bei entsprechendem Aufenthalt in den betroffenen Gebieten lassen am Beginn einer Gelbfieberinfektion differentialdiagnostisch auch an eine Malaria denken. Andere, mit Gelbsucht einhergehenden Infektionen sind auszuschließen, so alle klassischen Virushepatitiden, eine Leptospirose oder ein Rückfallfieber. Andere Virusinfektionen mit hämorrhagischem Fieber sind abzugrenzen, so eine Infektion mit Ebolaviren, dem Lassa-Virus, Marburg-Virus oder Junin-Virus. Hierbei ist das im Krankheitsverlauf sehr frühe Auftreten der Blutungsneigung („Spanische Flagge“ als Hautsymptom) eher typisch für Gelbfieber. Generalisierte, septische Verläufe von Herpes-simplex-Infektionen oder einer Herpes B können dem Gelbfieber sehr ähnliche Symptome aufweisen. Nicht-infektiöse Ursachen können ebenfalls mit einer Gelbsucht und einer verstärkten Blutungsneigung einhergehen, so beispielsweise verschiedene Formen der Vergiftung mit lebertoxischen Substanzen.
Behandlung
Für Gelbfieber existiert wie für alle von Flaviviren ausgelösten Krankheiten keine ursächliche Therapie. Wenn möglich, ist eine Einweisung in ein Krankenhaus (Hospitalisierung) vorzunehmen und aufgrund des in manchen Fällen sich schnell verschlechternden Krankheitszustandes ist eine intensivmedizinische Überwachung angebracht. Verschiedene Methoden zur akuten Behandlung der Krankheit zeigten in Studien wenig Erfolg, so ist eine passive Immunisierung nach dem Erscheinen von Symptomen wahrscheinlich ohne Effekt. Auch Ribavirin und andere antivirale Medikamente zeigten genauso wie Behandlungen mit Interferonen keine positiven Wirkungen in Gelbfieberpatienten.[10] Eine symptomatische Behandlung umfasst Maßnahmen zur Rehydratation und Gabe von Mitteln wie Paracetamol zur Schmerzlinderung. Auf Acetylsalicylsäure (z. B. Aspirin) sollte aufgrund seiner gerinnungshemmenden Wirkung verzichtet werden, da diese im Falle von inneren Blutungen, die bei Gelbfieber auftreten können, verheerend ist.
Vorbeugung
Die persönlichen Vorbeugemaßnahmen gegen Gelbfieber umfassen eine Impfung sowie das Vermeiden von Mückenstichen in Gebieten, in denen Gelbfieber endemisch vorkommt. Institutionelle Maßnahmen zur Präventionen von Gelbfieber umfassen Impfprogramme und Maßnahmen zur Kontrolle der krankheitsübertragenden Stechmücken.
Impfung
Bei Reisen in betroffene Gebiete wird dringend eine Impfung empfohlen, da insbesondere zugereiste, nicht-einheimische Personen von schweren Verlaufsformen betroffen sind. Der Impfschutz setzt bei 95 %[12] der Geimpften nach 10 Tagen ein und hält lebenslang[13]. Der attenuierte Lebendimpfstoff (Stamm 17D) wurde 1937[12] von Max Theiler aus einem verstorbenen Patienten aus Ghana isoliert und wird durch Vermehrung in bebrüteten Hühnereiern gewonnen. Die WHO empfiehlt, in endemischen Gebieten die Impfung routinemäßig zwischen dem 9. und 12. Lebensmonat durchzuführen.[6]
Relativ häufig (in ungefähr 20 % aller Fälle[14]) führt die Impfung zu milden, grippeähnlichen Symptomen. Sehr selten, in weniger als einem Fall auf 200.000 bis 300.000[12] Impfungen, kann eine YEL-AVD (yellow fever vaccine-associated viscerotropic disease) auftreten, welche in 60 % aller Fälle zum Tode führt. Dies ist sehr wahrscheinlich auf einen genetischen Defekt im Immunsystem zurückzuführen, jedoch wurde auch bei bestimmten Impfkampagnen eine 20-fach höhere Inzidenzrate beobachtet. Alter ist ein großer Risikofaktor, in Kindern liegt die Komplikationsrate ungefähr bei einem Fall auf 10 Millionen Impfdosen. Eine zweite schwere Nebenwirkung ist eine Infektion des Nervensystems, eine sogenannte YEL-AND (yellow fever vaccine-associated neurotropic disease). Diese Komplikation kann in einem Fall auf 200.000 bis 300.000 Impfungen auftreten, welche eine Meningoenzephalitis auslösen kann und in weniger als 5 %[12] der Fälle zum Tod führt.[6][10]
Der Impfstoff ist laut Hersteller nicht für Säuglinge unter sechs Monaten, laut WHO nicht unter neun Monaten geeignet. Bei Personen ab 60 Jahren ist wegen eines erhöhten Risikos schwerer Nebenwirkungen die Indikation für die Erstimpfung streng zu stellen. Schwangeren sollte der Impfstoff nur nach strenger Risiko-Nutzen-Abwägung verabreicht werden, da keine Daten zur Sicherheit vorliegen. Kontraindiziert ist die Impfung bei immunsupprimierten Personen; bei einer HIV-Infektion sollte nur bei vorhandener Immunfunktion eine Impfung vorgenommen werden. Weiterhin ist die Impfung bei Personen mit einer Erkrankung des Thymus nicht angezeigt. Aufgrund der Herstellungsmethode darf der Lebendimpfstoff nicht an Allergiker gegen Hühnereiweiß verimpft werden.[12] Zu einer vorherigen Gabe von Immunglobulinen (passive Impfung) muss bei Impfungen allgemein ein Abstand von mindestens drei Monaten eingehalten werden. Andere Lebendimpfstoffe (Mumps, Masern, Röteln) sollten entweder gleichzeitig oder im Abstand von vier Wochen verabreicht werden.[15] Um das Impfvirus nicht an den Transfusionsempfänger weiterzugeben, sollte nach der Impfung kein Blut gespendet werden (die empfohlene Wartezeit liegt bei 2 bis 4 Wochen).[16][17] Die Gelbfieber-Impfung darf nur durch speziell weitergebildete Ärzte verabreicht werden (sogenannte „Gelbfieber-Impfstelle“). Dies liegt an der Gefährlichkeit des Gelbfiebers, im früher sehr kompliziertem Umgang mit dem Impfstoff und dem Willen, maximale Sicherheit für die Betroffenen garantieren zu können. Ausführende Behörden in Deutschland sind die entsprechenden Ministerien der Bundesländer.[18]
Impfpflicht
Einige Länder Asiens sind zumindest theoretisch von Gelbfieber bedroht (Überträgermücke und infizierbare Affen nachgewiesen), ohne dass die Krankheit dort bislang vorkommt. Um zu vermeiden, dass das Virus eingeschleppt wird und sich auf Dauer festsetzen kann, verlangen diese und andere Länder von ausländischen Besuchern eine vorherige Impfung, wenn diese durch Gelbfiebergebiete gereist sind (auch Transit). Sie muss durch eine Impfbescheinigung nachgewiesen werden, die 10 Tage nach der Impfung gültig wird und lebenslang gilt. Eine Liste über alle Länder, die eine Gelbfieberimpfung verlangen, wird von der WHO veröffentlicht.[19] Kann die Impfung aus einem der oben beschriebenen Gründe nicht durchgeführt werden, ist eine Befreiung von der Impfpflicht möglich. Das in diesem Fall notwendige Impfbefreiungszeugnis (Exemption Certificate) wird durch eine von der WHO anerkannte Impfstelle ausgestellt.
Obwohl 32 der 44 Länder, in denen Gelbfieber endemisch vorkommt, Impfprogramme haben, sind auch in vielen dieser Länder weniger als 50 %[6] aller Personen geimpft.
Vektorkontrolle

Neben Impfungen ist die Kontrolle der Gelbfiebermücke (Aedes aegypti) von großer Bedeutung, besonders da dieselbe Mücke neben Gelbfieber auch weitere Krankheiten wie Dengue- und Chikungunyafieber übertragen kann. Die Gelbfiebermücke brütet bevorzugt in Wasseransammlungen, die von Bewohnern in Gebieten mit prekärer Trinkwasserversorgung selbst angelegt wurden oder die sich in Hausmüll ansammeln; insbesondere in Reifen, aber auch in alten Dosen und Plastikgefäßen. Besonders in der Nähe urbaner Zentren von Entwicklungsländern sind diese Bedingungen oft anzutreffen und bilden ein ausgezeichnetes Habitat für die Gelbfiebermücke. Bei der Bekämpfung der Mücke werden zwei Strategien verfolgt:
Einerseits werden Maßnahmen zur Abtötung der sich entwickelnden Larven ergriffen. Dabei werden neben Maßnahmen zur Verminderung der Larvengewässer vor allem Larvizide, larvenfressende Fische und Ruderfußkrebse (Copepoda) eingesetzt, welche direkt die Anzahl der Larven und somit indirekt die Anzahl der krankheitsübertragenden Mücken dezimiert. In Vietnam werden seit mehreren Jahren Ruderfußkrebse der Gattung Mesocyclops zur Bekämpfung des Denguefiebers eingesetzt (Gelbfieber kommt in Asien nicht vor), wobei die Ausführung der Maßnahmen monatlich überprüft wird. Dies führte dazu, dass in den betroffenen Gebieten seit 2001 kein Fall von Dengue-Fieber mehr auftrat; eine ähnliche Maßnahme ist wahrscheinlich auch gegen Gelbfieber effektiv, weil beide Maßnahmen auf denselben Organismus zielen. Als chemisches Larvizid wird vorwiegend Pyriproxyfen empfohlen, da es für Menschen ungefährlich ist und bereits in kleinen Mengen wirksam ist.[6]
Andererseits werden neben den Larven auch die erwachsenen Gelbfiebermücken bekämpft. Dabei werden Vorhänge und Abdeckungen von Wasserbehältern mit Insektizid behandelt und es kann Insektizid in den Innenräumen versprüht werden, was aber von der WHO nicht empfohlen wird. Wie gegen den Überträger der Malariakrankheit, die Anopheles-Mücke, werden auch gegen Gelbfiebermücken insektizidbehandelte Moskitonetze mit Erfolg eingesetzt.[6]
Geschichte

Die evolutionären Ursprünge des Gelbfieberviruses liegen sehr wahrscheinlich in Afrika.[20] Es wird vermutet, dass das Virus ursprünglich aus Ost- oder Zentralafrika kommt und sich von dort nach Westafrika ausbreitete. Nach Südamerika gelangten sowohl die Gelbfiebermücke als auch das Virus selbst wahrscheinlich durch den Schiffsverkehr, der nach 1492 einsetzte. Der erste wahrscheinliche Ausbruch der Krankheit fand 1648 dann auch in Yucatan statt, bei dem die Krankheit als xekik (Schwarzes Erbrechen) bezeichnet wurde. Mindestens 25 größere Ausbrüche folgten, so in Philadelphia 1793, bei dem einige Tausend Menschen starben und die amerikanische Regierung mitsamt dem damaligen Präsidenten George Washington gezwungen wurde, die Stadt zu verlassen.[21] Auch in Europa wurden gelegentliche Ausbrüche verzeichnet, so 1821 in Barcelona mit mehreren Tausend Toten. 1867 kam es in Florida zu einem Ausbruch auf Fort Jefferson. 1878 starben 20.000 Menschen bei einem Ausbruch im Mississippi-Tal, und der letzte Ausbruch in den USA erfolgte 1905 in New Orleans.[2]
Bereits 1881 stellte der kubanische Arzt und Wissenschaftler Carlos Juan Finlay die Hypothese auf, dass Stechmücken das Gelbfieber übertragen. Nachdem die amerikanische Invasion in Kuba in den 1890er Jahren 13 Mal so viele Todesopfer durch Gelbfieber wie durch militärische Operationen gefordert hatte, wurden weitere Experimente zu der „Moskito-Hypothese“ angestellt und der Arzt Walter Reed bewies, dass Gelbfieber tatsächlich durch Moskitos übertragen wurde. Tatsächlich aber hatte schon 1848 Josiah Clark Nott einen bemerkenswerten Artikel veröffentlicht, in dem er über das Gelbfieber und „die Gründe für die Vermutung, dass seine Ursache in einer Insekten-Lebensform zu suchen sei“ schrieb. Während Notts Argumente noch vage und ungenau ausgearbeitet waren, konnte die von Louis Daniel Beauperthuy 1853 veröffentlichte Diskussion, worin er Gelbfieber und andere Krankheiten als von Mosquitos verursacht beschrieb, nur als explizit bezeichnet werden.[22][23]
Gelbfieber war damit das erste Virus, dessen Übertragung durch Moskitos bewiesen wurde. Der amerikanische Armeearzt William C. Gorgas wandte diese Erkenntnis konsequent an und erzielte damit eine vollständige Elimination von Gelbfieber in Havanna und konnte auch beim Bau des Panamakanals erfolgreich gegen Gelbfieber vorgehen – nachdem ein französischer Versuch zum Bau des Kanals unter anderem an Gelbfieber und Malaria gescheitert war.[2]
1927 wurde das Gelbfiebervirus in Westafrika isoliert (Adrian Stokes gelang dies beim Nachweis der Übertragbarkeit auf Affen), was in den 1930er Jahren zur Entwicklung von zwei Impfstoffen gegen Gelbfieber führte. Der Impfstoff 17D wurde um 1937 von dem aus Südafrika stammenden Mikrobiologen Max Theiler am Rockefeller-Institut entwickelt. Er gewann den Impfstoff aus Hühnereiern und erhielt für diese Leistung 1951 den Nobelpreis für Medizin. Ein französisches Forscherteam entwickelte den Impfstoff FNV (french neurotropic vaccine), welchen sie aus den Gehirnen von Mäusen gewannen – da er aber mit einer höheren Inzidenz von Enzephalitis bei Kindern einherging, wurde dessen Verwendung ab 1961 nicht mehr empfohlen. 17D dagegen wird heute immer noch gebraucht und bisher über 400 Millionen Einzeldosen abgegeben. Seither wurden aber nur wenig Mittel in die Entwicklung neuer Impfstoffe investiert, was dazu führte, dass mit der über 60 Jahre alten Technologie die Impfstoffproduktion nicht schnell genug an die Bedürfnisse eines Gelbfieberausbruchs angepasst werden kann. Neuere Impfstoffe auf der Basis von Vero-Zellen sind in Entwicklung und sollen in Zukunft den Impfstoff 17D ablösen.[6]
Durch eine Politik der Vektorkontrolle und konsequenter Impfprogramme wurde der urbane Gelbfieberzyklus in Südamerika unter Kontrolle gebracht und seit 1943 wurde – abgesehen von einem urbanen Ausbruch in Santa Cruz de la Sierra (Bolivien) – kein durch die Gelbfiebermücke übertragenes Gelbfieber mehr festgestellt. Seit den 1980er Jahren steigt die Anzahl der Gelbfieberfälle in Südamerika jedoch wieder an und die Gelbfiebermücke ist wieder in die urbanen Zentren in Südamerika zurückgekehrt, unter anderem weil die Vektorkontrollprogramme wieder aufgegeben wurden. Auch wenn sich noch kein urbaner Zyklus etabliert hat, wird befürchtet, dass dies wieder stattfinden könnte. Bei einem Ausbruch in Paraguay im Jahre 2008 wurde ursprünglich befürchtet, es handle sich um einen urbanen Ausbruch, was sich aber nicht bewahrheitete.[6]
In Afrika dagegen wurden mehrheitlich Impfprogramme durchgeführt, um das Virus auszurotten. Dies gelang aber nicht, da der silvatische Zyklus erhalten blieb. Insbesondere nachdem die Maßnahmen zur Bekämpfung des Gelbfiebers wieder aufgegeben wurden und nur einige Länder die Gelbfieberimpfung in das reguläre Impfprogramm aufnahmen, breitete sich die Krankheit wieder aus.[6]
Potentielle biologische Waffe
Gelbfieber wurde von verschiedenen Regierungen, darunter auch der amerikanischen und möglicherweise der nordkoreanischen Regierung, als potentielle biologische Waffe untersucht. Das Programm der amerikanischen Regierung wurde 1969 offiziell eingestellt.[24] Im Zweiten Weltkrieg wurde ein Versuch unternommen, sämtliche amerikanische Armeeangehörige gegen Gelbfieber zu impfen, da sich die japanische Armee 1939 Gelbfieberviren beschaffen wollte, wovon die amerikanischen Geheimdienste wussten. Zu diesem Zeitpunkt war in den USA noch keine Gelbfieberimpfung von der FDA freigegeben worden und so wurde eine nicht anerkannte Impfung verwendet, was dazu führte, dass 330.000 Personen mit dem Hepatitis-B-Virus infiziert wurden (es handelt sich dabei um den größten Ausbruch dieser Viruserkrankung überhaupt).[25] Weiterhin wurde 1975 ein Großversuch der WHO in Indien, der mit amerikanischen Geldern durchgeführt wurde und bei dem die Bekämpfung der Gelbfiebermücke hätte untersucht werden sollen, von der indischen Regierung gestoppt, da indische Wissenschaftler befürchtet hatten, die amerikanische Regierung untersuche eigentlich die Möglichkeit, Gelbfieber als biologische Waffe zu benutzen.[26][27] Auch wird befürchtet, dass Terroristen das Gelbfiebervirus als biologische Waffe einsetzen könnten.[28]
Meldepflicht
Gelbfieber ist in Österreich gemäß § 1 Abs. 1 Nummer 1 Epidemiegesetz 1950 bei Verdacht, Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
In der Schweiz besteht Meldepflicht bei klinischem Verdacht, Todesfall sowie dem positiven und negativen Infektionsnachweis für den Erreger Gelbfieber-Virus durch den behandelnden Arzt bzw. das untersuchende Labor. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
In Deutschland ist Gelbfieber gemäß § 6 Infektionsschutzgesetz (IfSG) bei Verdacht auf ein virusbedingtes hämorrhagisches Fieber bzw. gemäß § 7 IfSG bei Nachweis des Krankheitserregers Gelbfiebervirus seitens des Arztes bzw. des Labors namentlich meldepflichtig. Diese Meldepflicht wendet sich an Ärzte usw.
Literatur
- Gelbfieber. Merkblatt für Ärzte. Robert Koch-Institut. Stand 29. Oktober 2010.
- Jari Vainio, Felicity Cutts: Yellow Fever (Memento vom 23. August 2000 im Internet Archive) (PDF, 86 S., 400 kB). WHO, London School of Hygiene and Tropical Medicine, 1998.
- W. Lang, Th. Löscher: Tropenmedizin in Klinik und Praxis. Thieme, Stuttgart 2000, ISBN 3-13-785803-8, S. 350–355.
- Gordon C. Cook, Alimuddin I. Zumla (Hrsg.): Manson’s Tropical Diseases. Saunders, London 2002, ISBN 0-7020-2640-9, S. 755–758.
- Th. Mertens, O. Haller, H.-D. Klenk (Hrsg.): Diagnostik und Therapie von Viruskrankheiten – Leitlinien der Gesellschaft für Virologie. 2. Auflage. Elsevier, München 2004, ISBN 3-437-21971-5, S. 77–82.
- E. D. Barnett: Yellow fever: epidemiology and prevention. In: Clinical Infectious Diseases. Band 44, Nummer 6, März 2007, S. 850–856, ISSN 1537-6591. doi:10.1086/511869. PMID 17304460. (Review).
- Paul de Kruif: Walter Reed. Die Verscheuchung des gelben Fiebers. In: Paul de Kruif: Mikrobenjäger. (Originalausgabe: Microbe Hunters. Harcourt, Brace & Co., New York 1926) Orell Füssli Verlag, Zürich/ Leipzig 1927; 8. Auflage ebenda 1940, S. 301–322.
Weblinks
- RKI Seiten zu Gelbfieber
- Gelbfieberimpfstellen in Deutschland, der Schweiz und Österreich
- Informationen des CDC zu Gelbfieber (englisch)
- WHO Factsheet (englisch)
- Liste aller Länder mit Impfempfehlung der WHO (Stand 2012) (Memento vom 21. Oktober 2014 im Internet Archive) (PDF; 405 kB)
- Immunität als Gottesgeschenk
Einzelnachweise
- Michael B. A. Oldstone: Viruses, Plagues, and History. 1. Auflage. Oxford University Press, 2000, ISBN 0-19-513422-2, S. 45.
- A. D. Barrett, S. Higgs: Yellow fever: a disease that has yet to be conquered. In: Annu. Rev. Entomol. Band 52, 2007, S. 209–229, doi:10.1146/annurev.ento.52.110405.091454, PMID 16913829.
- A. Sampath, R. Padmanabhan: Molecular targets for flavivirus drug discovery. In: Antiviral Research. Band 81, Nr. 1, Januar 2009, S. 6–15, doi:10.1016/j.antiviral.2008.08.004, PMID 18796313.
- D. Fontenille et al.: First evidence of natural vertical transmission of yellow fever virus in Aedes aegypti, its epidemic vector. In: Trans R Soc Trop Med Hyg. Band 91, Nr. 5, 1997, S. 533–535. PMID 9463659
- E. S. Jentes, G. Poumerol, M. D. Gershman: The revised global yellow fever risk map and recommendations for vaccination, consensus of the Informal WHO Working Group on Geographic Risk for Yellow Fever. In: Lancet Infect Dis. Band 11, 2011, S. 622–632.
- M. A. Tolle: Mosquito-borne diseases. In: Curr Probl Pediatr Adolesc Health Care. Band 39, Nr. 4, April 2009, S. 97–140, doi:10.1016/j.cppeds.2009.01.001, PMID 19327647.
- WHO | Yellow fever. Abgerufen am 13. August 2009.
- RKI-Merkblatt zu Gelbfieber, abgerufen am 15. März 2015: http://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Gelbfieber.html
- C. Chastel: Centenary of the discovery of yellow fever virus and its transmission by a mosquito (Cuba 1900–1901). In: Bull Soc Pathol Exot. Band 96, Nr. 3, August 2003, S. 250–6, PMID 14582304 (französisch).
- T. P. Monath: Treatment of yellow fever. In: Antiviral Res. Band 78, Nr. 1, April 2008, S. 116–124, doi:10.1016/j.antiviral.2007.10.009, PMID 18061688.
- Susanne Modrow, Dietrich Falke, Uwe Truyen: Molekulare Virologie – Eine Einführung für Biologen und Mediziner. 2. Auflage. Spektrum Akademischer Verlag, 2002, ISBN 3-8274-1086-X, S. 182.
- A. D. Barrett, D. E. Teuwen: Yellow fever vaccine – how does it work and why do rare cases of serious adverse events take place? In: Current Opinion in Immunology. Band 21, Nr. 3, Juni 2009, S. 308–313, doi:10.1016/j.coi.2009.05.018, PMID 19520559.
- Yellow fever vaccination booster not needed. Abgerufen am 7. Juni 2013.
- Supplementary information on vaccine safety. (PDF) (Nicht mehr online verfügbar.) Archiviert vom Original am 26. April 2003; abgerufen am 11. Oktober 2009.
- Mitteilung der Ständigen Impfkommission (STIKO) am RKI: Zu Nebenwirkungen und vereinzelten Komplikationen nach Gelbfieber-Impfung. In: Epidemiologisches Bulletin. Nr. 44, 2001 (rki.de [PDF; abgerufen am 28. Februar 2013]).
- Donating Blood: Eligibility Criteria by Topic. Abgerufen am 28. Februar 2013.
- BLUTSPENDE NACH IMPFUNGEN. (Nicht mehr online verfügbar.) Ehemals im Original; abgerufen am 11. Oktober 2009. (Seite nicht mehr abrufbar, Suche in Webarchiven)
- Dr. med. Frühwein Abgerufen am 8. August 2017.
- Liste aller Länder mit Impfempfehlung der WHO. (PDF; 436 kB) (Nicht mehr online verfügbar.) Archiviert vom Original am 21. April 2009; abgerufen am 11. Oktober 2009.
- E. A. Gould, X. de Lamballerie, P. M. Zanotto, E. C. Holmes: Origins, evolution, and vector/host coadaptations within the genus Flavivirus. In: Advances in Virus Research. Band 59, 2003, S. 277–314, PMID 14696332.
- Yellow Fever Attacks Philadelphia, 1793. In: EyeWitness to History. Abgerufen am 14. August 2009.
- Josiah Clark Nott: Yellow fever contrasted with bilious fever: reasons for believing it a disease sui generis – its mode of propagation – remote cause – probable insect or animalcular origin. In: New Orleans medical and surgical journal. Band 4, 1848, S. 563–601.
- C. C. Dauer, G. M. Carrera: Carlos Finlay's Contribution to the Epidemiology of Yellow Fever. In: Yale J Biol Med. Band 9, Nr. 6, Juli 1937, S. 584.1–588, PMC 2601738 (freier Volltext).
- L. Borio, T. Inglesby, CJ. Petersu. a.: Hemorrhagic fever viruses as biological weapons: medical and public health management. In: JAMA. Band 287, Nr. 18, Mai 2002, S. 2391–2405, PMID 11988060.
- M. Furmanski: Unlicensed vaccines and bioweapon defense in World War II. In: JAMA. Band 282, Nr. 9, September 1999, S. 822, PMID 10478686.
- K. Powell, K. S. Jayaraman: Mosquito researchers deny plotting secret biowarfare test. In: Nature. Band 419, Nr. 6910, Oktober 2002, S. 867, doi:10.1038/419867a, PMID 12410269.
- Narender K. Seghal: Doubts over US in India. In: Nature. Band 251, 20. September 1974, S. 177.
- Potential Biological Weapons Threats. Abgerufen am 14. Oktober 2009.
