Hepatitis C
Die Hepatitis C ist eine durch das Hepatitis-C-Virus verursachte Infektionskrankheit beim Menschen. Sie zeichnet sich durch eine hohe Rate der Chronifizierung aus (bis 80 %), die im Verlauf zu schweren Leberschädigungen wie der Leberzirrhose und dem Leberzellkarzinom führen kann. Die Übertragung erfolgt parenteral über Blut. Eine Therapie der chronischen Hepatitis C, also die vollständige Viruseliminierung, ist durch den Einsatz von direkt antiviral wirksamen Substanzen in bis zu 99 % der Fälle möglich.[1] Eine Impfung gegen Hepatitis C gibt es bisher nicht.
| Klassifikation nach ICD-10 | |
|---|---|
| B17.1 | Akute Virushepatitis C |
| B18.2 | Chronische Virushepatitis C |
| ICD-10 online (WHO-Version 2019) | |
Für die Entdeckung des Virus wurden im Jahr 2020 Harvey J. Alter, Michael Houghton and Charles M. Rice mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet.[2]
Erreger
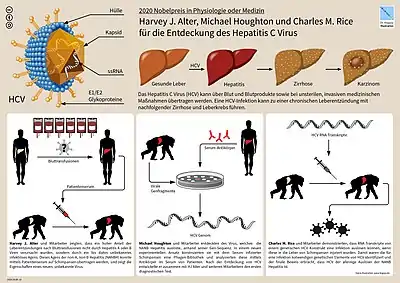
Das Hepatitis-C-Virus (HCV) wurde im Jahre 1989 mit Hilfe gentechnischer Methoden (Nachweis des Erbmaterials) erstmals identifiziert[3] (vorher Hepatitis non-A non-B). Es ist ein 45 nm großes behülltes Einzel(+)-Strang-RNA-Virus und gehört zur Gattung Hepacivirus der Familie der Flaviviridae. Man kann sieben Genotypen und 67 Subtypen unterscheiden.[4] So findet man beispielsweise in Europa und in den USA vorwiegend die Genotypen 1, 2 und 3 und in Afrika Typ 4. Bisher war man davon ausgegangen, dass der Mensch der einzige natürliche Wirt des Hepatitis-C-Virus ist. Ein internationales Wissenschaftsteam hat auf der Suche nach dem Ursprung des Erregers in Nagetieren viele Varianten von HCV-ähnlichen Viren gefunden. In Fledermäusen konnten Antikörper gegen den Erreger nachgewiesen werden. Deshalb wird jetzt davon ausgegangen, dass sich diese Virus-Familie ursprünglich in Nagetieren entwickelt hat.[5]
Übertragung
Bei etwa 30 % der Erkrankungen lässt sich im Nachhinein der Infektionsweg nicht mehr nachvollziehen. Erhöhte Infektionsgefahr besteht heute für Konsumenten von Drogen wie Heroin, die intravenös konsumieren und dasselbe Spritzbesteck mit anderen Konsumenten teilen, wie auch für Personen mit nasalem Drogenkonsum durch gemeinsame Benutzung von (Schnupf)röhrchen. Auch Tätowierungen und Piercings sind bei Verwendung verunreinigter Instrumente ein Risikofaktor. Häufige Infektionswege sind die Verletzung mit spitzen und scharfen Instrumenten (Nadelstichverletzung (NSV)) bei gleichzeitiger Übertragung kontaminierten Blutes. Das Risiko der Ansteckung nach einer NSV mit bekannt positiver Indexperson wird in der Literatur mit 3 bis 10 Prozent angegeben. Es ist damit höher als das durchschnittliche Risiko der Übertragung von HIV, scheint aber wie beim HIV stark abhängig von der Virämie der Indexperson zu sein.
Auch betroffen waren bis etwa zum Jahr 1990 Hämophilie-Patienten, die zum Beispiel bei operativen Eingriffen auf Spenderblut/-plasma oder auf aus Menschenblut hergestellte Gerinnungspräparate angewiesen waren. Damals wurden Hepatitis C und auch B vielfach unbemerkt auf diese Patienten übertragen. Mit der Einführung moderner Testverfahren, mit deren Hilfe heute über 99 % der Hepatitis-C-positiven Spender identifiziert werden können, besteht nur noch ein minimales Risiko einer Ansteckung durch eine Blutübertragung. Ein weiterer möglicher Infektionsweg ist eine Lebertransplantation.
Die sexuelle Übertragung der Hepatitis C ist selten. Da das Virus durch Blut übertragen wird, sind Sexualpraktiken, die ein höheres Risiko von Schleimhautverletzungen beinhalten, wie der ungeschützte Analverkehr, mit höherem Risiko behaftet. Die Häufigkeit der Übertragung des Virus von der schwangeren Mutter auf das ungeborene Kind wird bei einer komplikationslosen Entbindung auf unter 5 % geschätzt. Bei einer Koinfektion mit dem HI-Virus kann die Übertragung auf bis zu 14 % steigen.
Die Inkubationszeit liegt zwischen 2 und 26 Wochen (6 Monaten).
Epidemiologie
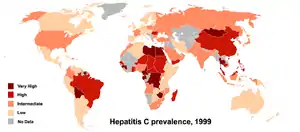
Die Prävalenz beträgt weltweit 2,6 %, in Deutschland 0,5 % und in den Hochrisikogebieten der Welt (dunkelrote Gebiete auf der Karte) 5,0 % und mehr – in der Mongolei bis 48 %.[6]
Zur epidemiologischen Situation der Hepatitis C werden jedes Jahr durch das Robert Koch-Institut (RKI) Zahlen veröffentlicht. Diese belaufen sich für das Jahr 2005 auf 8308 gemeldete Erstdiagnosen in Deutschland.[7] Davon wurden etwas mehr als 50 % labordiagnostisch festgestellt und waren ohne typisches klinisches Krankheitsbild. Die Unterscheidung zwischen akuten und schon länger bestehenden HCV-Infektionen ist labordiagnostisch nicht möglich.
Weltweit sind etwa 170 Millionen Menschen mit dem HC-Virus infiziert, in Deutschland sind 400.000 bis 500.000 Menschen davon betroffen.[8] Die Hauptrisikogruppe für eine HCV-Infektion sind intravenös injizierende Drogenkonsumenten, von denen 60 bis 90 Prozent Träger von HCV sind.[9] Umgekehrt wiesen in einer US-amerikanischen Untersuchung 48,4 % aller anti-HCV-positiven Personen im Alter zwischen 20 und 59 Jahren einen intravenösen Drogenkonsum auf.[10]
Die beim RKI für Deutschland gemeldeten Fallzahlen haben sich seit dem Jahr 2000 folgendermaßen entwickelt:
| Jahr | gemeldete Fallzahlen |
|---|---|
| 2000 | 5091[11] |
| 2001 | 4350[12] |
| 2002 | 6698[13] |
| 2003 | 8762[14] |
| 2004 | 8955[15] |
| 2005 | 8357[16] |
| 2006 | 7560[17] |
| 2007 | 6867[18] |
| 2008 | 6223[19] |
| 2009 | 5431[20] |
| 2010 | 4998[21] |
| 2011 | 5056[22] |
| 2012 | 4996[23] |
| 2013 | 5168[24] |
| 2014 | 5825[25] |
| 2015 | 4872[26] |
| 2016 | 4422[27] |
| 2017 | 4733[28] |
| 2018 | 5899[29] |
| 2019 | 6633[29] |
Diagnostik
Die Diagnose erfolgt durch Nachweis virusspezifischer Antikörper gegen Struktur- und Nichtstrukturproteine mittels Enzymimmunoassays und Immunoblots sowie durch Nachweis von Teilen des Virusgenoms (HCV-RNA) mittels Polymerase-Kettenreaktion (RT-PCR). Liegen ein sicher positiver Antikörpertest und eine im Abstand von mindestens drei Monaten mehrfach negative PCR vor, so kann von einer früheren ausgeheilten Infektion ausgegangen werden. Eine Leberbiopsie oder eine Lebersonographie können zuverlässige Aussagen über das Stadium der Krankheit (Stadium der Gewebsschädigung) treffen. Anders als bei anderen Hepatitiden sind die Transaminase-Werte des Bluts (GGT, GPT, GOT) häufig von der Schwere bzw. dem Stadium der Erkrankung unabhängig und daher kein sicherer Marker für den tatsächlichen Krankheitsverlauf.
Verlauf
Die Hepatitis C wird in der Akutphase aufgrund des meist symptomlosen oder symptomarmen Verlaufs (in 85 % der Fälle) oftmals nicht diagnostiziert. Mögliche Beschwerden nach einer Inkubationszeit von 20 bis 60 Tagen sind Müdigkeit, Abgeschlagenheit, Appetitlosigkeit, Gelenkschmerzen, Druck- oder Spannungsgefühl im rechten Oberbauch, möglicherweise auch ein Gewichtsverlust. Bei einigen Betroffenen kommt es zu einer Gelbsucht; der Urin kann sehr dunkel, der Stuhl lehmfarben sein.[30] Damit wird die Erkrankung in vielen Fällen vom Betroffenen gar nicht oder lediglich als vermeintlicher grippaler Infekt wahrgenommen. Die Akutphase geht jedoch in mehr als 70 % der Fälle in eine chronische Verlaufsform über. Aufgrund der hohen Virusvariabilität und der wahrscheinlich spezifischen Unterdrückung einer ausreichenden T-Zell-Antwort kommt es zu einer ständigen Vermehrung des Virus und damit zu einer chronischen Infektion.
Bleibt die Infektion dann unbehandelt, so führt sie bei ca. einem Viertel der Patienten im Langzeitverlauf nach etwa 20 Jahren zur Leberzirrhose. Außerdem besteht ein erhöhtes Risiko für ein Leberzellkarzinom.
Im Verlauf einer chronischen HCV-Infektion kann es zu weiteren, meist antikörpervermittelten Erkrankungen kommen. Zu diesen zählen die Kryoglobulinämie (besonders häufig bei Genotyp 2), das Sjögren-Syndrom, die Panarteriitis nodosa und eine Immunkomplex-Glomerulonephritis. Im gesicherten kausalen Zusammenhang mit der HCV-Infektion werden als extrahepatische Erkrankungen die Insulinresistenz/Diabetes mellitus, eine kryoglobuliämische Vaskulitis, lymphoproliferative Erkrankungen, eine Einschränkung der Leistungsfähigkeit (Müdigkeit, Abgeschlagenheit) sowie depressive Symptome beschrieben.[31]
Therapie
Standardtherapie und Therapiealgorithmen
Eine akute Hepatitis C wurde gemäß der 2009 angewandten Standardtherapie nach dreimonatigem Abwarten und weiterbestehendem positiven HCV-RNA-Befund ähnlich wie die chronische Hepatitis C mit PEG-Interferon alpha 2-b zusammen mit Ribavirin virostatisch behandelt. Alternativ kam auch die sofortige Gabe allein des Interferons über sechs Monate in Betracht.[32]
Als Standardtherapie für HCV Genotypen 1 und 4 wurde 2015 eine Kombination von Sofosbuvir und Ledipasvir (Harvoni®), für HCV Genotypen 2 und 3 eine Kombination von Sofosbuvir und Ribavirin, für HCV Genotypen 5 und 6 eine Kombination von Ledipasvir und Sofosbuvir und Ribavirin, oder als Alternative bei HCV Genotyp 3 eine Kombination von Daclatasvir und Sofosbuvir, empfohlen.[33]
Die „aktuelle Empfehlung zur Therapie der chronischen Hepatitis C“ der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) nennt als „Zugelassene Medikamente“ zur Therapie der Hepatitis C (Stand: 7/2015):[33]
- konventionelle Therapie:
- Peginterferon α zur Erst- und Re-Therapie für alle Genotypen
- Ribavirin als Kombinationstherapie zur Erst- und Re-Therapie für alle Genotypen
- Proteaseinhibitoren:
- Simeprevir (Olysio® von Janssen Pharmaceutica) als Kombinationstherapie zur Erst- und Re-Therapie für die Genotypen 1 und 4
- Paritaprevir (Pharmazeutischer Unternehmer: AbbVie) als Kombinationstherapie zur Erst- und Re-Therapie für die Genotypen 1 und 4
- Asunaprevir, Ciluprevir, Danoprevir, Glecaprevir, Grazoprevir, Narlaprevir, Sovaprevir, Vaniprevir, Voxilaprevir
- nicht mehr als Standardtherapie empfohlen:
- Telaprevir (EU: Incivo®, Pharmazeutischer Unternehmer: Janssen-Cilag, USA: Incivek®, Pharmazeutischer Unternehmer: Vertex Pharmaceuticals) als Kombinationstherapie zur Erst- und Re-Therapie für den Genotyp 1
- Boceprevir (Victrelis®, Pharmazeutischer Unternehmer: MSD Sharp & Dohme) als Kombinationstherapie zur Erst- und Re-Therapie für den Genotyp 1
- Faldaprevir, Vedroprevir
- NS5A-Inhibitoren:
- Daclatasvir (Daklinza®, Pharmazeutischer Unternehmer: Bristol-Myers Squibb) als Kombinationstherapie zur Erst- und Re-Therapie für die Genotypen 1 – 6
- Ledipasvir (Pharmazeutischer Unternehmer: Gilead Sciences) als Kombinationstherapie zur Erst- und Re-Therapie für die Genotypen 1, 3, 4 und 6
- Ombitasvir (Pharmazeutischer Unternehmer: AbbVie) als Kombinationstherapie zur Erst- und Re-Therapie für die Genotypen 1 und 4
- Elbasvir, Odalasvir, Pibrentasvir, Ravidasvir, Ruzasvir, Samatasvir, Velpatasvir
- Nicht-nukleosidische Polymerase (NS5B)-Inhibitoren:
- Dasabuvir (EU: Exviera®, Pharmazeutischer Unternehmer: AbbVie) als Kombinationstherapie zur Erst- und Re-Therapie für den Genotyp 1
- Beclabuvir, Deleobuvir, Filibuvir, Setrobuvir, Radalbuvir, Uprifosbuvir
- Nukleos(t)idische Polymerase (NS5B)-Inhibitoren:
- Sofosbuvir (Sovaldi®, Pharmazeutischer Unternehmer: Gilead Sciences) als Kombinationstherapie zur Erst- und Re-Therapie für alle Genotypen
Sofosbuvir ist der dritte DAA-Wirkstoff (als ‘direct antiviral agent’, ‘direct-acting antiviral agent’, „direkt antivirale Substanz“ oder „direkt wirksamer antiviraler Arzneistoff“ bezeichnet), der in die Replikation des Virus eingreift, jedoch der erste Polymerase-Inhibitor.[34][35][36]
Anfang 2015 erfolgte ein Addendum der DGVS zu ihrer Leitlinie von 2014, welche die interferonfreie Kombinationstherapie mit Sofosbuvir und Ribavirin für die Ersttherapie bei Genotyp 2 empfiehlt.[37]
Aus der Gruppe der NS5A-Inhibitoren wurde 2014 Ledipasvir als Kombinationspräparat mit Sofosbuvir (Harvoni®) in der EU zugelassen.[38]
Eine zugelassene Kombinationstherapie von AbbVie (Viekirax®) besteht aus Ombitasvir, Paritaprevir und Ritonavir.[39]
Ehemalige Standardtherapie
Die Standardbehandlung bestand (Stand 2009) aus einer kombinierten Therapie mit pegyliertem Interferon α (Peginterferon alfa-2a bzw. Peginterferon alfa-2b) und dem Virostatikum Ribavirin über eine Dauer von 24 bis 48, selten 72 Wochen. Peg-Interferon wird einmal wöchentlich als Spritze unter die Haut gesetzt, Ribavirin wird täglich in Tablettenform (bei Kindern teilweise auch flüssig) verabreicht.
Ziel der Behandlung ist, dass sechs Monate nach dem Therapieende weiterhin kein Virus mehr nachweisbar ist (HCV-RNA negativ). Ist dieser Punkt erreicht, gelten Patienten als geheilt. Spätere Rückfälle sind sehr selten.
Abhängig von dem beim Patienten vorliegenden Genotyp des Virus besteht mit dieser Therapie eine Chance von etwa 50 bis 80 %, das Virus dauerhaft zu eliminieren. Bei den Genotypen 2 und 3 ist die Erfolgswahrscheinlichkeit deutlich höher als beim Genotyp 1. Weitere wichtige Faktoren für einen Therapieerfolg sind Alter, Geschlecht, Viruslast, Dauer der Erkrankung, Körpergewicht und Schädigungsgrad der Leber. Zusätzliche Erkrankungen wie eine HIV- oder Hepatitis-B-Infektion können den Therapieerfolg erschweren.
Inzwischen wird die Therapiedauer nicht nur nach dem Genotyp angepasst, sondern auch danach, wie schnell oder langsam die Virusmenge in den ersten 4, 12 und ggf. 24 Wochen abfällt.
Bei der Hepatitis-C-Behandlung ist mit zahlreichen Nebenwirkungen zu rechnen, die je nach Patient unterschiedlich stark ausgeprägt sind. (Peg)-Interferon α kann unter anderem zu grippalen Symptomen (Fieber, Schüttelfrost), Müdigkeit, leichtem Haarausfall, Fehlfunktionen der Schilddrüse und psychischen Nebenwirkungen wie Depressionen, Aggressionen oder Angstzuständen führen. Wenn Patienten bereits eine Vorgeschichte von Depressionen haben, kann in ausgewählten Fällen bereits vor Beginn einer Interferon-Therapie ein Antidepressivum gegeben werden. Die häufigste Nebenwirkung von Ribavirin ist eine Verminderung der roten Blutkörperchen (Hämolyse); diese kann dazu führen, dass die Ribavirin-Dosis reduziert und in schweren Fällen die Therapie vorzeitig beendet wird. Da eine ausreichende Ribavirinmenge wichtig für die Heilungschancen ist, versucht man jedoch, Dosisreduktionen möglichst zu vermeiden.
Die Entscheidung für oder gegen eine Therapie wird individuell gefällt. Wichtig für die Entscheidung sind der jeweilige Krankheitsverlauf, eventuelle Kontraindikationen und die voraussichtlichen Therapiechancen, aber auch die Lebenssituation des Betroffenen. Die Behandlung sollte von einem therapieerfahrenen Arzt durchgeführt und überwacht werden.
Eine neue Studie zeigte, dass es Patienten einer akuten Hepatitis C einen Vorteil bringen kann, wenn der Therapiebeginn einige Wochen hinausgezögert wird. So konnte bei einem Fünftel der Patienten eine spontane Ausheilung erfolgen, es war danach keine Therapie mehr notwendig.[40]
Neue Medikamente
Neben neuen Interferonen und Ribavirin-Ersatzstoffen forscht man auch an Mitteln, die das Virus direkt an der Vermehrung behindern (Protease- und Polymerasehemmer). Im Jahre 2011 wurden die Proteaseinhibitoren Telaprevir und Boceprevir in den USA, in der EU und in Japan zugelassen.[41][42] Sowohl Boceprevir als auch Telaprevir müssen mit Peg-Interferon und Ribavirin kombiniert werden. Beide Substanzen sind nur für den Genotyp 1 des Hepatitis-C-Virus zugelassen. Protease- und Polymerasehemmer senken als Einzelsubstanzen die Viruslast (etwa auf Werte unter 600.000 IU/ml[43]) deutlich ab, rufen aber rasch Resistenzen hervor, wodurch die Virenmenge wieder ansteigt. Dreifachtherapien mit Telaprevir bzw. Boceprevir sind beim Genotyp 1 deutlich wirksamer, jedoch sind Nebenwirkungen und Wechselwirkungen mit anderen Medikamenten zu beachten. Telaprevir wie auch Boceprevir können die Blutarmut (Anämie) verstärken. Bei Telaprevir werden Hautausschläge und Juckreiz im Analbereich häufiger beobachtet. Bei Boceprevir können öfter Geschmacksstörungen (Dysgeusien) auftreten.[44][45]
Neben antiviralen Substanzen in Kombination mit Peg-Interferon und Ribavirin forscht man auch an interferonfreien Therapien gegen Hepatitis C.[46] Im April 2011 wurde auf dem Leberkongress EASL erstmals von interferonfreien Heilungen unter kontrollierten Bedingungen berichtet: 4 von 11 Hepatitis-C-Patienten mit Genotyp 1 wurden durch eine interferonfreie Behandlung mit Asunaprevir und Daclatasvir geheilt.[47] Daclatasvir und andere überzeugen vor allem durch die relativ kurz notwendige Therapie, da es ab dem ersten Tag zur Verminderung der Viruslast kommt.[48] Weitere interferonfreie Kombinationstherapien sind in Erforschung.[49] Eine 12-wöchige Kombinationstherapie aus GS-7977 (PSI-7977) mit Ribavirin konnte 10 von 10 Hepatitis-C-Patienten mit dem Genotyp 2 und 3 heilen,[50] diese Zweifachkombination reichte aber bei erfolglos vorbehandelten HCV-Genotyp-1-Patienten („Null-Responder“ ohne Rapid Virological Response und ohne Early Virological Response[51]) nicht zur Heilung aus.[52]
Eine Kombination von Sofosbuvir und Velpatasvir (Epclusa®[53]) hat in einer Studie eine Heilungsrate von 99 % erbracht.[54]
Vorbeugung
Es ist kein Impfstoff zur aktiven Immunisierung gegen Hepatitis C zugelassen. Bisherige Schutzmaßnahmen beschränken sich auf die Verhinderung der Exposition, indem Blut-zu-Blut-Kontakte mit Infizierten vermieden werden, also beispielsweise bei intravenösem Drogenkonsum jeder nur seine eigene Spritze und Nadel verwendet. Um die Versuchung zum gemeinsamen Spritzengebrauch zu vermindern, bieten Drogenberatungsstellen kostenlos Injektionsbestecke an. Infizierte sollten lernen, „Blut-Vorsicht“ zu üben (AIDS-Hilfe). Dazu gehört überwiegend, auf mögliche Blutkontakte aufmerksam zu werden und die gemeinsame Benutzung von Nagelscheren, Rasiermessern und Zahnbürsten mit Nicht-Infizierten zu vermeiden. Zudem sollten beim Geschlechtsverkehr Flüssigkeitsbarrieren wie Kondome und "Dental Dams" (Lecktücher) benutzt werden.
Es gibt keine Postexpositionsprophylaxe nach einer Infektion mit Hepatitis C, wie sie bei Hepatitis B oder HIV bekannt ist. Wird Hepatitis C im ersten halben Jahr nach der Infektion entdeckt und behandelt, kann eine 24-wöchige Interferon-Therapie in mehr als 90 % der Fälle zur Heilung führen, bevor die Erkrankung einen chronischen Verlauf nimmt.
Übertragung von Hepatitis-C-Viren durch ärztliche Maßnahmen
Übertragung im Rahmen einer Bilharziose-Behandlung
Während der 1950er bis in die 1980er Jahre bekämpften die ägyptischen Gesundheitsbehörden zusammen mit der Weltgesundheitsorganisation die dort sehr häufige Bilharziose mit organisierten Kampagnen, bei denen den Erkrankten Brechweinstein (tartar emetic) injiziert wurde. Vermutlich über nicht ausreichend desinfizierte Kanülen kam es zu Ansteckungen mit dem Hepatitis-C-Virus. In späteren serologischen Untersuchungen waren bei 70–90 % aller Fälle von chronischer Hepatitis, Leberzirrhose und Leberzellkarzinomen die Virusantigene nachzuweisen. Die Zahl der betroffenen Personen wird auf sechs Millionen geschätzt. Da die genannten Komplikationen einer Hepatitis-C-Virusinfektion häufig erst nach zwanzig Jahren auftraten, steht nach Ansicht von Infektiologen der Höhepunkt in der Epidemie von Leberkrankheiten in Ägypten noch bevor.[55] Es handelt sich vermutlich um den schwersten Fall von durch ärztliche Maßnahmen (iatrogen) übertragenen Krankheitserregern in der Geschichte.[56]
Übertragung im Rahmen einer Anti-D-Immunprophylaxe
Die Anti-D-Immunprophylaxe soll dazu dienen, bei einer Mutter, der der Rhesusfaktor D fehlt (rhesus-negativ), in einer zweiten Schwangerschaft eine Abstoßungsreaktion gegen einen rhesus-positiven Fötus zu unterbinden. Bei der Geburt gelangt immer Blut des Kindes in den Blutkreislauf der Mutter. Ist die Frau rhesus-negativ, ihr Kind dagegen rhesus-positiv, so kann die Frau Antikörper gegen den für sie fremden Rhesusfaktor entwickeln. Bei einer weiteren Schwangerschaft mit einem ebenfalls rhesus-positiven Fötus können die mütterlichen Antikörper dann die Plazenta passieren und zu Behinderungen beim Fötus bis hin zum Absterben führen. Um das zu vermeiden, werden direkt nach der Geburt des ersten und weiterer Kinder Anti-D-Immunglobuline gespritzt und so die nachfolgenden Geschwister geschützt.
Deutschland
In der DDR war die Anti-D-Immunprophylaxe gesetzlich vorgeschrieben. In den Jahren 1978 und 1979 erhielten dabei mehrere tausend Frauen – in Presseberichten war von 6.700 die Rede[57] – mit Hepatitis-C-Viren verseuchte Immunglobuline. Der Hersteller (BIBT Halle) und Patentinhaber der DDR-Anti-D-Immunprophylaxe hatte 1978 bereits vor der Produktion der relevanten Serum-Chargen von der Hepatitis-C-Viruskontamination des Ausgangsmaterials (Blutplasma) Kenntnis.[58] Die Spender des Blutplasmas (Produktionsrohstoff der Anti-D-Immunprophylaxe) befanden sich wegen akuter Non-A-non-B-Hepatitis (Hepatitis-C-Virus) in stationärer Behandlung, und damit stand bereits vor der AntiD-Serumherstellung fest, dass das von den stationär Erkrankten gespendete Blutplasma Non-A-non-B-(Hepatitis-C-) viruskontaminiert sein musste. Es handelte sich somit nicht nur um einen Arzneimittelskandal, sondern um die größte Arzneimittelstraftat der DDR, wie in den Akten der nicht öffentlichen Hauptverhandlung des 4. Strafsenats des Bezirksgerichts Halle/Saale (Aktenzeichen 4 BS 13/79 vom 27. November 1979) dokumentiert ist. Die viruskontaminierten Chargen waren vom Bezirksinstitut für Blutspende- und Transfusionswesen des Bezirks Halle (BIBT) und vom Staatlichen Kontrollinstitut für Seren und Impfstoffe (Quelle: Ermittlungsakten zu Aktenzeichen 4 BS 13/79) freigegeben worden. Die AntiD-Arzneimittel-Straftatsopfer wurden zunächst nach dem Gesetz zur Verhütung und Bekämpfung übertragbarer Krankheiten beim Menschen (GüK) der DDR unterstützt. Die Bundesregierung im wiedervereinigten Deutschland argumentierte dann, die Entschädigung sei Ländersache. Die betroffenen Frauen galten als impfgeschädigt und erhielten deswegen Leistungen nach dem Bundesseuchengesetz. Am 9. Juni 2000 verabschiedete der Bundestag das Anti-D-Hilfegesetz, wonach infizierte Frauen, ihre nach der Immunprophylaxe geborenen infizierten Kinder sowie andere infizierte Kontaktpersonen einen Anspruch auf Krankenbehandlung und finanzielle Hilfe haben. Die Rentenleistungen liegen zwischen 271 und 1082 Euro monatlich (Stand: 2004); 2464 Anträge wurden anerkannt. Der Höhepunkt der Einmalzahlungen wurde im Jahr 2000 mit sieben Millionen Euro erreicht; außerdem werden jährlich rund zwei Millionen Euro an Renten ausgezahlt, die mindestens zur Hälfte vom Bund finanziert werden. 2001 prüfte der Bundesrechnungshof die Umsetzung des Gesetzes und bemängelte den uneinheitlichen Umgang mit den Anträgen in den Ländern; er regte eine schärfere Bundesaufsicht an.[59] Nach der Zahl der Betroffenen handelt es sich – nach dem Contergan-Skandal – um den größten Arzneimittelskandal der deutschen Nachkriegsgeschichte.
Für die im sogenannten Bluterskandal in den 1990er Jahren mit HIV infizierten Personen liegt in 90 Prozent der Fälle eine Koinfektion durch mit Hepatitis-C-Virus verseuchten Blutprodukten vor. Des Weiteren betraf dieser Blutskandal auch noch ca. 1200 weitere hämophile Patienten, die nicht mit dem HI-Virus koinfiziert wurden.[60] Diese Infektionen hätten wie die HIV-Infizierung bei entsprechender Virusinaktivierung der Gerinnungspräparate verhindert werden können. Bis zum heutigen Zeitpunkt (Stand Sommer 2019) gibt es keinerlei Entschädigungsleistung für diesen Hepatitis-C-Blutskandal.
Irland
In Irland werden Blutspenden seit Oktober 1991 auf Antikörper gegen das Hepatitis-C-Virus getestet. In einer regionalen Studie stellte sich dabei heraus, dass 13 von 15 infizierten Frauen rhesus-negativ waren (zu erwarten gewesen wären drei); sie waren zugleich erheblich älter als der Durchschnitt der Spender. Zwölf dieser Frauen hatten 1977 eine Anti-D-Immunprophylaxe erhalten. Diese Entdeckung löste eine Vertrauenskrise in den Blutspendedienst (Irish Blood Transfusion Service Board) aus. 1996 wurde eine nationale Untersuchungskommission eingerichtet. Über 62.000 Frauen, die zwischen 1970 und 1994 eine Immunprophylaxe erhalten hatten, wurden getestet, wobei sich bestätigte, dass Chargen von Anti-D-Immunglobulinen, die 1977 und 1978 verwendet worden waren, mit Hepatitis-C-Viren kontaminiert gewesen waren. Die Kommission kam zu dem Ergebnis, dass das Blutplasma einer einzigen kontaminierten Person zu der Verseuchung geführt hatte. 1997 wurde ein Tribunal eingerichtet, das über Entschädigungsansprüche entscheiden sollte. Von 1871 Anträgen wurden 1042 (Stand: November 1998) als berechtigt anerkannt und Entschädigungen im Gegenwert von insgesamt 219 Millionen US-Dollar gezahlt. Das entspricht einer durchschnittlichen Entschädigung von 210.173 Dollar pro Fall.[61]
22 Jahre nach der ursprünglichen Infektion wurden 155 Frauen nachuntersucht. Die häufigsten berichteten Symptome waren Müdigkeit und Gelenkschmerzen; 77 Prozent der Frauen zeigten außerdem klinisch bedeutsame Angstsymptome. Nur bei 87 Frauen ließ sich die Hepatitis-C-Infektion noch mit PCR nachweisen, die anderen schienen das Virus spontan eliminiert zu haben; allerdings zeigte knapp die Hälfte von diesen noch Antikörper. Auffälligerweise war ausgerechnet in dieser Gruppe jede fünfte Frau an Hepatitis erkrankt. Eine Leberbiopsie wurde auch bei 27 (40 %) der PCR-negativen Patientinnen durchgeführt, hierdurch wurden minimale entzündliche Veränderungen wie geringgradige Entzündung und minimale Fibrosierung festgestellt. Vier (14,8 %) Personen zeigten einen normalen Leberhistologiebefund, 20 (74 %) Personen hatten eine leichte Entzündung und drei (11,1 %) Personen eine mittelschwere bis schwere Lebererkrankung. Frauen mit nachweisbaren Viren litten nur zu 3,4 Prozent an einer Hepatitis. Die Viruslast scheint also nicht die Stärke der klinischen Symptome wiederzugeben. In keinem einzigen Fall konnten eine Zirrhose oder ein Leberzellkarzinom nachgewiesen werden. Insgesamt zeigte diese Studie, dass in einem überraschend hohen Anteil der Frauen ihr Körper die Viren eliminiert hatte und dass die Krankheit nicht dazu neigt, im Laufe der Jahre schlimmer zu werden. Trotz des hier gesehenen günstigen Krankheitsverlaufs bestanden starke psychologische Stresssymptome und eine schlechte Lebensqualität.[62]
Übertragung durch Blutgerinnungsmittel
In Japan haben seit dem Oktober 2002 etwa 240 Personen den Staat wegen Infektion mit Hepatitis-C-Viren durch Blutgerinnungsmittel, speziell Fibrinogen, verklagt. Die meisten Erkrankten hatten die Blutprodukte während einer Entbindung übertragen bekommen. Im Januar 2008 beendete die Regierung die Gerichtsverfahren mit einem Vergleich: Auf dieser Grundlage erließ das japanische Parlament am 15. Januar ein Gesetz, das den Opfern Entschädigungen zwischen 12 und 40 Millionen Yen (etwa 75.000 bis 250.000 Euro) zusprach.[63] Als anspruchsberechtigt wurden zunächst etwa 1000 Menschen bezeichnet. Premierminister Yasuo Fukuda entschuldigte sich bei den Betroffenen und übernahm im Namen des Staates die Verantwortung. Der Entschädigungsfonds wird mit 20 Milliarden Yen ausgestattet, in ihn sollen auch die Hersteller der kontaminierten Blutprodukte einzahlen.[64] Am 15. Februar 2008 enthüllte das Gesundheitsministerium, dass die tatsächliche Zahl der infizierten Personen sich vermutlich auf 8.896 beläuft. Bisher seien erst rund 40 Prozent der Betroffenen informiert worden. Als Hersteller der kontaminierten Blutprodukte werden drei Firmen, die Mitsubishi Tanabe Pharma Corp. sowie ihre Tochterunternehmen Benesis Corp. und Nihon Pharmaceutical Co. genannt. Bei Mitsubishi Tanabe handelt es sich um den Nachfolger der Green Cross Corp. die das Fibrinogen ursprünglich herstellte. Green Cross war in Japan bekannt geworden, weil zahlreiche Menschen Aids entwickelten, nachdem es mit HIV kontaminierte Blutprodukte verkauft hatte.[65]
Das höchste Risiko der Infektion mit Hepatitis C bestand bei Empfängern von Blutprodukten, die aus mehreren Tausend Einzelspenden gewonnen wurden, so z. B. Hämophile (Bluter). Die Aufklärung der genauen Umstände des sogenannten „Bluterskandals“,[66] in der primär die Infektion durch mit HIV kontaminierte Blutprodukte thematisiert wurde, dauert bis heute an.[67][68]
Übertragung durch verseuchte Spritzen
Nach einer Studie der Universität Valencia hat der Anästhesist Juan Maeso Vélez zwischen 1994 und 1998 in zwei Krankenhäusern von Valencia mindestens 171 Patienten mit Hepatitis C infiziert. Die Studie, mit der es gelang, Maeso als einzige Quelle dingfest zu machen, wurde im Rahmen eines Gerichtsverfahrens im Jahr 2000 angefertigt.[69]
In einer Klinik in Las Vegas haben sich nach Presseberichten mehrere Menschen durch unsaubere Spritzen mit Hepatitis-Viren bzw. dem HIV infiziert. Seit März 2004 sollen die Mitarbeiter im „Endoscopy Center of Southern Nevada“ Einweg-Spritzen und Einweg-Injektionsfläschchen gemäß Anweisung des Klinikdirektors mehrfach verwendet haben, so dass auf diesem Weg die Viren übertragen werden konnten. Der Skandal kam ans Licht, als im Februar 2008 sechs Hepatitis-C-Erkrankungen an den zuständigen Bezirk gemeldet wurden.[70]
Kostenaspekte
Eine zwölfwöchige Therapie mit den wirksamsten Tabletten Sofosbuvir kostet in Deutschland ab 23. Januar 2015 rund 43.562,52 Euro[71]. Mittlerweile sind die Kosten für die Behandlung auf 29.989,95 Euro gesunken, was einen Preis von 357,02 Euro pro Tablette ergäbe (Stand April 2020)[72]. Der Hersteller Gilead berichtete im ersten Halbjahr 2014 einen weltweiten Sofosbuvir-Umsatz von 5,7 Milliarden $. In Ägypten, wo bis zu 22 % der Bevölkerung mit HCV infiziert sind, vereinbarte mit Gilead, 150.000 Patienten im kritischen Stadium Sofosbuvir für 300 $ zu verabreichen – statt für 84.000 $, die sie nie zahlen könnten.[73] Die hohen Kosten der neuesten Medikamentengeneration werden kontrovers diskutiert und führen zu Einschränkungen seitens der Versicherungen bei der Kostenübernahme.[74] Die Kosten der bisherigen Therapiemöglichkeiten, z. B. mit Interferon + Ribavirin + Telaprevir betragen je nach Dauer der antiviralen Therapie zwischen 7800 Euro und 35 000 Euro pro Patient.[75]
Meldepflicht
In Deutschland ist jede akute Virushepatitis (also auch akute Hepatitis C) gemäß § 6 Infektionsschutzgesetz (IfSG) namentlich meldepflichtig. Dies betrifft den Verdacht einer Erkrankung, die Erkrankung sowie den Tod an dieser Infektionskrankheit. Zudem ist auch jeder Nachweis des Hepatitis-C-Virus nach § 7 IfSG namentlich meldepflichtig.
In Österreich sind nach § 1 Abs. 1 Epidemiegesetz 1950 Verdachts-, Erkrankungs- und Todesfälle an infektiöser Hepatitis (Hepatitis A, B, C, D, E), also auch Hepatitis C, anzeigepflichtig.
Auch in der Schweiz unterliegt Hepatitis C der Meldepflicht und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldekriterien für diese Meldung durch Ärzte, Spitäler usw. sind ein positiver laboranalytischer Befund und die Aufforderung durch die Kantonsärztin oder den Kantonsarzt, den Fall zu melden. Ein positiver laboranalytischer Befund für das Hepatitis-C-Virus ist von Laboratorien nach Anhang 3 der oben genannten Verordnung des EDI zu melden.
Literatur
- H. Wedemeyer, M. Cornberg, M. P. Manns: PEG-Interferone: Bedeutung für die Therapie der Virushepatitis B und C. In: Dtsch Med Wochenschr. 2001 Jun 1;126 Suppl 1, S. S68–S75, PMID 11450618
- E. Herrmann, C. Sarrazin: Hepatitis-C-Virus – Viruskinetik und Resistenzmechanismen. In: Z Gastroenterol. 1998; 36, S. 997–1008, PMID 15136939
- J. Hadem, H. Wedemeyer, M. P. Manns: Hepatitis als Reisekrankheit. In: Internist. 2004; 45, S. 655–668, PMID 15118829
- Gert Frösner: Moderne Hepatitisdiagnostik. ISBN 3-932091-50-7.
- Stefan Zeuzem: Hepatitis C im Dialog – 100 Fragen – 100 Antworten. ISBN 3-13-133391-X.
- Das Deutsche Hepatitis-C Handbuch. Herausgeber: Deutsches Hepatitis C Forum e. V., ISBN 3-00-004025-0.
- W. P. Hofmann: Behandlung von Patienten mit chronischer Hepatitis C: Aktueller HCV-Therapiestandard. In: Dtsch Arztebl Int. Nr. 109(19), 2012, S. 352–358 (Übersichtsarbeit).
- Gerhard Scheu: Deliktische Produktverantwortung für Hepatitis C-Infektionen hämophiler Patienten. Nomos, Baden-Baden 1999, ISBN 3-7890-6385-1 (Der Autor war der Vorsitzende des Untersuchungsausschusses des 12. Deutschen Bundestages zu diesem Thema.)
- Hartwig Klinker: Infektionen durch Viren. In: Marianne Abele-Horn (Hrsg.): Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 297–307, hier: S. 299–301.
Weblinks
- Hepatitis C – Informationen des Robert Koch-Instituts
- Kompetenznetz Hepatitis
- Laborlexikon: Hepatitis C
- National Hepatitis C Program U.S. Department of Veterans Affairs (in englischer Sprache)
- S3-Leitlinie: Diagnostik und Therapie der Hepatitis-C-Virus (HCV) Infektion, AWMF-Registernummer 021/012, Volltext (PDF; 1,1 MB) Stand 2018
- S3-Leitlinie Prophylaxe, Diagnostik und Therapie der Hepatitis-C-Virus(HCV)-Infektion, AWMF-Register-Nr.:021/012
Einzelnachweise
- DHC-R-final-2018. Abgerufen am 4. Dezember 2020.
- Meldung Nobelpreis für Medizin 2020, Süddeutsche Zeitung, 5. Okt. 2020
- Q. L. Choo, G. Kuo u. a.: Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. In: Science. Band 244, Nummer 4902, April 1989, S. 359–362, PMID 2523562.
- Donald B. Smith, Jens Bukh, Carla Kuiken, A. Scott Muerhoff, Charles M. Rice: Expanded classification of hepatitis C virus into 7 genotypes and 67 subtypes: updated criteria and genotype assignment web resource. In: Hepatology. Band 59, Nr. 1, 2014, ISSN 1527-3350, S. 318–327, doi:10.1002/hep.26744, PMID 24115039, PMC 4063340 (freier Volltext).
- Jan Felix Drexler, Victor Max Corman, Marcel Alexander Müller u. a.: Evidence for Novel Hepaciviruses in Rodents. In: PLoS Pathogens. 9, Nr. 6, 2013 doi:10.1371/journal.ppat.1003438
- S. Fujioka, H. Shimomura u. a.: Prevalence of hepatitis B and C virus markers in outpatients of Mongolian general hospitals. In: Kansensh?gaku zasshi. The Journal of the Japanese Association for Infectious Diseases. Band 72, Nummer 1, Januar 1998, S. 5–11, PMID 9503777.
- Robert Koch-Institut: Epidemiologisches Bulletin. 13/2006.
- Robert Koch-Institut: Epidemiologisches Bulletin. 46/2005.
- G. Seger: Drogen und Hepatitis C: Neue Konzepte der Prävention gesucht. In: Dtsch Arztebl. Band 101, Nummer 27, 2004.
- G. L. Armstrong, A. Wasley u. a.: The prevalence of hepatitis C virus infection in the United States, 1999 through 2002. In: Annals of Internal Medicine. Band 144, Nummer 10, Mai 2006, S. 705–714, PMID 16702586.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 119 kB) 18. Januar 2002.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 113 kB) 17. Januar 2003.
- Epidemiologisches Bulletin Nr. 2 des RKI (PDF; 172 kB) 16. Januar 2004.
- Epidemiologisches Bulletin Nr. 2 des RKI (PDF) 14. Januar 2005.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 139 kB) 20. Januar 2006.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 111 kB) 19. Januar 2007.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 107 kB) 18. Januar 2008.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 124 kB) 19. Januar 2009.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 116 kB) 25. Januar 2010.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 113 kB) 24. Januar 2011.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 121 kB) 23. Januar 2012.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 117 kB) 21. Januar 2013.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 116 kB) 20. Januar 2014.
- Bulletin Nr. 3 des RKI (PDF) 14. Januar 2015.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 195 kB) 20. Januar 2016.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 128 kB) 18. Januar 2017.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 238 kB) 17. Januar 2018.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 238 kB) 17. Januar 2018.
- Epidemiologisches Bulletin Nr. 3 des RKI (PDF; 2,5 MB) 16. Januar 2020
- Centers for Disease Control and Prevention: Hepatitis C FAQs for Health Professionals
- Leitlinie (Memento vom 12. Januar 2012 im Internet Archive) (PDF; 1 MB)
- Hartwig Klinker: Hepatitis C. In: Marianne Abele-Horn (Hrsg.): Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 299–301, hier: S. 299 (In Studien wie HepNet).
- dgvs.de (PDF)
- Ira M. Jacobson, Stuart C. Gordon, Kris V. Kowdley, Eric M. Yoshida, Maribel Rodriguez-Torres, Mark S. Sulkowski, Mitchell L. Shiffman, Eric Lawitz, Gregory Everson, Michael Bennett, Eugene Schiff, M. Tarek Al-Assi, G. Mani Subramanian, D. i. An, Ming Lin, John McNally, Diana Brainard, William T. Symonds, John G. McHutchison, Keyur Patel, Jordan Feld, Stephen Pianko, David R. Nelson: Sofosbuvir for Hepatitis C Genotype 2 or 3 in Patients without Treatment Options. In: New England Journal of Medicine. 2013, S. 130423030016000, doi:10.1056/NEJMoa1214854.
- Eric Lawitz, Alessandra Mangia, David Wyles, Maribel Rodriguez-Torres, Tarek Hassanein, Stuart C. Gordon, Michael Schultz, Mitchell N. Davis, Zeid Kayali, K. Rajender Reddy, Ira M. Jacobson, Kris V. Kowdley, Lisa Nyberg, G. Mani Subramanian, Robert H. Hyland, Sarah Arterburn, Deyuan Jiang, John McNally, Diana Brainard, William T. Symonds, John G. McHutchison, Aasim M. Sheikh, Zobair Younossi, Edward J. Gane: Sofosbuvir for Previously Untreated Chronic Hepatitis C Infection. In: New England Journal of Medicine. 2013, S. 130423030016000, doi:10.1056/NEJMoa1214853.
- C. Neumann-Haefelin, H.E. Blum, R. Thimme: Direkt antivirale Therapieansätze bei der chronischen Hepatitis C In: Dtsch med Wochenschr. 2012; 137(25/26), S. 1360–1365. doi:10.1055/s-0032-1305064.
- Christoph Sarrazin, Thomas Berg, Peter Buggisch, Matthias Dollinger, Holger Hinrichsen, Dietrich Hüppe, Michael Manns, Stefan Mauss, Jörg Petersen, Karl-Georg Simon, Heiner Wedemeyer, Stefan Zeuzem: Aktuelle Empfehlung der DGVS und des bng zur Therapie der chronischen Hepatitis C (Memento des Originals vom 2. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., DGVS-Leitlinie; zuletzt abgerufen am 8. März 2015.
- Europäische Kommission erteilt Zulassung für Harvoni. Abgerufen am 21. März 2015.
- TECHNIVIE™ (ombitasvir, paritaprevir and ritonavir) Tablets, for Oral Use. Full Prescribing Information. AbbVie Inc., North Chicago, IL 60064. Abgerufen am 28. Juli 2015.
- Katja Deterding, Norbert Grüner, Peter Buggisch, Johannes Wiegand, Peter R. Galle, Ulrich Spengler, Holger Hinrichsen, Thomas Berg, Andrej Potthoff, Nisar Malek, Anika Großhennig, Armin Koch, Helmut Diepolder, Stefan Lüth, Sandra Feyerabend, Maria Christina Jung, Magdalena Rogalska-Taranta, Verena Schlaphoff, Markus Cornberg, Michael P. Manns, Heiner Wedemeyer: Delayed versus immediate treatment for patients with acute hepatitis C: a randomised controlled non-inferiority trial. In: The Lancet Infectious Diseases. 13, 2013, S. 497–506, doi:10.1016/S1473-3099(13)70059-8.
- FDA approves Telaprevir, 13. Mai 2011, Bericht auf Medscape.com, aufgerufen am 26. Februar 2019
- Victrelis (Boceprevir) Approval history auf drug.com, aufgerufen am 26. Februar 2019
- Hartwig Klinker: Infektionen durch Hepatitisviren. In: Marianne Abele-Horn (Hrsg.): Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 299–301, hier: S. 300 f.
- Arzneimittelinformationen der European Medicines Agency zu Telaprevir
- Arzneimittelinformationen zu Boceprevir der European Medicines Agency
- New HCV Drugs at AASLD. Natap.org
- Anna S. Lok u. a.: Preliminary Study of Two Antiviral Agents for Hepatitis C Genotype 1. In: N Engl J Med, 2012, 366, S. 216–224.
- J. Guedja, H. Daharia, L. Rong, N. D. Sansonee, R. E. Nettlesh, S. J. Cotlere, T. J. Laydene, S. L. Uprichardd, A. S. Perelson: Modeling shows that the NS5A inhibitor daclatasvir has two modes of action and yields a shorter estimate of the hepatitis C virus half-life. doi:10.1073/pnas.1203110110
- Are we ready for IFN-free treatment regimens? Natap.org
- Conference Reports for NATAP, abgerufen am 26. März 2014.
- Hartwig Klinker (2009), S. 300.
- Hepatitis C: Rückschlag für GS-7977 bei Nullrespondern mit dem Genotyp 1. (Memento vom 1. März 2012 im Internet Archive) Deutsche Leberhilfe e. V.
- Ellen Reifferscheid: Neueinführung Epclusa. In: Gelbe Liste. Medizinische Medien Informations GmbH, 4. August 2016, abgerufen am 21. Juli 2017.
- Jordan J. Feld, Ira M. Jacobson, Christophe Hézode, Tarik Asselah, Peter J. Ruane, Norbert Gruener, Armand Abergel, Alessandra Mangia, Ching-Lung Lai, Henry L.Y. Chan, Francesco Mazzotta, Christophe Moreno, Eric Yoshida, Stephen D. Shafran, William J. Towner: Sofosbuvir and Velpatasvir for HCV Genotype 1, 2, 4, 5, and 6 Infection. In: New England Journal of Medicine. 16. November 2015, S. 151117120417004. doi:10.1056/NEJMoa1512610.
- G. T. Strickland: Liver disease in Egypt: hepatitis C superseded schistosomiasis as a result of iatrogenic and biological factors. In: Hepatology. Band 43, Nr. 5, 2006, S. 915–922.
- C. Frank u. a.: The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. In: The Lancet. Band 355, Nr. 9207, 2000, S. 887–891.
- Entschädigung für Hepatitis-C-Infizierte. In: Deutsches Ärzteblatt. Band 94, Nr. 9, 1997, S. A-500 / B-422 / C-398. (aerzteblatt.de)
- Große Anfrage der Abgeordneten Horst Schmidbauer u. a. zur Infektion durch Hepatitis C-kontaminiertes Plasma 1978/1979 in der DDR dipbt.bundestag.de Deutscher Bundestag, Drucksache 13/1649 vom 7. Juni 1995.
- Deutscher Bundestag, (PDF) Drucksache 15/2792 (PDF; 240 kB)
- Aids-Skandal: Bluter verlangen Entschädigung. In: Hamburger Abendblatt. 17. August 1999, abgerufen am 1. April 2019.
- Elizabeth Kenny-Walsh: Clinical Outcomes after Hepatitis C Infection from Contaminated Anti-D Immune Globulin. In: The New England Journal of Medicine. Band 340, Nr. 16, 1999, S. 1228–1233.
- S. Barrett u. a.: The natural course of hepatitis C virus infection after 22 years in a unique homogenous cohort: spontaneous viral clearance and chronic HCV infection. In: Gut. Band 49, 2001, S. 423–430.
- Hepatitis C victims settle lawsuits filed against state. In: The Japan Times. 5. Februar 2008. (search.japantimes.co.jp)
- Hepatitis C bill offering aid, apology clears Diet. In: The Japan Times. 12. Januar 2008. (search.japantimes.co.jp)
- Report increases hepatitis C exposure cases to 8,896. In: The Japan Times. 16. Februar 2008. (search.japantimes.co.jp)
- Bluterskandal: Wunder von Bonn. In: Der Spiegel. Nr. 41, 1994 (online).
- Antrag Entschädigungsregelung für durch Blutprodukte mit HCV infizierte Bluter schaffen. Deutscher Bundestag, 21. Januar 2009; dip21.bundestag.de (PDF)
- Udo Ludwig: Tod auf Rezept. In: Der Spiegel. Nr. 32, 2009 (online).
- El ADN revela que el anestesista Maeso contagió la hepatitis C a 171 pacientes. In: El País. 24. Februar 2000. (elpais.com)
- Klinikpersonal benutzte verseuchte Spritzen an 40.000 Patienten – auf Anweisung. In: Spiegel Online, 29. Februar 2008.
- Sovaldi-Preis steht. 16. Februar 2015, abgerufen am 13. März 2021.
- Hepatitis&More: Preisübersicht. Abgerufen am 13. März 2021.
- Volker Stollorz: Gelbsucht heilen, kräftig löhnen. auf: faz.net, 28. Juli 2014.
- Rita Flubacher: Eine Packung Pillen für 19 000 Franken. In: Tages-Anzeiger, 7. August 2014, S. 1.
- Avoxa-Mediengruppe Deutscher Apotheker GmbH: Innovative Arzneimittel bei Hepatitis C: Was kostet der Zusatznutzen? Abgerufen am 13. März 2021.