Rötelnvirus
Das Rötelnvirus (wissenschaftlich Rubella virus) ist der Erreger von Röteln und ist bei Infektion in den ersten Schwangerschafts-Wochen der Verursacher der Rötelnembryofetopathie. Der Mensch ist der einzige bekannte Wirt des mittels Tröpfcheninfektion übertragbaren Virus.[3]
| Rötelnvirus | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
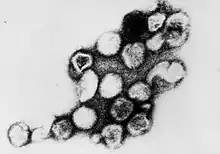
Rötelnviren (TEM-Aufnahme) | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Rubella virus | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| RUBV, RuV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Die molekulare Grundlage für die Verursachung der Rötelnembryopathie ist noch nicht vollständig geklärt, aber In-vitro-Studien mit Zelllinien zeigten, dass das Rubella-Virus einen apoptotischen Einfluss auf einzelne Zelltypen hat. Es gibt Hinweise auf einen von p53 abhängigen Mechanismus.[4]
Aufbau und Eigenschaften
Das Rötelnvirus ist das einzige Mitglied der Gattung Rubivirus und gehört zur Familie der Matonaviridae[1] (früher zu Togaviridae), deren Mitglieder typischerweise eine einzelsträngige RNA mit positiver Polarität als Genom besitzen, das von einem ikosaedrischen, 30 bis 40 nm großem Kapsid umgeben ist.[5]
Das RNA-Genom im Inneren des Kapsids hat eine Länge von 9.757 Nukleotiden und codiert für zwei nichtstrukturelle Proteine sowie drei strukturelle Proteine.[6] Das Kapsidprotein sowie die beiden Glycoproteine E1 und E2 machen die drei strukturellen Proteine aus.
Die kugelförmigen Viruspartikel haben einen Durchmesser von 50 bis 70 nm und sind von einer Lipidmembran (Virushülle) umgeben.[5] Größtenteils formen E1 und E2 Hetereodimere, die in der Hülle eingelagert sind. Dort bilden drei jener E1-E2-Dimere ein Trimer, die deutlich als Spikes (Ausstülpungen) von 5 bis 8 nm Höhe sichtbar sind.[7]
E1 ist das immundominante Oberflächenmolekül des Virus, es besitzt Epitope für hämagglutinationshemmende und neutralisierende Antikörper.[5] Es ist für die Infektion des Virus verantwortlich.[8] Die Strukturproteine können eine humorale Immunantwort verursachen. Trotz struktureller Verwandtschaft zu den von Arthropoden übertragenen Alphaviren der Familie der Togaviren sind keine Kreuzreaktionen zu diesen Viren nachgewiesen.[8]
Beim Rötelnvirus ist nur ein einziger Serotyp bekannt, es ist antigenetisch stabil.[5] Phylogenetisch sind 12 Genotypen anerkannt: 1a (provisorisch), 1B, 1C, 1D, 1E, 1F, 1G, 1H, 1I, 1J (Clade 1) sowie 2A, 2B und 2C (Clade 2).[5][8][9] Größtenteils zirkulieren die Genotypen 1E, 1G, 1J und 2B während 1D, 1F, 1I, und 2A vermutlich ausgestorben sind.[9]
Replikation
Die Vermehrung von Rötelnviren entspricht deren von Alphaviren, ist aber im Vergleich dazu erhablich langsamer.[5] Daher wird erst 36 bis 48 Stunden nach Infektion das Produktionsmaxium erreicht.
Rötelnviren heften sich über spezifische Rezeptoren an der Zelloberfläche an und werden durch ein sich ausbildendes Endosomvesikel aufgenommen. Bei neutralem pH-Wert außerhalb der Zelle bedeckt das E2-Hüllprotein das E1-Protein. Im Innern des Endosoms werden nun bei saurem pH die äußeren Domänen des E1-Proteins freigelegt und die Fusion von Endosommembran und Virushülle wird induziert. Somit gelangt das Kapsid in das Zytosol, zerfällt und gibt das Genom frei.
Die (+)ssRNA (positiv-einzelsträngige-RNA) dient zunächst nur der Translation der Nicht-Strukturproteine, die als großes Polyprotein synthetisiert und danach in einzelne Proteine zerschnitten werden. Die Sequenzen für die Strukturproteine werden erst über eine komplementäre (-)ssRNA als Matrize durch die virale RNA-Polymerase (Replikase) vervielfältigt und als eigene kurze mRNA translatiert. Diese kurze (subgenomische) mRNA wird zusätzlich in das Virion verpackt.[10]
Bei der Translation der Strukturproteine entsteht ebenfalls ein langes Polypeptid (110 kDa), das in drei Stücke geschnitten werden muss. Dabei wird das Polyprotein endoproteolytisch in die Proteine E1, E2 und Kapsidprotein zerteilt. Bei E1 und E2 handelt es sich um Typ I Transmembranproteine deren Translokation in das endoplasmatische Retikulum (ER) mit Hilfe einer N-terminalen Signalsequenz geschieht. Vom ER gelangt der als Heterodimer vorliegenden E1·E2-Komplex in den Golgi-Apparat, wo die Knospung (Budding) neuer Virionen stattfindet (im Gegensatz zu den Alphaviren, deren Knospung an der Plasmamembran stattfindet). Die Kapsidproteine hingegen bleiben im Cytoplasma und lagern sich an die genomische RNA an, mit der sie schließlich das Kapsid bilden.[11]
Kapsidprotein
Das Kapsidprotein (auch Protein C) hat verschiedene Funktionen. Die Hauptfunktionen sind die Bildung von Homooligomeren um das Kapsid zu formen, und die Bindung der genomischen RNA. Weiterhin ist es verantwortlich für die Aggregation der RNA im Kapsid, es interagiert mit den Membranproteinen E1 und E2 und bindet das menschliche Wirtsprotein p32, wobei diese Interaktion wichtig ist für die Vermehrung des Virus im Wirt.[12]
Im Gegensatz zu Alphaviren macht das Kapsid keiner Autoprotolyse, sondern wird von der Signal-Peptidase vom Rest des Polyproteins abgetrennt. Die Herstellung des Kapsides erfolgt an Oberfläche der intrazellulären Membranen zeitgleich mit der Knospung des Virus.[13]
Herkunft
Die Herkunft des Rötelnvirus ist unbekannt. Im Jahr 2020 wurden jedoch von Andrew J. Bennet und Kollegen erstmals zwei eng mit dem Rötelnvirus verwandte Viren bei mehreren Tierarten nachgewiesen.[14] In einer Erläuterung des Friedrich-Loeffler-Instituts (FLI) hieß es: „Beide Viren zeigen große strukturelle Ähnlichkeiten mit dem Rötelnvirus und weisen drauf hin, dass dessen Ursprung im Tierreich zu suchen ist.“[15] Bei drei verendeten Zootieren und in Gelbhalsmäusen war in Deutschland vom Friedrich-Loeffler-Institut ein bis dahin unbekannter, nach dem Fundort am Strelasund (Mecklenburg-Vorpommern) als „Rustrela-Virus“ bezeichneter Erreger nachgewiesen worden. Auslöser war der Tod eines Esels, eines Baumkängurus und eines Wasserschweins, die nach Anzeichen einer Enzephalitis verstorben waren. Danach wurde das Virus auch bei den örtlich freilebenden Mäusen nachgewiesen, die vermutlich ein Reservoir für das Virus darstellen, aber selber nicht erkranken.[16] Unabhängig von diesen Untersuchungen hatte ein US-amerikanisches Team in Uganda einen bis dahin unbekannten, nach dem Fundort im Kibale-Nationalpark als „Ruhugu-Virus“ bezeichneten Erreger bei Zyklopen-Rundblattnasen (Hipposideros cyclops) – einer Fledermaus aus der Gattung der Altwelt-Rundblattnasen – entdeckt.[17] Möglicherweise sprang also auch der Vorfahr des Rötelnvirus vom Tier auf den Menschen über. Die Röteln wären damit ebenfalls eine Zoonose.[18][19]
Systematik
Offiziell bestätigt vom International Committee on Taxonomy of Viruses (Master Species List #35 März 2020) innerhalb der Familie Matonaviridae ist nur die Gattung Rubivirus mit der Spezies Rubella virus. Weitere vorgeschlagene Spezies in dieser Gattung sind nach NCBI (Stand Oktober 2020):[20]
- „Guangdong chinese water snake rubivirus“ (Kantonesisches Wasserschlangen-Virus)
- „Ruhugu virus“ (RuhV)[14][17]
- „Rustrela virus“ (RusV)[14]
Die Verwandtschaftsbeziehungen sind nach Bennet et al. wie folgt:[14]
| Rubivirus |
| ||||||||||||
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis des Rubellavirus namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Die Meldepflicht betrifft in erster Linie die Leitungen von Laboren (§ 8 IfSG).
In der Schweiz ist der positive laboranalytische Befund zu einem Rötelnvirus für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Literatur
- David M. Knipe, Peter M. Howley (Hrsg.): Fields’ virology. Wolters Kluwer/Lippincott Williams & Wilkins Health, Philadelphia 2013, ISBN 978-1-4511-0563-6 (englisch).
- C.M. Fauquet, M.A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London/San Diego 2005.
Weblinks
- Togaviridae. In: Human Virology at Standord. 8. März 1998 (englisch).
Einzelnachweise
- ICTV Master Species List 2018b.v1, MSL #34
- ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- Mitteilung der Ständigen Impfkommission beim RKI – Empfehlung und wissenschaftliche Begründung für die Angleichung der beruflich indizierten Masern-MumpsRöteln-(MMR-) und Varizellen-Impfung. In: Epidemiologisches Bulletin. Nr. 2/2020. Robert Koch-Institut (RKI), 9. Januar 2020, S. 3–22, hier S. 6 rechts oben (rki.de [PDF; 2,8 MB; abgerufen am 2. April 2020]).
- Megyeri K, Berencsi K, Halazonetis TD, et al: Involvement of a p53-dependent pathway in rubella virus-induced apoptosis. In: Virology. 259, Nr. 1, Juni 1999, S. 74–84. doi:10.1006/viro.1999.9757. PMID 10364491.
- Gisela Enders: Rötelnvirus (Rubellavirus). In: Birgid Neumeister et al. (Hrsg.): Mikrobiologische Diagnostik. 2. Auflage. Georg Thieme Verlag, 2009, ISBN 978-3-13-743602-7, S. 862 ff., doi:10.1055/b-0034-69343.
- G. Dominguez, C. Y. Wang, T. K. Frey: Sequence of the genome RNA of rubella virus: evidence for genetic rearrangement during togavirus evolution. In: Virology. Band 177, Nr. 1, Juli 1990, S. 225–238, doi:10.1016/0042-6822(90)90476-8, PMID 2353453, PMC 7131718 (freier Volltext).
- Bardeletti G, Kessler N, Aymard-Henry M: Morphology, biochemical analysis and neuraminidase activity of rubella virus. In: Arch. Virol.. 49, Nr. 2–3, 1975, S. 175–86. PMID 1212096.
- RKI-Ratgeber - Röteln. In: RKI. 20. Mai 2020, abgerufen am 25. April 2021.
- Rubella virus nomenclature update: 2013. In: WHO (Hrsg.): Weekly Epidemiological Record. Band 88, Nr. 32, 9. August 2013, S. 337–348 (who.int [PDF]).
- Togaviridae- Classification and Taxonomy. Abgerufen am 6. Februar 2011.
- Garbutt M, Law LM, Chan H, Hobman TC: Role of rubella virus glycoprotein domains in assembly of virus-like particles. In: J. Virol.. 73, Nr. 5, Mai 1999, S. 3524–33. PMID 10196241. PMC 104124 (freier Volltext).
- Beatch MD, Everitt JC, Law LJ, Hobman TC: Interactions between rubella virus capsid and host protein p32 are important for virus replication. In: J. Virol.. 79, Nr. 16, August 2005, S. 10807–20. doi:10.1128/JVI.79.16.10807-10820.2005. PMID 16051872. PMC 1182682 (freier Volltext).
- Beatch MD, Hobman TC: Rubella virus capsid associates with host cell protein p32 and localizes to mitochondria. In: J. Virol.. 74, Nr. 12, Juni 2000, S. 5569–76. PMID 10823864. PMC 112044 (freier Volltext).
- Andrew J. Bennett, Adrian C. Paskey, Arnt Ebinger, Florian Pfaff, Grit Priemer, Dirk Höper, Angele Breithaupt, Elisa Heuser, Rainer G. Ulrich, Jens H. Kuhn, Kimberly A. Bishop-Lilly, Martin Beer, Tony L. Goldberg: Relatives of rubella virus in diverse mammals. In: Nature. Online-Vorabveröffentlichung vom 7. Oktober 2020, doi:10.1038/s41586-020-2812-9.
- Stammt das Rötelnvirus aus dem Tierreich? Auf: idw-online.de vom 7. Oktober 2020.
- Newly discovered viruses suggest ‘German measles’ jumped from animals to humans. Auf: sciencemag.org vom 7. Oktober 2020.
- First relatives of rubella virus discovered in bats in Uganda and mice in Germany. Auf: eurekalert.org vom 7. Oktober 2020.
- Daniel Lingenhöhl: Zoonosen: Sprangen auch die Röteln von Tieren auf uns über?, auf: spektrum.de vom 9. Oktober 2020, Quelle: Friedrich-Loeffler-Institut (FLI)
- Eine kleine Maus mit viraler Fracht, auf wissenschaft.de vom 8. Oktober 2020
- NCBI: Rubivirus (genus)