Hepatitis E
Die Hepatitis E ist eine virale, infektiöse Hepatitis beim Menschen, die durch das Hepatitis-E-Virus (HEV) verursacht wird. Besonders bei Überschwemmungen in Südostasien während der Monsunzeit kann sich Hepatitis E zu einer Epidemie entwickeln, da sie durch Wasser übertragen wird und auch im Zusammenhang mit Tieren als Reservoir des Erregers steht. In Europa ist unzureichend gegartes Schweinefleisch der hauptsächliche Infektionsweg für den Menschen.[1][2] Ein Impfstoff ist in der Volksrepublik China seit April 2012 zugelassen.
| Klassifikation nach ICD-10 | |
|---|---|
| B17.2 | Akute Virushepatitis E |
| ICD-10 online (WHO-Version 2019) | |
Erreger und Epidemiologie
| Hepatitis-E-Virus | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
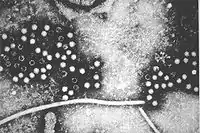
Virionen des Hepatitis-E-Virus im TEM | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Orthohepevirus A | ||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||
| HEV | ||||||||||||||||
| Links | ||||||||||||||||
|
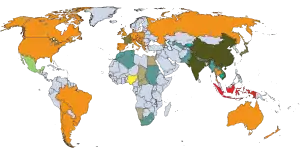
Genotyp 2
Genotyp 3
Genotyp 4
Genotypen 1 und 2
Genotypen 1 und 3
Genotypen 2 und 3
Genotypen 1 und 4
Genotypen 3 und 4
keine Daten
Der Erreger ist das Orthohepevirus A alias Hepatitis-E-Virus (HEV). Es handelt sich um ein unbehülltes Einzel(+)-Strang-RNA-Virus von 32–34 nm Größe. Früher der Familie Caliciviridae zugeordnet, wird es inzwischen in die Familie der Hepeviridae eingeteilt.[6] Mehrere humanpathogene Subtypen des HEV sind beschrieben worden. Die Erkrankung tritt meist in anikterischer Form auf und wurde erstmals 1980 in Indien entdeckt.
Die frühere Gattung Hepevirus wurde vom International Committee on Taxonomy of Viruses (ICTV) in Orthohepevirus[7] umbenannt und neu aufgeteilt. In der neuen Gattung Orthohepevirus sind neben der genannten Spezies mit 8 Genotypen (1a bis 8a) noch drei weitere Spezies, nämlich Orthohepevirus B (Aviäres Hepatitis-E-Virus, AHEV), Orthohepevirus C (befällt Ratten und Iltisse) und Orthohepevirus D (befällt Fledermäuse) zu finden. Nicht-Landwirbeltiere sind dagegen Wirte von mindestens einer weiteren Gattung aus der Familie Hepeviridae.
Nach der Einrichtung der Orthohepevirus-Spezies A bis D wurden auch die Genotypen neu benannt, die neuen Typen 1a bis 8a gehören zur Spezies Orthohepevirus A. Zuvor waren 5 Genotypen bekannt, verstreut über die Spezies, mit den humanpathogen Typen 1 bis 4 (zu Orthohepevirus A) und dem aviären (nur bei Vögeln vorkommenden) Typ 5 (zu Orthohepevirus B).[5] Die weltweite Verteilung der Genotypen ist unterschiedlich. In Europa wird überwiegend der Genotyp 3 gefunden. Für die verschiedenen HEV-Genotypen bestehen unterschiedliche Erregerreservoire. Die Genotypen 1 und 2 werden ganz überwiegend nur von Mensch zu Mensch übertragen. Typischerweise finden sich daher Infektionen mit diesen Genotypen in Ländern mit schlechter Trinkwasserhygiene. In Mitteleuropa diagnostizierte HEV-Genotyp 1/2-Fälle sind überwiegend aus südlichen Ländern importierte Infektionen.
Die HEV-Genotypen 3 und 4 konnten wiederholt bei Tieren nachgewiesen werden, insbesondere bei Hausschweinen und Wildschweinen sowie in Schweinefleisch.[5][8][9] Die Übertragung auf den Menschen auf diesem Weg ist die vermutete Hauptinfektionsquelle in den Industrienationen. Damit kann die HEV Genotyp 3/4-Infektion als Zoonose bezeichnet werden.
Das Robert Koch-Institut ermittelte für Deutschland eine HEV-Antikörper-Prävalenz von 16,8 %, d. h. 16,8 % der Untersuchten hatten Antikörper gegen das Virus, was auf einen früheren Kontakt hindeutet. Da die meisten HEV-Infektionen ohne wesentliche Symptome, d. h. klinisch inapparent, verlaufen, kann man aus diesen Zahlen auf etwa 320.000 HEV-Infektionen jährlich in Deutschland schließen.[10] Die in Frankreich, Deutschland und UK gemeldeten Fallzahlen haben sich in den letzten zehn Jahren verzehnfacht, mit insgesamt 21.000 Fällen in diesem Zeitraum.[2]
Zu den Risikogruppen, bei denen ein Hepatitis-E-Virus mit erhöhter Wahrscheinlichkeit eine Hepatitis-E-Erkrankung auslöst, zählen Menschen mit einer akuten oder chronischen Immunschwäche sowie durch mehrere Vorerkrankungen immungeschwächte Menschen. Menschen, die zu diesen Risikogruppen gehören, rät das Bundesinstitut für Risikobewertung (BfR) von dem Konsum roher, kurzgereifter und luftgetrockneter Haus- und Wildschweinerzeugnisse wie Mett, frischer Mettwurst sowie nicht mindestens auf 70 °C erhitzten Haus- und Wildschweinfleisches ab. Bei Temperaturen über 70 °C werden die Viren in aller Regel inaktiviert bzw. zerstört.[11]
In Schweinelebern und insbesondere Schweinefleischerzeugnissen wie Leberwurst wurden 2019/2020 in signifikant vielen Stichproben aus Süd- und Westdeutschland, Belgien, den Niederlanden und Österreich relevante Mengen von Hepatitis-E-Virus-RNA nachgewiesen. Die Originalautoren der entsprechenden Studie der Universität Tübingen gehen davon aus, dass seit ca. 2009 die Hepatitis-E-Prävalenz „relativ unverändert und sehr hoch ist“.[12]
Bisher konnte in dem in Deutschland vertriebenen Rindfleisch keine verbreitete Belastung mit Hepatitis-E-Viren festgestellt werden.
Eine weitere Infektionsquelle stellen Bluttransfusionen dar, da Spenderblut mangels eines kostengünstigen Testverfahrens in der Regel nicht auf Hepatitis-E-Viren getestet wird. So sind beispielsweise bei Herztransplantierten, die häufig während der OP so viel Blut verlieren, dass Bluttransfusionen notwendig werden, häufiger unmittelbar nach dem Eingriff mehr Hepatitis-E-Viren im Blut nachweisbar als bei anderen Transplantationspatienten. Doch auch hier sind in der Regel nur Mitglieder der oben genannten Risikogruppen gefährdet.
Eine großangelegte, auf China beschränkte Studie wies zudem die Belastung des Trinkwassers mit Hepatitis E nach. In Deutschland werden regelmäßig Proben aus Trinkwasserreservoirs auf Hepatitis-E-Viren untersucht, um einer Ausbreitung über das Trinkwasser vorzubeugen.[13][14] In Europa stellt das Trinkwasser keinen Übertragungsweg dar.[2]
Vorkommen
Die Hepatitis E ist die zweithäufigste Hepatitis in Nordafrika und Vorderasien, speziell im Sudan und Irak. Die Zahl der Hepatitis-E-Fälle stieg in den letzten Jahren an. 2007 und 2008 waren die Mehrzahl der Neuerkrankungen in Deutschland durch in Deutschland heimische Virusstämme verursacht.[15] Laut neueren Erkenntnissen des RKI ist das Hepatitis-E-Virus jedoch bereits seit langem auch in Mitteleuropa heimisch und wird vor allem über kontaminiertes Schweine- und Wildfleisch übertragen.[16] Die beim RKI für Deutschland gemeldeten Fallzahlen haben sich seit dem Jahr 2005 folgendermaßen entwickelt:
| Jahr | gemeldete Fallzahlen |
|---|---|
| 2005 | 54[17] |
| 2006 | 51[18] |
| 2007 | 73[19] |
| 2008 | 104[20] |
| 2009 | 108[21] |
| 2010 | 221[22] |
| 2011 | 238[23] |
| 2012 | 338[24] |
| 2013 | 442[24] |
| 2014 | 661[25] |
| 2015 | 1264[26] |
| 2016 | 1983[27] |
| 2017 | 2951[28] |
| 2018 | 3400[29] |
| 2019 | 3728[30] |
| 2020 | 3227[31] |
| 2021 | 2829[31] |
Übertragung
Die Übertragung ist durch Genuss von nicht durchgekochtem Fleisch (Hausschwein, Wildschwein oder Hirsch),[32] per Kontaktinfektion beziehungsweise Schmierinfektion fäkal-oral von infizierten Personen und in vielen Ländern über das Wasser möglich. Die Transmission von Person zu Person mittels Tröpfcheninfektion ist nicht nachgewiesen. In Deutschland werden auf Anordnung des Paul-Ehrlich-Instituts seit Januar 2020 Blutspenden verbindlich auf Hepatitis E getestet und nur HEV-freie Präparate freigegeben.[33][34][35]
Klinischer Verlauf
Die Erkrankung hat eine Inkubationszeit von 30 bis 40 Tagen und ist klinisch nicht von der Hepatitis A zu unterscheiden. Sie ist jedoch schwerer im Verlauf, in 0,5 bis 4 % der Fälle sogar tödlich. Besonders Schwangere sollten nicht in Endemiegebiete reisen, da eine Infektion während der Schwangerschaft mit einer Sterblichkeit von rund 25 % bei der werdenden Mutter verbunden ist.[36] Nach Organtransplantation kann die Hepatitis E in eine chronische Verlaufsform übergehen[37] und zur Leberzirrhose führen.[38]
Therapie
Da die Erkrankung in der Regel selbstlimitiertend ist, beschränkt sich die Therapie meist auf symptomatisch-unterstützende Maßnahmen.[39] Eine Ausnahme bilden Patienten mit geschwächtem Immunsystem, die häufig nicht in der Lage sind, das Virus gewissermaßen aus eigener Kraft zu eliminieren, so dass es zur Chronifizierung der Erkrankung kommt. In diesen Fällen ist es häufig sinnvoll, einen Therapieversuch mit Ribavirin zu unternehmen.[5] Ribavirin ist für diese Anwendung nicht zugelassen (Stand 2021). Daher sollte vor Therapiebeginn eine Kostenerstattung bei der Krankenkasse beantragt werden.[40]
Impfung
Ein Impfstoff befindet sich in klinischer Erprobung. Die Effektivität konnte im März 2007 in einer Phase-2-Studie, die in Nepal durchgeführt wurde, nachgewiesen werden.[41] 2010 konnte in einer chinesischen Studie mit 56.302 Geimpften und einer ebenso großen Kontrollgruppe statistisch signifikant die Wirkung des Impfstoffs nachgewiesen werden. Von den geimpften Personen erkrankte in zwölf Monaten niemand an der Erkrankung, während 15 Personen der Kontrollgruppe erkrankten.[42] Der Impfstoff erhielt als HEV 239 in der Volksrepublik China im April 2012 die Zulassung.[43]
Meldepflicht
In Deutschland ist jede akute Virushepatitis (also auch akute Hepatitis E) gemäß § 6 Infektionsschutzgesetz (IfSG) namentlich meldepflichtig.[44] Dies betrifft den Verdacht einer Erkrankung, die Erkrankung sowie den Tod. Zudem ist auch jeder direkte oder indirekte Nachweis des Hepatitis-E-Virus nach § 7 IfSG namentlich meldepflichtig, soweit der Nachweis auf eine akute Infektion hinweisen.
In Österreich sind nach § 1 Abs. 1 Epidemiegesetz 1950 Verdachts-, Erkrankungs- und Todesfälle an infektiöser Hepatitis (Hepatitis A, B, C, D, E), also auch an Hepatitis E, anzeigepflichtig.
Auch in der Schweiz unterliegt Hepatitis E der Meldepflicht[45] und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldekriterien für diese Meldung durch Ärzte, Spitäler usw. ist ein positiver laboranalytischer Befund. Ein positiver laboranalytischer Befund bei PCR-Analyse oder ein negativer laboranalytischer Befund für das Hepatitis-E-Virus ist von Laboratorien nach Anhang 3 der oben genannten Verordnung des EDI zu melden.
Literatur
Übersichtsartikel
- J. H. Hoofnagle, K. E. Nelson, R. H. Purcell: Hepatitis E. In: The New England journal of medicine. Band 367, Nummer 13, September 2012, S. 1237–1244, doi:10.1056/NEJMra1204512, PMID 23013075.
- N. Kamar, R. Bendall, F. Legrand-Abravanel, N. S. Xia, S. Ijaz, J. Izopet, H. R. Dalton: Hepatitis E. In: The Lancet. Band 379, Nummer 9835, Juni 2012, S. 2477–2488, doi:10.1016/S0140-6736(11)61849-7, PMID 22549046.
Weblinks
- Hepatitis E – Informationen des Robert Koch-Instituts
- Fragen und Antworten zur Übertragung des Hepatitis E-Virus durch Wild- und Hausschweine und daraus gewonnene Lebensmittel Verbraucherinformation des Bundesinstituts für Risikobewertung vom 9. Februar 2016
- Hepatitis E: Vermehrt Infektionen durch Schweinefleisch. Mit Video aus der Fernsehsendung „Visite“ des NDR (Webseitenstand: 5. Dezember 2018)
Einzelnachweise
- RKI – RKI-Ratgeber – Hepatitis E. In: rki.de. Abgerufen am 29. Juli 2018.
- Hepatitis E: rohes Schweinefleisch ist Hauptursache für Infektionen in der EU. In: efsa.europa.eu, Europäische Behörde für Lebensmittelsicherheit, 11. Juli 2017, abgerufen am 29. Juli 2017.
- ICTV Master Species List 2018b v1. MSL #34, Feb. 2019.
- ICTV: ICTV Master Species List 2019.v1. New MSL including all taxa updates since the 2018b release. MSL #35. März 2020.
- S. Pischke, P. Behrendt, C. T. Bock, Jilg W, Manns MP, Wedemeyer H: Hepatitis E in Deutschland – eine unterschätzte Infektionskrankheit. In: Deutsches Ärzteblatt. Band 111, 2014, S. 577–583, doi:10.3238/arztebl.2014.0577.
- Arbeitskreis Blut, Untergruppe «Bewertung Blutassoziierter Krankheitserreger»: Hepatitis E Virus. In: Transfus Med Hemother. Band 36, Nr. 1, Februar 2009, S. 40–47, doi:10.1159/000197321, PMID 21048820.
- SIB: Orthohepevirus. In: ViralZone, SIB Swiss Institute of Bioinformatics, abgerufen am 22. September 2021.
- O. Wichmann, S. Schimanski, J. Koch, M. Kohler, C. Rothe, A. Plentz, W. Jilg, K. Stark: Phylogenetic and case-control study on hepatitis E virus infection in Germany. In: The Journal of Infectious Diseases. Band 198, Nummer 12, Dezember 2008, S. 1732–1741, doi:10.1086/593211, PMID 18983248.
- A. Schielke, K. Sachs, M. Lierz, B. Appel, A. Jansen, R. Johne: Detection of hepatitis E virus in wild boars of rural and urban regions in Germany and whole genome characterization of an endemic strain. In: Virology journal. Band 6, 2009, S. 58, doi:10.1186/1743-422X-6-58, PMID 19442307, PMC 2689194 (freier Volltext).
- Mirko S. Faber, Jürgen J. Wenzel, Wolfgang Jilg, Michael Thamm, Michael Höhle: Hepatitis E Virus Seroprevalence among Adults, Germany. In: Emerging Infectious Diseases. Band 18, Nr. 10, Oktober 2012, S. 1654–1657, doi:10.3201/eid1810.111756, PMID 23018055, PMC 3471611 (freier Volltext) – (cdc.gov [abgerufen am 16. Juni 2016]).
- Fragen und Antworten zur Übertragung des Hepatitis E-Virus durch Wild- und Hausschweine und daraus gewonnene Lebensmittel. In: FAQ des BfI. Bundesinstitut für Risikobewertung, 9. Februar 2016, abgerufen am 31. August 2016.
- Hepatitis-E-Viren in Schweinefleisch nachgewiesen Neue Studie zeigt Häufigkeit von Verunreinigungen in kommerziellem Schweinefleisch. In: uni-tuebingen.de. Universitätsklinikum Tübingen. Medizinische Klinik. Institut für Tropenmedizin, Reisemedizin, Humanparasitologie, 8. September 2020, abgerufen am 9. September 2020.
- Hepatitis E durch rohes Schweinefleisch. (Nicht mehr online verfügbar.) In: Visite. NDR, 30. August 2016, archiviert vom Original am 2. September 2016; abgerufen am 31. August 2016.
- Hepatitis E – Experteninterview. (Nicht mehr online verfügbar.) In: Visite. NDR, 30. August 2016, archiviert vom Original am 2. September 2016; abgerufen am 31. August 2016.
- Hepatitis E – Epidemiologie und Risikofaktoren in Deutschland. In: Epidemiologisches Bulletin des RKI. Nr. 49/2008, 5. Dezember 2008.
- Hepatitis-E-Virus breitet sich aus, 28. Juli 2015
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 111 kB) 19. Januar 2007.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 107 kB) 18. Januar 2008.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 124 kB) 19. Januar 2009.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 116 kB) 25. Januar 2010.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 121 kB) 24. Januar 2011.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 121 kB) 23. Januar 2012.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 117 kB) 21. Januar 2013.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 116 kB) 20. Januar 2014.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 307 kB) 19. Januar 2015.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 195 kB) 25. Januar 2016.
- Epidemiologisches Bulletin Nr. 7 des RKI. (PDF; 273 kB) 16. Februar 2017.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 238 kB) 18. Januar 2018.
- Epidemiologisches Bulletin Nr. 3 des RKI. (PDF; 2,5 MB) 16. Januar 2020.
- Epidemiologisches Bulletin Nr. 1 des RKI. (PDF; 2,7 MB) 7. Januar 2020.
- Epidemiologisches Bulletin Nr. 1 des RKI. (PDF; 3,5 MB) 6. Januar 2022
- Public health risks associated with hepatitis E virus (HEV) as a food-borne pathogen. In: efsa.europa.eu, Europäische Behörde für Lebensmittelsicherheit, 11. Juli 2017, abgerufen am 29. Juli 2017.
- Paul-Ehrlich-Institut – Abgeschlossene Verfahren / Bescheide – Bekanntmachung über die Zulassung von Arzneimitteln – Abwehr von Arzneimittelrisiken – Anordnung der Testung von Blutspendern zur Verhinderung einer Übertragung von Hepatitis-E-Virus durch Blutkomponenten zur Transfusion und Stammzellzubereitungen zur hämatopoetischen Rekonstitution – Vom 5. Februar 2019. In: pei.de. Abgerufen am 29. November 2019.
- Paul-Ehrlich-Institut ordnet Hepatitis-E-Virus-Testung von Blutspenden an. In: aerzteblatt.de. 18. Juni 2018, abgerufen am 22. September 2021.
- Dorothea Brummerloh: Neue Regeln für Blutspende. (MP3; 4,4 MB) (Nicht mehr online verfügbar.) In: SWR2. 15. August 2018, archiviert vom Original am 27. Juni 2019; abgerufen am 22. September 2021 (5:01 Min.).
- A. Kumar, M. Beniwal, P. Kar, J. B. Sharma, N. S. Murthy: Hepatitis E in pregnancy. In: International journal of gynaecology and obstetrics. Band 85, Nummer 3, Juni 2004, S. 240–244, doi:10.1016/j.ijgo.2003.11.018, PMID 15145258.
- N. Kamar, J. Selves, J. M. Mansuy, L. Ouezzani, J. M. Péron, J. Guitard, O. Cointault, L. Esposito, F. Abravanel, M. Danjoux, D. Durand, J. P. Vinel, J. Izopet, L. Rostaing: Hepatitis E virus and chronic hepatitis in organ-transplant recipients. In: The New England Journal of Medicine. Band 358, Nummer 8, Februar 2008, S. 811–817, doi:10.1056/NEJMoa0706992, PMID 18287603.
- R. Gérolami, V. Moal, P. Colson: Chronic hepatitis E with cirrhosis in a kidney-transplant recipient. In: The New England Journal of Medicine. Band 358, Nummer 8, Februar 2008, S. 859–860, doi:10.1056/NEJMc0708687, PMID 18287615.
- Gerd Herold u. a.: Innere Medizin. Köln, 2012, S. 525 f.
- Ribavirin-ratiopharm® 200 mg / 400 mg Filmtabletten (Fachinformation). (PDF; 119 kB) Ratiopharm, 27. Januar 2017, abgerufen am 22. September 2021.
- M. P. Shrestha, R. M. Scott, D. M. Joshi, M. P. Mammen, G. B. Thapa, N. Thapa, K. S. Myint, M. Fourneau, R. A. Kuschner, S. K. Shrestha, M. P. David, J. Seriwatana, D. W. Vaughn, A. Safary, T. P. Endy, B. L. Innis: Safety and efficacy of a recombinant hepatitis E vaccine. In: The New England Journal of Medicine. Band 356, Nummer 9, März 2007, S. 895–903, doi:10.1056/NEJMoa061847, PMID 17329696.
- F. C. Zhu, J. Zhang, X. F. Zhang, C. Zhou, Z. Z. Wang, S. J. Huang, H. Wang, C. L. Yang, H. M. Jiang, J. P. Cai, Y. J. Wang, X. Ai, Y. M. Hu, Q. Tang, X. Yao, Q. Yan, Y. L. Xian, T. Wu, Y. M. Li, J. Miao, M. H. Ng, J. W. Shih, N. S. Xia: Efficacy and safety of a recombinant hepatitis E vaccine in healthy adults: a large-scale, randomised, double-blind placebo-controlled, phase 3 trial. In: The Lancet. Band 376, Nummer 9744, September 2010, S. 895–902, doi:10.1016/S0140-6736(10)61030-6, PMID 20728932.
- Allison Proffitt: First HEV vaccine approved. In: Nature Biotechnology. 30, 2012, S. 300–300, doi:10.1038/nbt0412-300a.
- Hepatitis E. RKI-Ratgeber. In: rki.de. Robert Koch-Institut, 2. November 2015, abgerufen am 18. März 2020.
- Fabienne Riklin: In der Mortadella-Leberwurst lauert Hepatitis-Gefahr. In: tagesanzeiger.ch. 23. Oktober 2018, abgerufen am 23. Oktober 2018.