Virusartige Partikel
Virusartige Partikel (auch virusähnliche Partikel, englisch virus-like particles, VLP) sind Viruspartikel, die keine funktionalen Nukleinsäuren enthalten.
VLPs werden zu Impfzwecken eingesetzt. Sie werden ferner in der Virologie und in der Immunologie benötigt, um Immunreaktionen, Viren und Zellfunktionen zu untersuchen.
Eigenschaften
VLPs bestehen aus strukturiert zusammengelagerten Proteinen der viralen Kapsel (Kapsid) oder Hülle. Da sie keine viralen Nukleinsäuren enthalten, können sie nicht in den Zielzellen vermehrt werden. Da sie ferner – anders als virale Vektoren – auch keine anderen funktionalen Nukleinsäuren enthalten, sind sie auch nicht in der Lage, ein Transgen zu überbringen.
VLPs sind dennoch oftmals nicht leer, sondern können – etwa zur Stabilisierung – unspezifische Nukleinsäuren oder nicht funktionelle DNA bzw. RNA mit den jeweiligen Erkennungssequenzen enthalten. In größeren VLPs können gezielt Proteine verpackt werden.
Anwendungen
Virusartige Partikel sind etwa für die Impfstoffherstellung bedeutsam, da sie durch das enthaltene Virusprotein immunogen wirken, jedoch nicht vermehrungsfähig sind und sich im Gegensatz zu den Ganzvirus- oder Spaltimpfstoffen, die aus aufwändig zu kultivierenden Viren gewonnen werden, auch rekombinant herstellen lassen. Medizinisch verwendete VLPs lassen sich in Analogie zur Morphologie der pathogenen Viren einteilen in nicht-umhüllte und umhüllte Partikel. Als Expressionssysteme kommen Bakterien, Hefen, Insektenzellen, Säugetier- und Vogelzellen sowie Pflanzenzellen, aber auch zellfreie Systeme zur Anwendung.
Nicht umhüllte VLPs
Sie bestehen aus einem oder mehreren Proteinen, die sich einschichtig oder mehrschichtig zusammenlagern. Die rekombinant hergestellten Proteine lassen sich je nach Expressionssystem glykosiliert oder nicht-gykosiliert erzeugen, was sich auf die Effizienz der Immunisierung auswirken kann. Als Weiterentwicklungen anzusehen sind Impfstoffantigene, die mittels genetischer Fusion oder chemischer Konjugation an virale Strukturproteine hergestellt werden, wobei chimäre VLPs entstehen. Technologisch existieren verschiedene Strategien zur „Dekoration“ einer VLP-Oberfläche mit Antigenen, unter denen bspw. SpyTag-/SpyCatcher-Technologie zu erwähnen ist.[1]
Frühe VLP-Impfstoffe stellen die Schutzimpfungen ab den 1980er Jahren gegen Hepatitis B dar, die Partikel von Oberfächenantigenen des Hepatitis-B-Virus (HBV) enthalten (HBsAg, S-Protein). Die ersten Vertreter (Heptavax B, Hevac B) wurden aus dem Blutplasma von mit HBV infizierten Patienten gewonnen, wegen der Kontaminationsgefahr jedoch später ersetzt durch rekombinant ─ entweder mittels des Hefepilzes Saccharomyces cerevisiae (monovalent: Recombivax, Engerix B) oder mittels CHO-Zellen (bivalent: GenHevac B; trivalent: Sci-B-Vac) ─ produzierter Impfstoffe.
| Ziel | Plattform | Expressionssystem(e) | Antigen(e) | Impfstoffname(n) |
|---|---|---|---|---|
| Nicht umhüllte VLP | ||||
| HBV | HBsAg | S. cerevisiae | HBsAg | Recombivax, Engerix B |
| HBsAg | P. pastoris | HBsAg | Enivac HB, Heberbiovac HB | |
| HBsAg | H. polymorpha | HBsAg | Hepavax-Gene | |
| HBsAg | CHO-Zellen | HBsAg, prä-S2 | GenHevac B | |
| HBsAg | CHO-Zellen | HBsAg, prä-S1, prä-S2 | Sci-B-Vac | |
| HBsAg | P. pastoris, E. coli | HBsAg, HBcAg | HeberNasvac (CU) | |
| P. falciparum (Malaria) | HBsAg | S. cerevisiae | Circumsporozoit-Protein (CSP) von P. falciparum | Mosquirix[Anmerk. 1] (RTS,S, chimäres VLP) |
| HEV | HEV | S. cerevisiae | HEV 239 (HEV/ORF2)[3] | Hecolin (CN) |
| HPV | HPV | S. cerevisiae | HPV 6/11/16/18 L1 | Gardasil |
| HPV | S. cerevisiae | HPV 6/11/16/18/31/33/45/52/58 L1 | Gardasil 9 | |
| HPV | IC-BEVS | HPV 16/18 L1 | Cervarix | |
| PCV2 | PCV | IC-BEVS | PCV2/ORF2 | Ingelvac CircoFLEX, Porcilis PCV ID |
| Virosomale VLP | ||||
| IAV | Influenza-Virosom | zellfrei | Influenza A (H1N1), A H3N2, B, HA und NA | Infexal V[Anmerk. 2] |
| HAV | Influenza-Virosom | zellfrei | Inakiviertes HAV (Stamm: RG-SB) | Epaxal [Anmerk. 2] |
| ||||
Einen therapeutischen Impfstoff zur Behandlung der chronischen Hepatitis B (CHB) stellt die Kombination von VLPs des HBsAg mit dem Kapsidproteins HBcAg dar, die in Pichia pastoris bzw. Escherichia coli exprimiert werden. (HeberNasvac).[4]
Bei den beiden 2006 und 2007 eingeführten Impfstoffen gegen durch Papillomviren ausgelöste Erkrankungen (bestimmte Krebsarten des Gebärmutterhalses, des Penis, der Vulva, des Anus und des Mundes, sowie Genitalwarzen) handelt es sich um virusartige Partikel, die spontan oder induziert entstehen durch das Zusammenlagern von L1-Kapsidproteinen verschiedener Papillomvirusstämme. Diese Proteine werden ebenfalls rekombinant hergestellt, in Saccharomyces cerevisiae (Gardasil) oder in einer von dem Schmetterling Aschgraue Höckereule (Trichoplusia ni) abgeleiteten Insektenzelllinie mittels des Baculovirus-Expressionssystems (Cervarix).
Ein weiterer bis zur Marktreife gelangter VLP -Impfstoff ist PCV2/ORF2 zur Impfung von Mastschweinen gegen die durch Infektion mit dem porcinen Circovirus-2 (PCV2) verursachten Krankheitsbilder (porcine circovirus diseases, PCVD). Sie sind insbesondere durch ausbleibendes Wachstum, Gewichtsverlust und erhöhte Sterblichkeit der Tiere gekennzeichnet, einhergehend mit einer entsprechenden Viruslast in Blut und lymphatischen Geweben sowie Virenausscheidung. Der Wirkstoff enthält das Hauptkapsidprotein, das von einem spezifischen Gen (dem Open-Reading-Frame-2-Gen, ORF2) des PCV2 kodiert wird. Die Herstellung erfolgt in Baculovirus-Insektenzell-Expressionssystemen (IC-BEVS) mittels Zelllinien aus den Ovarien des Schmetterlings Spodoptera frugiperda, wobei die Zelltypen Sf-9 (Ingelvac CircoFLEX[5]) oder Sf-21 (Porcilis PCV ID[6]) zum Einsatz kommen.
Mit RTS,S (Mosquirix) wurde 2015 ein chimäres VLP als Malariaimpfstoff entwickelt zur Immunisierung gegen die durch Plasmodium falciparum ausgelöste Malaria. Der Wirkstoff besteht aus zwei rekombinanten Proteinen: dem RTS-Fusionsprotein (Teil des Circumsporozoiten-Proteins von P. falciparum und HBsAg) und freiem S-Protein des Hepatitis-B-Virus (HBsAg). Beide werden in Saccharomyces cerevisiae exprimiert und lagern sich intrazellulär und spontan zu gemischten Partikelstrukturen zusammen.[7]
Erforscht wird auch die Eignung der Mantelproteine verschiedener Pflanzenviren (Tabakmosaikvirus, Alfalfa-Mosaikvirus, Augenbohnenmosaikvirus, Kartoffelmosaikvirus) als Fusionspartner für Impfstoffantigene. Als Zielantigene wurden diverse Krankheitserreger wie etwa P. falciparum, Tollwutvirus, HIV-1, Humanes Respiratorisches Synzytial-Virus oder Influenzavirus eingesetzt.
Komplexere VLPs stellen solche aus mehreren strukturellen Proteinen dar, die sich beispielsweise aus Vertretern der Virenfamilie der Reoviridae erzeugen lassen: aus bis zu nur vier der sieben Kapsidproteine des Blauzungenvirus konnten in Baculovirus-Insektenzell-Expressionssystemen VLP-Impfantigene gegen die Blauzungenkrankheit der Wiederkäuer gewonnen werden, aus vier Strukturproteinen des Rotavirus entstanden stabile doppel- und dreischichtige VLPs.
Das Core Protein des Hepatitis-B-Virus (HBcAg) dient auch als Basis für die extravirale Proteindomäne des Matrixprotein 2 des Influenzavirus zur Erzeugung von breitenwirksamen Impfstoffen gegen Influenza.[8] Weiterhin werden VLPs basierend auf dem Norwalk-Virus,[9][10] dem Parvovirus[9] und Filoviren[11] eingesetzt.
Umhüllte VLPs
Mit einer Hüllmembran umgebene VLPs lassen sich unter Einsatz von Insektenzellen, Säugetierzellen oder Pflanzenzellen herstellen. Umhüllte VLPs stellen komplexe Strukturen dar und bestehen aus der Wirtszellmembran als Hülle, auf deren Außenfläche die integrierten Zielantigene präsentiert werden. Umhüllte VLPs bieten ein höheres Maß an Flexibilität für die Integration von mehreren Antigenen aus denselben oder heterologen Pathogenen. Die Herstellung von umhüllten VLPs erfordert neben der Koexpression mehrerer struktureller viraler Proteine, die sich zu Partikeln zusammenfügen und in die Wirtsmembran eingebaut werden, auch die Abschnürung der VLPs aus der Membran der Wirtszelle („Knospung“). Um eine solche Knospung auszulösen, bedarf es eines Signals durch ein Protein eines behüllten Virus. Als geeignet gezeigt haben sich etwa bestimmte Strukturproteine des Influenza-A-Virus, die gag und env-Proteine von Retroviren, sowie die Kern- und Hüllproteine des Hepatitis-C-Virus (HCV). Untersucht wurde die Integration von entsprechenden Oberflächenproteinen krankmachender Erreger wie SARS-CoV in von Säugetierzelllinien oder die Oberflächenproteine von Ebolaviren in von Insektenzelllinien produzierten Membranhüllen.
Die zellfreie in-vitro-Konstitution von Virusproteinen mit membranartigen Strukturen aus Phospholipiden führt zu „Virosome“ genannten Partikeln. Sie ähneln im Aufbau den Liposomen, tragen aber in ihrer Lipidmembran zusätzlich Proteine der Virushülle. Abhängig von der gewünschten Art der Immunantwort, die durch einen virosomalen Impfstoff induziert werden soll, kann das Antigen entweder auf der Virosomenoberfläche präsentiert werden (durch Integration oder Verankerung in der Lipiddoppelschicht, Vernetzung mit membranassoziierten viralen Proteinen oder Adsorption an der Doppelschichtoberfläche) oder in sein Inneres eingebettet werden, wodurch die Antikörperproduktion bzw. CTL-Reaktionen stimuliert werden.
Beispiele für Impfstoffe auf Basis zellfrei hergestellter VLPs sind der virosomal formulierte Influenza-A-Impfstoff Inflexal V und der Hepatitis-A-Impfstoff Epaxal. Der Vertrieb wurde vom Hersteller aufgegeben.[12]
Ausblick
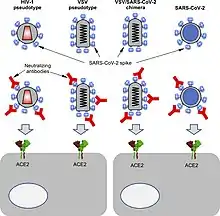
VLP wurden bzw. werden in zahlreichen Anwendungsgebieten erprobt, darunter auch als SARS-CoV-2-Impfstoff.[13] Jedoch nicht nur Vorbeugung vor Infektionskrankheiten sind mögliche Indikationen, sondern auch therapeutische Ansätze werden verfolgt, beispielsweise für die gezielte Freisetzung von Arzneistoffen (drug delivery, cellular targeting), für die Gentherapie und zur Behandlung von Krebserkrankungen.[14]
Literatur
- E.V. Grgacic, D.A. Anderson: Virus-like particles: passport to immune recognition. In Methods. Band 40, 2006. S. 60─65doi: 10.1016/j.ymeth.2006.07.018.
- N. Kushnir, S.J. Streatfield, V. Yusibov: Virus-like particles as a highly efficient vaccine platform: Diversity of targets and production systems and advances in clinical development. Vaccine, Band 31, 2012, S. 58–83. doi:10.1016/j.vaccine.2012.10.083.
- A. Roldão, M.C. Mellado, L.M. Castilho et al.: Virus-like particles in vaccine development. Expert Reviews Vaccines, Band 9, 2010, S. 1149–1176. doi: 10.1586/erv.10.115
- L.H.L. Lua, N.K. Connors, F. Sainsbury, Y.P. Chuan, N. Wibowo, AP.J. Middelberg: Bioengineering Virus-Like Particles as Vaccines. Biotechnology and Bioengineering, Band 111, 2014. S. 425–440. doi: 10.1002/bit.25159.
Einzelnachweise
- K.L. Aves, L. Goksøyr, A.F. Sander: Advantages and Prospects of Tag/Catcher Mediated Antigen Display on Capsid‐Like Particle‐Based Vaccines. Viruses, Band 12 (2020), S. 185. doi:10.3390/v12020185
- nach Kushnir et al. 2012
- Hepatitis E Vaccine: Composition, Safety, Immunogenicity and Efficacy. A document prepared for Strategic Advisory Group of Experts on Immunization (SAGE) by the Hepatitis E Vaccine Working Group. WHO, 2014 (PDF).
- J.K. Ho, B. Jeevan-Raj, H.-J. Netter: Hepatitis B Virus (HBV) Subviral Particles as Protective Vaccines and Vaccine Platforms, Viruses, Band 12 (2020), S. 126.
- Ingelvac CircoFLEX - Scientific Disussion , EMA, 25. Februar 2008 (PDF)
- CVMP assessment report for Porcilis PCV ID, EMA, 9. Juli 2015 (PDF)
- Assessment report Mosquirix™, EMA, 23. Juli 2015 (PDF).
- W. Fiers, M. De Filette, K. El Bakkouri, B. Schepens, K. Roose, M. Schotsaert, A. Birkett, X. Saelens: M2e-based universal influenza A vaccine. In: Vaccine. (2009) 27(45):6280-3. PMID 19840661.
- A. Roldão, M. C. Mellado, L. R. Castilho, M. J. Carrondo, P. M. Alves: Virus-like particles in vaccine development. In: Expert Rev Vaccines. (2010) Bd. 9(10), S. 1149–76. PMID 20923267.
- M. Herbst-Kralovetz, H. S. Mason, Q. Chen: Norwalk virus-like particles as vaccines. In: Expert Rev Vaccines. (2010) Bd. 9(3), S. 299–307. PMID 20218858; 2862602/ PMC 2862602 (freier Volltext).
- K. L. Warfield, M. J. Aman: Advances in virus-like particle vaccines for filoviruses. In: J Infect Dis. (2011) Bd. 204 Suppl 3, S. S1053-9. PMID 21987741; 3189993/ PMC 3189993 (freier Volltext).
- Novartis: Grippeimpfstoffe gehen an bioCSL, apotheke adhoc, 27. Oktober 2024.
- Virus-like particles as possible Covid-19 vaccine. In: www.mpg.de. 17. September 2020, abgerufen am 14. Februar 2021.
- D. Yan, Y.Q. Wei, H.C. Guo, S.Q. Sun: The application of virus-like particles as vaccines and biological vehicles. Applied Microbiology and Biotechnology, Band 99, 2015, S. 10415–10432. doi:10.1007/s00253-015-7000-8