Ebola-Impfstoff
Ein Ebola-Impfstoff ist ein Impfstoff gegen das Ebolavirus.
Einsatz
Vor 2014 wurden verschiedene experimentelle Impfstoffe durch Impfstoffdesign entwickelt,[1] die zwar in Tierversuchen vor einer Infektion mit Ebolaviren schützten,[2][3][4] bei denen jedoch keine Arzneimittelzulassung erfolgt war. Im Zuge der Ebolafieber-Epidemie 2014 bis 2016 wurden die Zulassungsverfahren für verschiedene Ebolaimpfstoffe und Medikamente beschleunigt.[5][6]
Die Weltgesundheitsorganisation schrieb in einer Stellungnahme, dass es im Zuge der Ebolafieber-Epidemie 2014 ethisch akzeptabel sei, präventive oder therapeutische Arzneimittel ohne Nachweis der Wirksamkeit im Menschen bei ebendiesen einzusetzen, wenn in Tierversuchen vielversprechende Ergebnisse gezeigt werden konnten.[7]
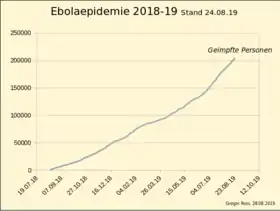
Während der Ebolafieber-Epidemie 2018 bis 2020 im Osten der Demokratischen Republik Kongo wurde am 8. August 2018 mit einer groß angelegten Impfkampagne begonnen. Seit Beginn dieser Kampagne wurden (Stand 18. Dezember 2018) 49.940 Menschen mit dem Ebola-Impfstoff versorgt, darunter alleine 19.120 in der Stadt Beni. Verwendet wird nach Entscheidung einer Ethikkommission ausschließlich der Impfstoff rVSV-ZEBOV der Firma MSD.[8] Der Impfstoff erwies sich begleitenden Studien zufolge als hochwirksam[9] und wurde im November 2019 als erster Impfstoff weltweit in Europa unter Vorbehalt zugelassen.[10]
cAd3-ZEBOV
Der Impfstoffkandidat cAd3-ZEBOV ist ein replikationskompetentes Schimpansen-Adenovirus, das auch das Glykoprotein (GP) des Zaire-Ebolavirus codiert.
VSV-EBOV
Der Impfstoff VSV-EBOV basiert auf dem Vesicular stomatitis virus (VSV) und codiert ebenfalls das Glykoprotein des Zaire-Ebolavirus. Er wurde unter den Namen Ervebo der Firma MSD Ende November 2019 in Europa (zunächst unter Vorbehalt) und Ende Dezember 2019 in den USA zugelassen.[11][12]
AdVac und MVA-BN
Ein Kombinationsimpfung aus zwei Impfstoffkandidaten (basierend auf Adenoviren und Vacciniaviren) wurde von Janssen Pharmaceutica, einer Tochterfirma von Johnson & Johnson, in Zusammenarbeit mit Bavarian Nordic entwickelt.[13][14] Sie ist seit Juli 2020 in Europa als Zabdeno/Mvabea (Ad26.ZEBOV/MVA-BN-Filo) zugelassen.[11]
VSV-EBOV/Ad5-EBOV
Als GamEvac-Kombi ist in Russland ein kombinierter Vektorimpfstoff zugelassen, der auf zwei rekombinant hergestellten, replizierenden viralen Vektoren basiert, in die der genetische Code für ein Glykoprotein (GP) in der Hülle des Zaire-Ebolavirus (ZEBOV, Variante Makona) eingesetzt wurde. Als Trägerviren fungieren ein abgeschwächter vesikulärer Stomatitis-Virus (VSV) und ein humaner Adenovirus vom Typ-5 (Ad5). GamEvac-Kombi wurde vom staatlichen Gamaleja-Institut für Epidemiologie und Mikrobiologie entwickelt und erhielt im Dezember 2015 vom russischen Gesundheitsministerium eine Notfallzulassung, die auf klinischen Daten der Phasen I und II zu Sicherheit und Immunogenität basierte.[15] Das Impfschema beinhaltet zwei intramuskuläre Verabreichungen beginnend mit einer Prime-Immunisierung mit VSV, gefolgt von einer Booster-Immunisierung mit Ad5 nach 21 bis 28 Tagen.[16] Inzwischen wurde der Abschluss weiterer Studien vermeldet,[17][18] auch für die gefriergetrockneten Darreichungsvariante GamEvac-Lyo.[19]
Triazoverin
Das russische Gesundheitsministerium hat für einen Impfstoffkandidaten klinische Studien für 2015 angekündigt.[20][21]
Nasaler Impfstoff
Die University of Texas-Austin untersucht einen Impfstoffkandidaten, der auf dem Adenovirus basiert und nasal angewendet wird.[23][24]
Einzelnachweise
- J. S. Richardson, J. D. Dekker, M. A. Croyle, G. P. Kobinger: Recent advances in Ebolavirus vaccine development Archiviert vom Original am 22. Oktober 2014. In: Human Vaccines (open access). 6, Nr. 6, Juni 2010, S. 439–49. doi:10.4161/hv.6.6.11097. PMID 20671437.
- T. Hoenen, A. Groseth, H. Feldmann: Current Ebola vaccines. In: Expert Opin Biol Ther. 12, Nr. 7, Juli 2012, S. 859–872. doi:10.1517/14712598.2012.685152. PMID 22559078. PMC 3422127 (freier Volltext).
- A. T. Peterson, J. T. Bauer, J. N. Mills: Ecologic and Geographic Distribution of Filovirus Disease. In: Emerging Infectious Diseases. 10, Nr. 1, 2004, S. 40–47. doi:10.3201/eid1001.030125. PMID 15078595. PMC 3322747 (freier Volltext).
- H. Fausther-Bovendo, S. Mulangu, N. J. Sullivan: Ebolavirus vaccines for humans and apes. In: Curr Opin Virol. 2, Nr. 3, Juni 2012, S. 324–29. doi:10.1016/j.coviro.2012.04.003. PMID 22560007. PMC 3397659 (freier Volltext).
- C. L. Cooper, S. Bavari: A race for an Ebola vaccine: promises and obstacles. In: Trends in microbiology. [elektronische Veröffentlichung vor dem Druck] Dezember 2014, ISSN 1878-4380, doi:10.1016/j.tim.2014.12.005, PMID 25535021.
- L. Ye, C. Yang: Development of vaccines for prevention of Ebola virus infection. In: Microbes and infection / Institut Pasteur. [elektronische Veröffentlichung vor dem Druck] Dezember 2014, ISSN 1769-714X, doi:10.1016/j.micinf.2014.12.004, PMID 25526819.
- WHO - Ethical considerations for use of unregistered interventions for Ebola virus disease. Abgerufen am 8. Oktober 2014.
- Situation épidémiologique dans les provinces du Nord-Kivu et de l'Ituri. Dr. Oly Ilunga Kalenga, Ministre de la Santé, 20. Dezember 2018, abgerufen am 20. Dezember 2018 (französisch).
- Daniela Hüttemann: Ebola-Impfung scheint hochwirksam zu sein. In: Pharmazeutische Zeitung. 24. April 2019, abgerufen am 30. April 2019.
- dpa / jb: EU-Zulassung für Ebola-Impfstoff Ervebo. 12. November 2019, abgerufen am 12. November 2019.
- Ebola-Impfstoffe. In: Paul-Ehrlich-Institut. 3. Dezember 2020, abgerufen am 12. Januar 2021.
- ERVEBO. In: FDA. 16. Januar 2020, abgerufen am 12. Januar 2021 (englisch).
- Fergus Walsh: Ebola: New vaccine trial begins. 6. Januar 2015.
- Johnson & Johnson Announces Major Commitment to Speed Ebola Vaccine Development and Significantly Expand Production. Johnson & Johnson. Abgerufen am 6. Januar 2015.
- WHO Strategic Advisory Group of Experts (SAGE) on Immunization: Ebola vaccines – Background paper for SAGE deliberations. SAGE meeting of October 2018, Background documents.
- GamEvac-Kombi kombinierter Vektorimpfstoff gegen Ebola, Vidal, abgerufen am 1. September 2020 (russisch).
- Klinische Studie (Phase (observational)): Open Study of the Duration of Immunity After Vaccination With GamEvac-Combi bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase IV): International Multicenter Study of the Immunogenicity of Medicinal Product GamEvac-Combi bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase I/II): A Double-blind Randomized Placebo-controlled Study of Safety and Immunogenicity of GamEvac-Lyo bei Clinicaltrials.gov der NIH
- Ebola crisis: Vaccine 'too late' for outbreak. In: BBC News. 17. Oktober 2014. Abgerufen am 14. Januar 2015.
- Russian Scientists Develop New Vaccine to Fight Ebola Virus. In: The Moscow Times. 27. August 2014. Archiviert vom Original am 20. Oktober 2014. Abgerufen am 14. Januar 2015.
- Novavax: Novavax Announces Ebola Vaccine Development Program at the 8th Vaccine and ISV Conference in Philadelphia. 27. Oktober 2014. Archiviert vom Original am 29. Oktober 2014. Abgerufen am 28. Oktober 2014.
- Todd Ackerman: UT nasal spray vaccine for Ebola effective in monkeys. In: Houston Chronicle, 5. November 2014. Abgerufen am 13. November 2014.
- J. H. Choi, K. Jonsson-Schmunk, X. Qiu, D. J. Shedlock, J. Strong, J. X. Xu, K. L. Michie, J. Audet, L. Fernando, M. J. Myers, D. Weiner, I. Bajrovic, L. Q. Tran, G. Wong, A. Bello, G. P. Kobinger, S. C. Schafer, M. A. Croyle: A Single Dose Respiratory Recombinant Adenovirus-Based Vaccine Provides Long-Term Protection for Non-Human Primates from Lethal Ebola Infection. In: Molecular Pharmaceutics. [elektronische Veröffentlichung vor dem Druck] November 2014, ISSN 1543-8392, doi:10.1021/mp500646d, PMID 25363619.