Antigenpräsentation
Die Antigenpräsentation bezeichnet in der Immunologie die Präsentation von Antigenen durch Zellen gegenüber Immunzellen. Die so präsentierten Antigene lösen in Folge eventuell eine adaptive Immunantwort aus. Die präsentierende Zelle wird als Antigen-präsentierende Zelle (APC) bezeichnet. Die Antigenpräsentation erfolgt über unterschiedliche Mechanismen. Nicht alle Zelltypen haben alle Formen der Antigenpräsentation. Zellen, die vornehmlich Antigene präsentieren, werden als professionelle Antigen-präsentierende Zellen (prAPC) bezeichnet.

1 Antigen
2 Antigen-präsentierende Zelle
3 Antigen-MHC-II-Komplex
4 T-Helfer-Zelle
5 gebundenes Antigen
6 B-Lymphozyt
7 Antigen-Prozessierung
8 Antigen-MHC-II-Komplex
9 Produktion Antigen-spezifischer Antikörper
10 Aktivierung eines B-Lymphozyten
| Übergeordnet |
| Prozess des Immunsystems |
| Untergeordnet |
| Antigenpräsentation in B-/T-/dendritischen Zellen/Monozyten/Makrophagen Präsentation exogener/endogener/Peptid-Antigene Antigenpräsentation nach rezeptorgesteuerter Aufnahme/Pinozytose/Phagozytose via MHC IB/II |
| Gene Ontology |
|---|
| QuickGO |
Eigenschaften
Es gibt vier Typen von Proteinen, die Antigene präsentieren: MHC-I, MHC-II, CD1 (MHC-I-ähnlich) und MR1 (MHC-I-ähnlich). Die ersten beiden Typen besitzen Bindungsstellen zur Präsentation von Peptiden, während CD1 Lipide bindet und präsentiert und MR-1 Vitaminvorläufer bakteriellen Ursprungs. Je nach Aufenthaltsort und Mechanismus zur Präsentation werden bei MHC-I Antigene präsentiert, die aus dem Zytosol der Zelle stammen (intrazellulärer Ursprung), wohingegen bei MHC-II und CD1 Antigene präsentiert werden, die von außerhalb der Zelle stammen (extrazellulärer Ursprung). Entsprechend besitzen die unterschiedlichen präsentierenden Proteine unterschiedliche Mechanismen zur Präsentation. Ebenso unterscheidet sich der weitere Verlauf der adaptiven Immunantwort, denn Peptide auf MHC-I werden zytotoxischen T-Zellen präsentiert (zelluläre Immunantwort), während die Präsentation von Peptiden auf MHC-II über ein paar Zwischenschritte zur Ausbildung von Antikörper-produzierenden B-Zellen führt (humorale Immunantwort). Autophagie mindert die Antigenpräsentation auf MHC-I und verstärkt die auf MHC-II.[1] Die MHC-Moleküle werden beim Menschen HLA (engl. human leucocyte antigens) genannt. Dabei entsprechen dem MHC-I: HLA-A, B, C und dem MHC-II: HLA-DR, HLA-DQ und HLA-DP. Bestimmte HLA-Gene stehen in Verbindung mit der Entstehung von Autoimmunkrankheiten, wie Morbus Bechterew, Lupus erythematodes (SLE), Insulin-abhängiger Diabetes Mellitus (IDDM) uvm.
Die Bindungseigenschaften der jeweiligen präsentierenden Proteine sind bekannt und die Bindung von Peptiden kann in silico via IEDB oder SYFPEITHI berechnet werden, jedoch muss im Anschluss eine experimentelle Überprüfung (z. B. per ELISpot) erfolgen.[2]
Antigenpräsentierende Proteine
| Präsentierendes Protein | Antigenstoffklasse | Antigenursprung |
|---|---|---|
| MHC-I | Peptid | intrazellulär |
| MR1 | Metabolit | intrazellulär |
| MHC-II | Peptid | extrazellulär |
| CD1 | Lipid | extrazellulär |
Proteine der Antigenpräsentation
Verschiedene Proteine sind beim Menschen an der Antigenpräsentation beteiligt:[3]
| Protein | Funktion | Genlokalisation auf Chromosom |
|---|---|---|
| HLA-A | Klassischer MHC-I | 6 |
| HLA-B | Klassischer MHC-I | 6 |
| HLA-C | Klassischer MHC-I | 6 |
| HLA-E | Nichtklassischer MHC-I | 6 |
| HLA-F | Nichtklassischer MHC-I | 6 |
| HLA-G | Nichtklassischer MHC-I | 6 |
| MICA | MHC-I-assoziiert | 6 |
| MICB | MHC-I-assoziiert | 6 |
| CD1a | Präsentation von Lipiden | 1 |
| CD1b | Präsentation von Lipiden | 1 |
| CD1c | Präsentation von Lipiden | 1 |
| CD1d | Präsentation von Lipiden | 1 |
| CD1e | ||
| MR1 | Präsentation von Metaboliten gegenüber MAIT-Zellen | 1 |
| HLA-DR | Klassischer MHC-II | 6 |
| HLA-DQ | (HLA-MB, DC) Klassischer MHC-II | 6 |
| HLA-DP | (HLA-SB) Klassischer MHC-II | 6 |
| HLA-DO | (HLA-DNA, DZA + HLA-DOB) Nichtklassischer MHC-II | 6 |
| HLA-DM | (RING6 + RING7) Nichtklassischer MHC-II | 6 |
| Invariant chain (CD74, Ii) | 5 | |
| β2-Mikroglobulin (B2M) | Bestandteil des MHC-I | 15 |
| LMP2 (PSMB9, RING12) | Induzierbare Untereinheit des Proteasoms | 6 |
| LMP7 (PSMB8, RING10) | Induzierbare Untereinheit des Proteasoms | 6 |
| MECL1 (PSMB10) | Induzierbare Untereinheit des Proteasoms | 16 |
| PA28a (PSME1) | Bestandteil des Immunoproteasoms | 14 |
| PA28b (PSME2) | Bestandteil des Immunoproteasoms | 14 |
| TAP1 (RING4, PSF1) | Antigenpeptidtransporter-Untereinheit | 6 |
| TAP2 (RING11, PSF2) | Antigenpeptidtransporter-Untereinheit | 6 |
| ERp57 (PDIA3, GRP58) | Oxidoreduktase im TAP-Komplex | 15 |
| ERAP1 | Aminopeptidase | 5 |
| Tapasin (TAPBP) | Peptidbeladung | 6 |
| TAPBPR (TAPBPL) | Peptidmodifikation | 12 |
| BIP (HSPA5) | ER-Chaperon | 9 |
| GILT (IFI30, IP30) | Thiolreduktase | 19 |
| Protein-Disulfid-Isomerase (P4HB) | ER-Chaperon (redox-reguliert) | 19 |
| Calreticulin (CALR) | ER-Chaperon | 19 |
| Calnexin (CANX) | ER-Chaperon | 5 |
| UGT1 (UGT1A1) | Glucuronosyltransferase | 2 |
| CIITA | Zentraler MHC-II-Transkriptionsfaktor | 16 |
| NLRC5 | Zentraler MHC-I-Transkriptionsfaktor | 16 |
Präsentation gegenüber T-Zellen
MHC-I
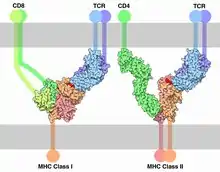
Der Weg über MHC-I dient zur Präsentation intrazellulärer Antigene. MHC-I wird von allen zellkernhaltigen Zellen (mit Ausnahme der Trophoblasten) gebildet. Erythrozyten (synonym rote Blutkörperchen) sind zellkernlos und besitzen auf ihrer Zelloberfläche kein MHC I. In jedem Menschen gibt es viele Isoformen von MHC-I, wodurch tausende verschiedene Peptide gebunden und präsentiert werden können.[4]
Zytosolische Proteine, egal ob körpereigen oder körperfremd, werden im Proteasom in kleine Proteinfragmente (Peptide) zerlegt. Insgesamt sind etwa 20 Peptidasen im Zytosol und im endoplasmatischen Retikulum an der Zerlegung in Peptide beteiligt.[5] Die Peptide haben bestimmte Eigenschaften (basische und hydrophobe Reste der enthaltenen Aminosäuren) und werden gezielt vom Antigenpeptid-Transporter (TAP) oder ein noch unbekanntes Transportprotein in das Endoplasmatische Retikulum (ER) transportiert.[6] Im Inneren des ER wird MHC-I mittels des Adapterproteins Tapasin in die örtliche Nähe des TAP gebracht. Das durch TAP importierte Peptid wird nun unter Beteiligung von TAP, Tapasin, Calreticulin und ERp57 an diesen MHC-I gebunden.[7] Erst dann wird das MHC-I an die Zelloberfläche sezerniert. Der MHC-I präsentiert also entweder körpereigene Antigene (einschließlich Tumorantigene) oder solche, die von Viren stammen. Manche Tumorzellen haben im Rahmen einer Umgehung der Immunantwort Mechanismen zur Vermeidung einer Antigenpräsentation auf MHC-I entwickelt.[8]
Der MHC-I präsentiert das Antigenpeptid an CD8+-T-Lymphozyten (auch zytotoxische T-Zellen, CTL). Bei diesem zellulären Kontakt zwischen einer antigenpräsentierenden Zelle (APC) und einem CD8+-T-Lymphozyten kommt es zur Ausbildung einer Rezeptor-Verdichtung (Immunologische Synapse), die ganz wesentlich zur Aktivierung der CD8+-T-Lymphozyten zum zytotoxischen T-Lymphozyten beiträgt. Ein einmalig aktivierter CTL kann nun seinerseits den MHC-I auf der Oberfläche von Körperzellen erkennen, sobald diese das Peptid (z. B. von einem Virusprotein oder ein tumorassoziiertes Antigen) präsentieren, mit dem der CTL aktiviert wurde. Als Folge wird die virusbefallene oder entartete Zelle von dem CTL getötet, ein Prozess, den man zellvermittelte Zytotoxizität nennt.
Kreuzpräsentation
Die Kreuzpräsentation[9] bezeichnet die Präsentation von Antigenen extrazellulären Ursprungs auf MHC-I gegenüber CD8+-zytotoxischen T-Zellen. Dieser Mechanismus ermöglicht die Präsentation von extrazellulären Antigenen gegenüber zytotoxischen T-Lymphozyten, die sonst nur für intrazelluläre Antigene erfolgt. Darüber hinaus ist die Kreuzpräsentation von großer Bedeutung bei der Aufrechterhaltung der Selbsttoleranz gegenüber körpereigenen Proteinen.[10][11] Die Kreuzpräsentation kommt vorwiegend bei Dendritischen Zellen vor.
CD1
CD1 bezeichnet eine Gruppe MHC-I-ähnlicher Proteine. Im humanen Genom befinden sich fünf Isoformen, die in drei Gruppen eingeteilt werden: Gruppe 1 umfasst CD1a, CD1b und CD1c, während Gruppe 2 CD1d und Gruppe 3 CD1e umfasst.[12] Während MHC I und II auf die Präsentation von Peptiden beschränkt sind, präsentieren CD1-Moleküle hauptsächlich Lipide. Diese können ihren Ursprung in Vesikeln haben, die aus einer Apoptose stammen. Apoptose-Vesikel entstehen z. B. beim Untergang von Makrophagen. Dendritische Zellen nehmen diese Apoptosevesikel auf und präsentieren die darin enthaltenen Lipid-Antigene an T-Zellen in einem drainierenden Lymphknoten. Diesen Weg der Antigenpräsentation nennt man den detour pathway. Bei der Prozessierung der Lipid-Antigene spielt vor allem das Protein Saposin-C (SAP-C) eine wichtige Rolle, da es befähigt ist, Lipide aus einer Biomembran auf CD1 zu übertragen.
CD1d wird von NKT-Zellen gebunden. NKT-Zellen stellen eine Subpopulation von T-Zellen dar. Sie wurden erstmals als T-Zellen mit Markern von NK-Zellen beschrieben (CD161 beim Menschen). Im Gegensatz zu herkömmlichen T-Zellen sezernieren sie große Mengen an Zytokinen des TH1- und TH2-Typs (u. a. Interferon γ, Interleukin-4). Die Oberflächenexpression des CD1d lässt sich durch Cytokine modulieren.
MR1
Ein MHC-I-Molekül aus der Untergruppe Ib namens MR1 bindet nicht Peptide, sondern verschiedene niedermolekulare Verbindungen, darunter Stoffwechselprodukte aus der bakteriellen Herstellung von Riboflavin.[13][14]
MHC-II
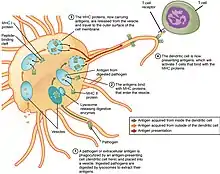
Der MHC-II dient zur Präsentation extrazellulärer Antigene und wird nur von professionellen Antigen-präsentierenden Zellen, z. B. von dendritischen Zellen, exprimiert.[15] Die Peptid-Bindungstasche dieses Komplexes wird – solange er sich im ER befindet – durch eine invariant chain, ebenfalls ein Peptid, blockiert. Erst die Verschmelzung des MHC tragenden Vesikels mit einem Phagolysosom und die Anwesenheit von HLA-DM, sowie das saure pH-Milieu verdrängen die invariant chain aus der Peptid-Bindungstasche und ermöglichen die Bindung eines Peptids extrazellulären Ursprungs. Dort wurde ein Organismus (z. B. ein Bakterium) durch Phagozytose, beispielsweise von einer Dendritischen Zelle aber auch von Makrophagen und B-Zellen, aufgenommen und im Phagolysosom in Fragmente zerlegt. Dies zeigt den völlig anderen Ursprung der Peptid-Fragmente, die auf MHC-II präsentiert werden. Dendritische Zellen präsentieren über MHC-II die Peptidfragmente den CD4+-T-Lymphozyten (T-Zellen). Diese können nun ihrerseits B-Lymphozyten (B-Zellen) zur Antikörperproduktion aktivieren oder Makrophagen dazu veranlassen, die phagozytierten Erreger im Phagolysosom zu vernichten. Alle diese Zell-Zell-Kontakte zeigen den gleichen charakteristischen Aufbau, den man als Immunologische Synapse bezeichnet.
Sowohl bei der Antigenpräsentation über MHC-I als auch über MHC-II muss sichergestellt sein, dass das präsentierte Peptid sich während des Aufenthalts auf der Zellmembran nicht löst und schlimmstenfalls durch ein anderes Fragment ausgetauscht wird. Diese nichtkovalente Bindung zwischen MHC und Peptid wird durch eine langsame on/off-Rate charakterisiert. Das bedeutet einerseits, dass die Bindung im Endoplasmatischen Retikulum sehr lange dauert (on-Rate), allerdings können einmal gebundene Peptide dann auch für sehr lange Zeit (über Tage) sehr stabil präsentiert werden (off-Rate). Eine weitere Sicherheitseinrichtung ist die Stabilität des MHC. Ohne gebundenes Peptid zerfällt der ganze Komplex und wird umgehend von der Zelle per Endozytose internalisiert.
Präsentation gegenüber B-Zellen
Im Gegensatz zu Antigenen für T-Zellen können Antigene für B-Zellen auch Proteine in voller Länge – ohne ein präsentierendes Protein – und in geringerem Umfang auch Kohlenhydrate sein. Daher kommen bei B-Zell-Epitopen nicht nur Sequenzepitope, sondern auch Konformationsepitope vor, denn durch die fehlende Längenbegrenzung der Präsentation kommen Epi- und Paratope vor, die sich über verschiedene nichtzusammenhängende Sequenzabschnitte eines Proteins erstrecken können. Die Antigenpräsentation gegenüber B-Zellen erfolgt durch follikuläre dendritische Zellen in Lymphknoten. Die Antigene werden vom B-Zell-Rezeptor (BCR) gebunden, wodurch eine humorale Immunantwort eingeleitet wird, die zur Produktion von Antikörpern führt.[16][17]
Geschichte
Im Jahr 1903 wurde beobachtet, dass in Inzuchtstämmen von Labormäusen Tumoren aus anderen Inzuchtstämmen nach Transplantation eine Abstoßungsreaktion erfahren.[3] Ab den 1950er Jahren wurde vermehrt zu Abstoßungsreaktionen geforscht. Dies führte zur Entdeckung von MHC durch Peter Gorer.[3] Für ihre Entdeckungen „zur Spezifität der zellulären Immunantwort“ (MHC-Restriktion) erhielten Peter C. Doherty und Rolf Zinkernagel 1996 den Nobelpreis für Physiologie oder Medizin.[18]
Literatur
- C. Janeway et al.: Immunobiology. 6. Auflage ISBN 0-8153-4101-6. Die 5. englische Ausgabe ist online auf den Seiten des NCBI-Bookshelf verfügbar, (online).
- H.-G. Rammensee, J. Bachmann, S. Stevanovic: MHC ligands and peptide motifs. Landes Bioscience, Georgetown, Tx 1997. (International distributor - except North America: Springer Verlag GmbH & Co. KG, Tiergartenstr. 17, D-69121 Heidelberg)
- F. Kotsias, I. Cebrian, A. Alloatti: Antigen processing and presentation. In: International review of cell and molecular biology. Band 348, 2019, S. 69–121, doi:10.1016/bs.ircmb.2019.07.005, PMID 31810556.
Weblinks
Einzelnachweise
- N. Germic, Z. Frangez, S. Yousefi, H. U. Simon: Regulation of the innate immune system by autophagy: monocytes, macrophages, dendritic cells and antigen presentation. In: Cell death and differentiation. Band 26, Nummer 4, 03 2019, S. 715–727, doi:10.1038/s41418-019-0297-6, PMID 30737475, PMC 6460400 (freier Volltext).
- M. Y. Lee, J. W. Jeon, C. Sievers, C. T. Allen: Antigen processing and presentation in cancer immunotherapy. In: Journal for immunotherapy of cancer. Band 8, Nummer 2, 08 2020, S. , doi:10.1136/jitc-2020-001111, PMID 32859742, PMC 7454179 (freier Volltext).
- A. Kelly, J. Trowsdale: Genetics of antigen processing and presentation. In: Immunogenetics. Band 71, Nummer 3, 03 2019, S. 161–170, doi:10.1007/s00251-018-1082-2, PMID 30215098, PMC 6394470 (freier Volltext).
- A. J. Zaitoua, A. Kaur, M. Raghavan: Variations in MHC class I antigen presentation and immunopeptidome selection pathways. In: F1000Research. Band 9, 2020, S. , doi:10.12688/f1000research.26935.1, PMID 33014341, PMC 7525337 (freier Volltext).
- S. Lázaro, D. Gamarra, M. Del Val: Proteolytic enzymes involved in MHC class I antigen processing: A guerrilla army that partners with the proteasome. In: Molecular immunology. Band 68, Nummer 2 Pt A, Dezember 2015, S. 72–76, doi:10.1016/j.molimm.2015.04.014, PMID 26006050.
- J. E. Grotzke, D. Sengupta, Q. Lu, P. Cresswell: The ongoing saga of the mechanism(s) of MHC class I-restricted cross-presentation. In: Current opinion in immunology. Band 46, Juni 2017, S. 89–96, doi:10.1016/j.coi.2017.03.015, PMID 28528219, PMC 5554740 (freier Volltext).
- J. S. Blum, P. A. Wearsch, P. Cresswell: Pathways of antigen processing. In: Annual review of immunology. Band 31, 2013, S. 443–473, doi:10.1146/annurev-immunol-032712-095910, PMID 23298205, PMC 4026165 (freier Volltext).
- K. Dhatchinamoorthy, J. D. Colbert, K. L. Rock: Cancer Immune Evasion Through Loss of MHC Class I Antigen Presentation. In: Frontiers in immunology. Band 12, 2021, S. 636568, doi:10.3389/fimmu.2021.636568, PMID 33767702, PMC 7986854 (freier Volltext).
- J. A. Villadangos, W. R. Heath, F. R. Carbone: Outside looking in: the inner workings of the cross-presentation pathway within dendritic cells. In: Trends in Immunology. Band 28, Nummer 2, Februar 2007, S. 45–47, ISSN 1471-4906. doi:10.1016/j.it.2006.12.008. PMID 17197240.
- C. Kurts u. a.: Constitutive class I-restricted exogenous presentation of self antigens in vivo. In: J Exp Med. Band 184, Nr. 3, 1996, S. 923–930, PMID 9064352.
- J. M. den Haan u. a.: CD8(+) but not CD8(-) dendritic cells cross-prime cytotoxic T cells in vivo. In: J Exp Med. Band 192, Nr. 12, 2000, S. 1685–1696, PMID 11120766.
- A. Shahine: The intricacies of self-lipid antigen presentation by CD1b. In: Molecular immunology. Band 104, 12 2018, S. 27–36, doi:10.1016/j.molimm.2018.09.022, PMID 30399491.
- E. Karamooz, M. J. Harriff, D. M. Lewinsohn: MR1-dependent antigen presentation. In: Seminars in cell & developmental biology. Band 84, 12 2018, S. 58–64, doi:10.1016/j.semcdb.2017.11.028, PMID 30449535, PMC 7061520 (freier Volltext).
- C. Kulicke, E. Karamooz, D. Lewinsohn, M. Harriff: Covering All the Bases: Complementary MR1 Antigen Presentation Pathways Sample Diverse Antigens and Intracellular Compartments. In: Frontiers in immunology. Band 11, 2020, S. 2034, doi:10.3389/fimmu.2020.02034, PMID 32983150, PMC 7492589 (freier Volltext).
- M. Nakayama: Antigen Presentation by MHC-Dressed Cells. In: Frontiers in immunology. Band 5, 2014, S. 672, doi:10.3389/fimmu.2014.00672, PMID 25601867, PMC 4283639 (freier Volltext).
- F. D. Batista, N. E. Harwood: The who, how and where of antigen presentation to B cells. In: Nature Reviews Immunology. Band 9, Nummer 1, Januar 2009, S. 15–27, doi:10.1038/nri2454, PMID 19079135.
- N. E. Harwood, F. D. Batista: Antigen presentation to B cells. In: F1000 biology reports. Band 2, Dezember 2010, S. 87, doi:10.3410/B2-87, PMID 21283653, PMC 3026618 (freier Volltext).
- Peter C. Doherty: The Nobel Prize in Physiology or Medicine 1996. In: nobelprize.org. 15. Oktober 1996, abgerufen am 4. Februar 2022 (englisch).