Humane Adenoviren
Humane Adenoviren (HAdV) sind humanpathogene Viren aus der Familie Adenoviridae und der Gattung Mastadenovirus. Sieben der 45 Arten dieser Gattung (Stand International Committee on Taxonomy of Viruses (ICTV), November 2018) können beim Menschen Erkrankungen auslösen und wurden erstmals 1953 von Wallace P. Rowe und anderen als Krankheitserreger für respiratorische Infektionen nachgewiesen[2] und aus menschlichen Rachenmandeln (Adenoiden) isoliert, wovon sich auch ihr Name ableitet. (Diese Viren und andere Adenoviridae, die in der Kultur in adenoidem Gewebe nekrotische Veränderungen verursachen, wurden früher auch als AD-Agens, von englisch Adenoid Degeneration Agents, genannt.[3]) Derzeit sind über 50 serologisch unterscheidbare Subtypen festgestellt.
| Humane Adenoviren | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
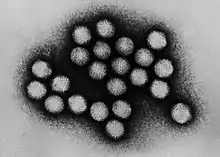
Adenoviren im TEM | ||||||||||||||||||
| Systematik | ||||||||||||||||||
| ||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||
| ||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||
| Human mastadenovirus A–G | ||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||
| HAdV | ||||||||||||||||||
| Links | ||||||||||||||||||
|
Merkmale
Die humanpathogenen Adenoviren gehören zu den unbehüllten doppelsträngigen, linearen DNA-Viren (dsDNA), daher zeichnen sie sich durch hohe Stabilität gegenüber chemischen und physikalischen Einwirkungen aus und tolerieren extreme pH-Werte und alkoholische Desinfektionsmittel. Zehnminütiges Erwärmen auf 56 °C inaktiviert sie hingegen vollständig. Ihr stabiles ikosaedrisches Kapsid und das Fehlen einer empfindlichen Hülle führt zu einer langanhaltenden Infektiosität außerhalb des Wirtskörpers. HAdVs haben einen Durchmesser von rund 70–90 nm. Die Größe des Genoms ist mit 26 bis 45 Kilobasenpaare im mittleren Bereich der DNA-Viren[4].
 Schemazeichnung eines Adenovirus
Schemazeichnung eines Adenovirus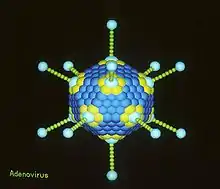 Virion eines Adenovirus
Virion eines Adenovirus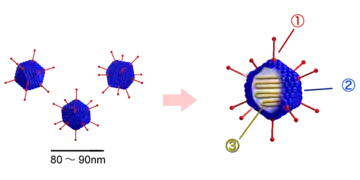 Struktur der Adenoviren
Struktur der Adenoviren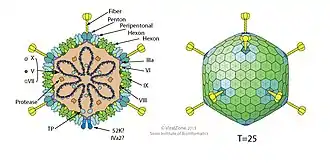 Kapsid eines Adenovirus
Kapsid eines Adenovirus Genom der Adenoviren
Genom der Adenoviren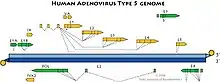 Gemom des Humanen Mastadenovirus C, Serotyp 5
Gemom des Humanen Mastadenovirus C, Serotyp 5
Klinik
Adenoviren verursachen hauptsächlich Erkrankungen der Atemwege. Abhängig vom jeweiligen Serotyp können allerdings auch eine Reihe anderer Erkrankungen hervorgerufen werden, so beispielsweise Gastroenteritis, Keratoconjunctivitis epidemica, Zystitis, Rhinitis, Pharyngitis oder Durchfälle. Die Symptome der Atemwegserkrankung durch Adenoviren reichen von der einfachen Erkältung über die akute Bronchitis bis zur Pneumonie. Bei Patienten mit geschwächtem Immunsystem besteht eine besondere Anfälligkeit für ernsthafte Komplikationen bei Adenovirus-Infektionen, wie zum Beispiel das Acute Respiratory Distress Syndrome (ARDS). Außerdem wird vermutet, dass es einen Zusammenhang zwischen dem Virustyp Ad-36 und Fettleibigkeit beim Menschen gibt.
Epidemiologie
Obwohl die epidemiologischen Merkmale der Adenoviren von Typ zu Typ verschieden sind, werden doch alle durch direkten Kontakt, fäkal-orale und gelegentlich durch Wasserübertragung weitergegeben. Einige Arten verursachen persistente, asymptomatische Infektionen von Hals- und Rachenmandeln oder Magen-Darm-Trakt des Wirtes; eine Ausbreitung kann über Monate oder Jahre erfolgen. Wenige Adenoviren (beispielsweise die Serotypen 1, 2, 5 und 6: Humanes Mastadenovirus C, HAdV-2) sind nachgewiesenermaßen in einigen Zonen der Welt endemisch; die Infektion erfolgt hier in der Regel bereits in der Kindheit. Andere Arten verursachen bei ansonsten sporadischen Infektionen gelegentliche Ausbrüche. So wird zum Beispiel die Keratoconjunctivitis epidemica durch die Serotypen 8, 19 und 37 (Humanes Mastadenovirus D, HAdV-9) ausgelöst. Epidemisch auftretende fieberhafte Erkrankungen mit Konjunktivitis sind oftmals mit Adenoviren assoziiert und treten im Allgemeinen im Umfeld unzureichend chlorierter Schwimmbecken und kleiner Seen auf. Gastroenteritiden werden, insbesondere bei Kindern, durch die Serotypen 40 und 41 (Humanes Mastadenovirus F, HAdV-40) ausgelöst. Bei einigen Serotypen variiert das klinische Spektrum der infektionsassoziierten Erkrankungen abhängig von der Eintrittspforte. So geht beispielsweise eine Infektion mit Serotyp 7 (Humanes Mastadenovirus B, HAdV-3) durch Inhalation mit schwerwiegenden Erkrankungen der unteren Atemwege einher, während eine orale Übertragung des Virus keine beziehungsweise nur eine milde Infektion verursacht.
Diagnose
Antigen-Detektion, PCR-Assay, Virusisolation, Elektronenmikroskopie und Serologie dienen zum Nachweis von Adenovirus-Infektionen. Die Typbestimmung wird in der Regel durch Hämagglutinationshemmungsreaktion oder Neutralisation mit typspezifischen Antisera vorgenommen. Da Adenoviren über einen längeren Zeitraum ausgeschieden werden können, bedeutet der Nachweis des Virus nicht unbedingt auch den Nachweis einer Erkrankung.
Therapie
Die meisten Infektionen verlaufen mild und erfordern keine Therapie oder eine symptomatische Behandlung. Aber auch bei ernsthaften Erkrankungen durch Adenovirus-Infektionen richtet sich die Behandlung mangels virusspezifischer Therapie auf die Symptome und Komplikationen der Infektion.
Prävention
Für die Serotypen 4 und 7 wurden Adenovirusimpfstoffe entwickelt, die allerdings nur zur Prävention schwerer Atemwegsinfektionen bei Rekruten der US-Streitkräfte verfügbar sind. Für die effektive Beschränkung der Ausbreitung Adenovirus-assoziierter Erkrankungen, wie zum Beispiel die epidemische Keratokonjunktivitis, die 2004 die vorübergehende Schließung mehrerer Bundeswehr-Stützpunkte bedingte, ist eine sorgfältige Infektionskontrolle notwendig.
Spätkomplikationen
Diskutiert werden verschiedene Krankheitsbilder, die sich als Spätfolgen einer Adenoviren-Infektion einstellen können, wie beispielsweise die persistierende Bronchiolitis, Gelenkschmerzen, die dilatative Kardiomyopathie oder Hörsturz. Vielfach wurde bislang angenommen, dass auch Adenoviren als Auslöser für Typ-1-Diabetes galten, was sich aber 2013 durch die Ergebnisse der internationalen TEDDY-Studie (The Environmental Determinants of Diabetes in the Young) als relativ unwahrscheinlich herausstellte.[5]
Anwendung von Adenoviren in der Medizin
Humane Adenoviren (vor allem Typ 5 aus der Spezies C) sind ein im Labor weit verbreiteter Vektor. Sie finden vermehrt Einsatz in der Medizin für Gentherapie und Impfstoffe. Beispiele:
- als Dystrophinträger in der Gentherapie der Duchenne-Muskeldystrophie
- in der Krebstherapie zur Hemmung von Tumorwachstum,[6] beispielsweise der künstlich hergestellte HAdv-C5-Abkömmling Ad5-3M.[7]
- als genmanipulierte Vakzine auf Basis von Vektorviren beispielsweise gegen Infektionen mit dem Ebolavirus oder SARS-CoV-2 (COVID-19, siehe Hauptartikel):[8][9]
- AZD1222 (AstraZeneca) – hergestellt auf Basis eines Adenovirus (Erkältungsvirus), dessen Wildtyp normalerweise nur Schimpansen infiziert.
- Ad26.COV2.S (Johnson & Johnson)
- Sputnik V.
Forschung
- Gentherapie bei völliger Farbenblindheit (Achromatopsie) verursacht durch ein defektes Gen CNGA3. Ein Team am Universitätsklinikum Tübingen erprobt seit 2020, wie sich Adenoviren als Vektor für eine funktionsfähige Version des Gens (dann bezeichnet als Gen AAV8.CNGA3) einsetzen lassen. Besonders bei noch jungen Patienten rechnet man sich unter geeigneten Voraussetzungen gute Erfolgschancen aus.[10][11]
- Vor allem sollen adenoviralen Vektoren zukünftig verstärkt in der Krebstherapie eingesetzt werden.
Meldepflicht
Die Meldepflicht von Adenoviren nur aus Konjunktivalabstrich unterliegt in Deutschland dem § 7 IfSG.[12]
Weblinks
- RKI: Adenovirus-Konjunktivitiden. Auf: rki.de, Stand: 21. März 2014; zuletzt abgerufen am 4. Dezember 2015.
- RKI: Adenovirus-Pneumonien. Auf: rki.de, Stand: 21. März 2014; zuletzt abgerufen am 4. Dezember 2015.
- Nationales Konsiliarlaboratorium für Adenoviren (Memento vom 11. Juni 2013 im Internet Archive)
- Medizinische Hochschule Hannover: Nationales Konsiliarlaboratorium für Adenoviren. Auf: mh-hannover.de; zuletzt abgerufen am 4. Dezember 2015.
- Zentrale Kommission für die Biologische Sicherheit beim Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL)
- Adenovirus Research Diskussionsgruppe
- CDC-Warnung zu Adenoviren Typ 14, neue Variante (16. November 2007, 56(45);1181-1184)
Einzelnachweise
- ICTV: ICTV Taxonomy history: Human mastadenovirus C. EC 51, Berlin, Deutschland, Juli 2019/ Email ratification March 2020 (MSL #35).
- Werner Köhler: Infektionskrankheiten. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 667–671; hier: S. 671.
- Hans von Kress (Hrsg.): Müller–Seifert. Taschenbuch der medizinisch-klinischen Diagnostik. 69. Auflage. Bergmann-Verlag, München 1966, S. 1069.
- Andrew J. Davison, Mária Benkő, Balázs Harrach: Genetic content and evolution of adenoviruses. In: Journal of General Virology. Band 84, Nr. 11, 2003, S. 2895–2908, doi:10.1099/vir.0.19497-0 (microbiologyresearch.org [abgerufen am 1. November 2017]).
- H.-S. Lee et al.: Next-generation sequencing for viruses in children with rapid-onset type 1 diabetes. In: Diabetologia. August 2013, Band 56, Nr. 8, S. 1705–1711, doi:10.1007/s00125-013-2924-y, (link.springer.com Volltext als PDF).
- H. Tazawa, S. Kagawa, T. Fujiwara: Advances in adenovirus-mediated p53 cancer gene therapy. In: Expert opinion on biological therapy. Band 13, Nr. 11, November 2013, ISSN 1744-7682, S. 1569–1583, doi:10.1517/14712598.2013.845662, PMID 24107178.
- Svetlana Atasheva, Corey C. Emerson, Jia Yao, Cedrick Young, Phoebe L. Stewart, Dmitry M. Shayakhmetov: Systemic cancer therapy with engineered adenovirus that evades innate immunity. In: Science Translational Medicine. Band 12, Nr. 571, eabc6659 25. November 2020, doi: 10.1126/scitranslmed.abc6659, dazu:
- New Weapon Against Metastatic Cancer: Engineered “Stealth Bomber” Virus. Auf: scitechdaily.com vom 25. November 2020.
- Jana Zeh: Ungefährliches Virus als Träger – Impfstoff aus China zeigt Immunreaktionen. Auf: n-tv.de vom 26. Mai 2020.
- Feng-Cai Zhu, Yu-Hua Li, Xu-Hua Guan, Li-Hua Hou, Wen-Juan Wang, Jing-Xin Li et al.: Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. In: The Lancet. 22. Mai 2020, doi:10.1016/S0140-6736(20)31208-3.
- Nadja Podbregar: Erste Gentherapie gegen völlige Farbenblindheit. Auf: scinexx.de vom 7. Mai 2020.
- M. Dominik Fischer, Stylianos Michalakis, Barbara Wilhelm, et al.: Safety and Vision Outcomes of Subretinal Gene Therapy Targeting Cone Photoreceptors in Achromatopsia. In: JAMA Ophthalmology. Band 138, Nr. 6, 30. April 2020, S. 643-651, doi:10.1001/jamaophthalmol.2020.1032.
- juris: IfsG §7 Auf: scitechdaily.com abgerufen am 11. Dezember 2018.