Corynebacterium diphtheriae
Das Bakterium Corynebacterium diphtheriae ist der Erreger der Diphtherie. Er ist auch als Klebs-Loeffler-Bazillus bekannt, weil es 1884 von Edwin Klebs (1834–1913) und Friedrich Loeffler (1852–1915) entdeckt wurde. Das Bakterium bildet ein Toxin (Diphtherietoxin), was seine Gefährlichkeit ausmacht.
| Corynebacterium diphtheriae | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
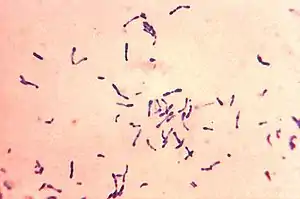
Corynebacterium diphtheriae | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Corynebacterium diphtheriae | ||||||||||||
| (Kruse 1886) Lehmann & Neumann 1896 |
Morphologie
Corynebacterium diphtheriae ist ein grampositives, fakultativ anaerobes, keulenförmiges Bakterium.[1] Die Zellwand enthält Mykolsäuren.[2] Weil es keine Geißeln besitzt, ist es unbeweglich. Die meisten Stämme weisen Pili auf.[2] Es bildet weder Kapsel noch Sporen. Mit der Neisser-Färbung lassen sich charakteristische endständige Auftreibungen aus Polyphosphaten und Calcium darstellen, die als Polkörperchen bezeichnet werden. Unter dem Mikroskop lagern sich die einzelnen Stäbchen (Länge bis zu 5 µm, Dicke 0,8 µm)[1] häufig V- oder Y-förmig an und erinnern so an chinesische Schriftzeichen. Für Studien ist von Bedeutung, dass sich die Corynebacterien anhand der durchschnittlichen Anzahl der Polkörperchen in Biotypen einteilen lassen.
| Biotyp | Anzahl der Polkörperchen |
| Corynebacterium diphtheriae mitis | 5 bis 6 |
| Corynebacterium diphtheriae gravis | 1 bis 2 |
| Corynebacterium diphtheriae intermedius | 3 bis 4 |
Epidemiologie
Weil der Mensch das einzige Erreger-Reservoir ist, lässt sich die Ausbreitung des Bakteriums durch Impfungen sehr gut bekämpfen. Gab es im Zweiten Weltkrieg noch 3 Millionen Erkrankungen, so ist die Inzidenz heute sehr gering. In Mitteleuropa beträgt sie ca. 0,001/100.000/Jahr. In den ersten Jahren nach dem Ende der UdSSR gab es in den Nachfolgestaaten einen massiven Anstieg der Erkrankungen, als die Impfprogramme zusammengebrochen sind. Heute wird C. diphtheriae aber auch dort durch groß angelegte Impfkampagnen wieder erfolgreich bekämpft. In vielen Entwicklungsländern bleibt Diphtherie allerdings weiterhin ein Problem.
Pathogenese
Die Übertragung erfolgt durch engen Kontakt (face-to-face) mit infizierten Personen, meistens durch Tröpfchen, seltener auch über kontaminierte Gegenstände. Der Erreger gelangt über die Schleimhaut, Konjunktiven oder Wunden in den Körper und vermehrt sich dort.[3] Das Diphtherietoxin, das allerdings nicht von allen Stämmen von C. diphtheriae gebildet wird, schädigt lokal die Epithelzellen, sodass sich eine Pseudomembran im Nasen-Rachen-Raum bildet. Dieser dicke, graue Belag besteht aus einem Fibrinnetz, in das abgestorbene Zellbestandteile, die Bakterien sowie Leukozyten eingelagert sind.[3] Das Gewebe unter der Pseudomembran ist nekrotisch. Wenn sich die Pseudomembran auf den Kehlkopf ausbreitet, kann es zu massiver Atemnot und letztendlich zum Tod kommen. Das Gift wirkt außerdem im gesamten Körper und schädigt vor allen das Herz, die Nieren, die Nebennieren, motorische Nerven und die Leber. Unabhängig von der Wirkung des Giftes sind auch Hautinfektionen und Endokarditis beobachtet worden.
Diphtherietoxin
Die genetische Information für das Toxin tox+ befindet sich nicht von vornherein im Genom von C. diphtheriae, sondern in einem Virus, dem so genannten Prophagen beta (siehe Corynebacterium-Phage beta).[4][5] Das Gen wird durch Transduktion in das Bakteriengenom übertragen.[2] Die „Zusammenarbeit“ dieser Gene ist so eng, dass das Gen dtxR, das tox+ reguliert, auf dem Bakteriengenom zu finden ist. In Anwesenheit von Eisen schaltet dtxR die Produktion des Giftes ab.[3]
Ähnlich wie andere AB-Bakterientoxine setzt sich das kugelförmige Diphtherietoxin aus einem größeren B- und einem kleineren A-Teil zusammen. Der B-Teil enthält eine Bindungsstelle, mit der er sich an ein Rezeptor (HB-EGF-precursor – heparin-binding epidermal growth factor, dt.: heparinbindender Vorläufer des epidermalen Wachstumsfaktors EGF), das häufig an menschlichen Zellen zu finden ist, bindet. Der HB-EGF-Vorläufer liegt besonders zahlreich in Zellmembranen von Herz-, Nerven- oder Nierenzellen vor, was erklärt, warum gerade diese Zellen bevorzugt das Toxin aufnehmen.[6] Das Gift wird dann in einer endozytischen Vakuole in die Zelle aufgenommen, wo sich das Toxin bei einem pH-Wert von 5 auffaltet. Infolgedessen kommen hydrophobe Anteile zum Vorschein, die in die Membran der Vakuole inserieren.[6] Der A-Teil des Toxins wird zum Cytoplasma des Zelle exponiert und abspalten. Auf dem A-Teil befindet sich ein Enzym, das ein ADP-Ribosyl auf den Elongationsfaktor eEF2 von NAD+ überträgt. Dadurch ist der Elongationsfaktor inhibiert, es kann keine Proteinbiosynthese mehr stattfinden und letztendlich stirbt die Zelle. Das Diphtherietoxin ist dabei so potent, dass ein Molekül ausreicht, um eine Zelle zu töten.[6]
Der Nachweis erfolgt mittels Real-Time-PCR, zur Bestätigung anschließend via Elek-Test.[7]
Kultivierung
Im Labor kann C. diphtheriae bei 37 °C auf Blutagar und auf serumhaltige Kulturmedien bzw. Hoyle-Agar angezüchtet werden (Normalatmosphäre mit 10 % CO2-Zusatz).[7] Ein Nährmedium aus Löffler-Serum ermöglicht gutes Wachstum und bildet die charakteristische Morphologie.
Sichtbare Kolonien bilden sich bei Temperaturen von 15–40 °C nach 18–24 Stunden. Da Tellurit von den Bakterien zu Tellur reduziert und intrazellulär angereichert wird, färben tellurithaltige Medien die Kolonien mit der Zeit schwarz.[7] Konzentrationen über 100 mg/ml wirken dabei auf andere Bakterien aus der Rachenflora hemmend, so dass C. diphtheriae selektiv identifiziert werden kann; Rückschlüsse auf die Toxinbildung können jedoch nicht getroffen werden.
Biochemische Untersuchungen ermöglichen eine Speziesdifferenzierung, alternativ geschieht dies via MALDI-TOF.[7]
Meldepflicht
In Deutschland ist der Verdacht einer Erkrankung, die Erkrankung Diphtherie und der Tod daran sowie namentlich meldepflichtig nach § 6. Ebenso ist der direkte oder indirekte Nachweis von Toxin-bildenden Corynebacteria namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes, soweit der Nachweis auf eine akute Infektion hinweist.
In Österreich ist Diphtherie eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Erkrankungs- und Todesfälle.
In der Schweiz ist der klinische Verdacht der Krankheit Diphtherie und die Veranlassung einer erregerspezifischen Labordiagnostik und ein positiver laboranalytischer Befund (oder ein negativer Befund bei Test auf Toxin-Gen) zum Erreger Corynebacterium diphtheriae (und anderer toxinbildende Corynebakterien) meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Literatur
- R. R. MacGregor: Corynebacterium diphtheriae. In: Mandell, Douglas and Bennett’s Principles and Practice of Infectious Diseases. 6. Auflage. 2005.
- Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 309 ff.
Weblinks
Einzelnachweise
- Friedrich Hofmann: Diphtherie. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 148 ff.
- Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 309, doi:10.1007/978-3-662-48678-8_37.
- Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 310, doi:10.1007/978-3-662-48678-8_37.
- SIB: Viral exotoxin. Expasy: ViralZone
- SIB: Modulation of host virulence by virus. Expasy: ViralZone
- Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 312, doi:10.1007/978-3-662-48678-8_37.
- Marlies Höck und Helmut Hahn: Korynebakterien. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E. Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 313, doi:10.1007/978-3-662-48678-8_37.