RNA-Impfstoff
Ein RNA-Impfstoff oder mRNA-Impfstoff (veraltet auch RNS-Impfstoff) ist ein Impfstoff, dessen Wirkmechanismus auf Ribonukleinsäure (als Wirkstoff meistens Messenger-RNA, deutsch Boten-RNS) oder modRNA[2] beruht. RNA-Impfstoffe gehören zu den genetischen Impfstoffen, da aus der RNA ein Protein hergestellt wird, das eine Immunreaktion auslöst. RNA-Impfstoffe können gegen alle proteinbasierten Antigene entwickelt werden, da nach der Impfung das Antigen mittels Translation im Körper des Geimpften nach der RNA-Vorlage gebildet wird. Die Proteine können beispielsweise von Viren, Bakterien oder Tumoren (Tumorantigen) abgeleitet sein.
Durch die Verpackung der RNA in Lipid-Nanopartikel wird die Aufnahme in die Zellen der geimpften Person erleichtert.[3][4] Nachdem diese in die Zellflüssigkeit einer Zelle des Patienten gelangt ist, setzt sie eine Translation in Gang, welche erst das gewünschte Protein und danach die dagegen gerichtete Immunreaktion erzeugt; die RNA des Impfstoffes selbst erzeugt jedoch keine adaptive Immunantwort und wird nach kurzer Zeit in der Zelle wieder abgebaut.
Am 2. Dezember 2020 wurde während der COVID-19-Pandemie weltweit erstmals ein mRNA-Impfstoff durch eine staatliche Regulierungsbehörde zugelassen: Die britische Zulassungsbehörde MHRA verkündete die Notzulassung für den von den Pharmaunternehmen BioNTech und Pfizer entwickelten SARS-CoV-2-Impfstoff Tozinameran (Handelsname Comirnaty).[5][6] Es folgten Zulassungen in weiteren Ländern (siehe zugelassene Impfstoffe).
Wirksamkeit und Sicherheit von RNA-Impfstoffen werden seit 2002 in klinischen Studien am Menschen, auch in anderen Anwendungsgebieten als COVID-19 (verschiedene Krebsarten und Infektionskrankheiten), untersucht. Es ist eine große Zahl präklinischer Daten verfügbar.[7][8][9][10][11][6]
Geschichte
Vorarbeit
mRNA wurde erstmals 1961 von Sydney Brenner, François Jacob und Matthew Meselson als Überträger der Information für die Biosynthese eines Proteins beschrieben.[12][13] 1971 injizierten Charles Daniel Lane et al. erfolgreich RNA, welche aus Retikulozyten von Kaninchen präpariert wurden, in Froscheizellen.[14] Das Experiment zeigte, dass die Translationsmaschinere der Froscheizelle mRNA von einem völlig anderen Zelltyp von einer anderen Spezies akzeptiert.[14] Im Jahr 1978 zeigte Giorgos Dimitriadis, dass mRNA in Liposomen von Zellen aufgenommen werden können.[15][13] Im selben Jahr gelang es Marc Ostro und weiteren Kollegen mRNA in menschliche Zellen zu transportieren.[16] Das erste Einschleusen von mRNA in Zellen mithilfe von kationischen Lipiden als Transfektionsreagenz wurde 1989 von Robert W. Malone vom Salk Institute for Biological Studies in Kalifornien und einigen Kollegen, darunter Philip Felgner, beschrieben.[17][18] Ein Jahr später wurde von J. Wolff, Philip Felgner und Kollegen die Aufnahme von in vitro erzeugter RNA in Zellen ohne Verwendung eines Transfektionsreagenz gezeigt.[19][18] Das erste RNA-basierte Arzneimittel war Patisiran, das 2018 von der EMA in Europa und von der FDA in den USA zugelassen wurde.[20]
mRNA-Impfstoff-Versuche bei Tieren
In den Jahren 1993 und 1994 wurde RNA erstmals von Frédéric Martinon, Pierre Meulien und Kollegen[21][18] und etwas später von X. Zhou, Peter Liljeström und Kollegen zur Impfung bei Mäusen beschrieben.[22][18] Martinon konnte zeigen, dass durch die Impfung mit einem RNA-Impfstoff eine zelluläre Immunantwort induziert wurde.[18] Im Jahr 1995 beschrieben Robert Conry und Kollegen, dass nach Impfung mit einem RNA-Impfstoff auch eine humorale Immunantwort hervorgerufen wurde.[23][18] In den folgenden Jahren wurden verschiedene Applikationsformen untersucht, bei denen die RNA per intramuskulärer, subkutaner, intradermaler, intravenöser, intranodaler, intrasplenaler Injektion (teilweise mit Protamin-Transfektion oder Lipofektion) sowie per Genkanone oder Mikronadelanordnungen in den Organismus eingebracht wurde.[24] Auch wurden RNA-Impfstoffe als Impfstoffe gegen Infektionserreger, als Krebsimpfstoffe und zur Hyposensibilisierung bei manchen Allergien untersucht.[24]
mRNA-Impfstoffe für den Menschen
Am Menschen wurden RNA-Impfstoffe erstmals in den Jahren 2002 bis 2003 in klinischen Studien getestet.[25][18] 2005 publizierten Katalin Karikó und Drew Weissman die Verwendung von Nukleosid-modifizierter RNA, ohne dass die angeborene Immunantwort (genauer: Toll-like-Rezeptoren 3, 7, 8 sowie MDA-5, NLRP3, RIG-I und NOD2)[24] durch die RNA selbst übermäßig aktiviert wird.[26] RNA-Impfstoffe wurden in den Folgejahren sowohl gegen Pathogene als auch zur Verwendung als Krebsimpfstoff untersucht und beschrieben.[7][27] Im Jahr 2017 beschloss die Weltgesundheitsorganisation, RNA-Impfstoffe als neue Wirkstoffklasse aufzunehmen.[28] Diese Technologie bildete die Grundlage für die Entwicklung mRNA-basierter SARS-CoV-2-Impfstoffe.
Die Covid-19-Pandemie führte zum Durchbruch der RNA-Impfstoffe, wobei jene von Biontech (mit den leitenden Wissenschaftlern Uğur Şahin und Özlem Türeci mit Katalin Karikó als Beraterin) und Moderna (mit den leitenden Wissenschaftlern Derrick Rossi und Tal Zaks) noch 2020 in den USA für den Notfallgebrauch genehmigt wurden (EUA, „Notfallzulassung“). Ebenfalls früh gestartet waren die Arbeiten bei CureVac (mit Steve Pascolo und Ingmar Hoerr als leitenden Wissenschaftlern), der Impfstoff kam aber im Vergleich zur Konkurrenz zu spät und war auch weniger effektiv. Bei allen beteiligten Firmen waren Vorarbeiten erfolgt, die zunächst andere Ziele hatten, meist die Entwicklung von Krebstherapien. Im Jahr 2020 wurde Tozinameran von Biontech/Pfizer der weltweit erste RNA-Impfstoff, der die Marktreife erreichte und zur Impfung von Menschen zugelassen wurde,[29][30][6] gefolgt von mRNA-1273 von Moderna.
Katalin Karikó, Drew Weissman, Philip Felgner, Uğur Şahin, Özlem Türeci und Derrick Rossi erhielten für RNA-Impfstoffe 2021 den Prinzessin-von-Asturien-Preis und Karikó und Weissman für 2022 den Breakthrough Prize in Life Sciences und den Lasker~DeBakey Clinical Medical Research Award. Ebenfalls 2021 erhielt das Biontech-Team Katalin Karikó, Özlem Türeci und Uğur Şahin den Paul-Ehrlich-und-Ludwig-Darmstaedter-Preis und (mit Christoph Huber) den Deutschen Zukunftspreis.
Wirkungsweise
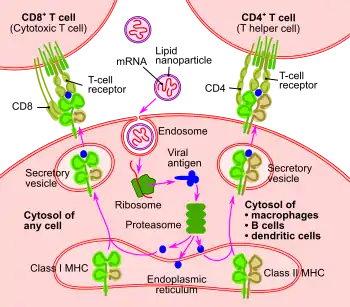
Beim Einsatz von RNA-Impfstoffen zur Immunisierung gegen virale Infektionskrankheiten wird (anders als bei Totimpfstoffen, die aus nicht mehr reproduktionsfähigem Krankheitserregern bzw. deren Bruchstücke bestehen) nur die mRNA der Antigene mit einem Hilfsstoff (Transfektionsreagenz) in den Organismus eingebracht. Wenn die mRNA-transfizierten Zellen vorübergehend diese Komponente des zu bekämpfenden Virus nach Vorlage der RNA herstellen und präsentieren, lernt die Immunabwehr der Geimpften, das Antigen spezifisch zu erkennen und im Falle einer tatsächlichen Infektion auch vor dem natürlichen Erreger zu schützen. In der Folge wird der Wirt immun.
mRNA ist zu groß (104 bis 106 Da), um durch einfache Diffusion durch die Zellmembran zu gelangen.[31] Zudem ist sie negativ geladen, so dass diese nicht die anionische Doppellipidschicht passieren kann. Nackte mRNA wäre auch ein Ziel diverser Nukleasen und des angeborenen Immunsystems. Daher bedarf es Transfektionsreagenzien, damit die mRNA Zellen transfizieren kann, ohne dass dies Toxizitäten oder eine ungewollte Immunogenität verursacht. Es stehen hierfür Nanopartikel zur Verfügung, die größtenteils entweder auf Lipiden oder Polymeren basieren.[31]
Die Aufnahme des RNA-Lipid-Nanopartikels in die Zelle erfolgt über einen der Wege der Endozytose. Bei der Endozytose wird ein Endosom von der Zelloberfläche eingeschnürt. Das Innere der Endosomen mit dem RNA-Lipid-Nanopartikel wird anschließend angesäuert. Dadurch entstehen am Transfektionsreagenz positive Ladungen, die wiederum negativ geladene Moleküle und Wasser binden. In Folge schwillt vermutlich das Endosom an und reißt stellenweise vorübergehend (Protonenschwamm-Hypothese).[32] Dabei wird das RNA-Lipid-Nanopartikel ins Zytosol freigesetzt.[32] Am Ribosom wird im Zuge der Translation aus der RNA ein Protein hergestellt, das als Antigen dient.
Nach der Herstellung des Antigens im Zytosol der Zelle (ribosomale Proteinbiosynthese der applizierten mRNA) erfolgt zunächst eine Zerlegung durch proteinabbauende Enzyme (Proteasen; hier konkret durch das Proteasom) und anschließend ein Export der Proteinfragmente (Peptide) ins Endoplasmatische Retikulum über den Antigenpeptid-Transporter. Dort binden die Peptide an MHC-Komplexe und werden an die Zelloberfläche sezerniert zur Präsentation der Epitope des Antigens. Die Präsentation am Haupthistokompatibilitätskomplex MHC I erzeugt eine zelluläre Immunantwort, bei der zytotoxische T-Zellen gegen das Spike-Glykoprotein gebildet werden. Auf dem MHC II hingegen werden nur Epitope von Antigenen präsentiert, die durch Endozytose von außerhalb der Zelle aufgenommen und durch Proteasen zerlegt worden sind. Die MHC-II-Präsentation der Epitope erzeugt eine humorale Immunantwort.[33] Wenn als Antigen ein Membranprotein verwendet wird, erfolgt zusätzlich eine Präsentation des Membranproteins in voller Länge auf der Zelloberfläche, wodurch Antikörper daran binden können.
Je langsamer eine mRNA in der Zelle abgebaut wird, desto häufiger kann sie translatiert werden und desto mehr Protein entsteht aus dieser mRNA-Vorlage. Die biologische Halbwertszeit der mRNA kann sehr verschieden sein und liegt je nach mRNA zwischen Minuten (beispielsweise bei vielen regulatorischen Proteinen) und einigen Stunden.[34] Eine Cap-Struktur am 5'-Ende der mRNA und eine untranslatierte Region (UTR) jeweils am 5'- und 3'-Ende erhöht die biologische Halbwertszeit der mRNA, bevor sie durch zytosolische Exoribonukleasen abgebaut wird, wodurch mehr Antigen gebildet wird.[35] Außerdem kann die Struktur der mRNA durch den Einbau von ungewöhnlichen Nukleosiden so modifiziert werden, dass sie nicht vom angeborenen Immunsystem erkannt wird. Eine derartige nukleosid-modifizierte mRNA (modRNA) wird zum Beispiel in RNA-basierten SARS-CoV-2-Impfstoffen verwendet. Zur Verstärkung der Immunantwort können Adjuvantien verwendet werden.[36] RNA-Impfstoffe (Vakzine) sind wirksamer, wenn sie in eine kationische Nanoemulsion (Emulsionen mit einem Tröpfchendurchmesser unterhalb von 100 Nanometern) formuliert sind und ein Adjuvans wie MF59 oder TriMix (mRNA von CD40L, CD70 und caTLR-4) enthalten.
Eine begrenzte Verlängerung der biologischen Halbwertszeit und somit eine Erhöhung der Antigenerzeugung wird durch replizierbare mRNA (self-amplifying mRNA, samRNA) erreicht, die für das Antigen und zusätzlich für eine RNA-Replikase codiert: also für ein Enzym, das diese RNA kopiert. Die samRNA fungiert als Sensor und Stimulator für ihre eigene Genexpression, die eine aktive Rolle bei der spezifischen positiven Rückkopplungsregulation der Genexpression spielt.[35][37][38] Dadurch kann die zur Impfung verwendete RNA-Menge bei gleicher Impfwirkung gemindert werden,[39] da 50 ng RNA für eine Impfwirkung als ausreichend beschrieben wurden.[40] Da samRNA deutlich größer als eine mRNA ist, die nur für das Antigen kodiert, dürfte der Mechanismus der Aufnahme in die Zelle ein anderer sein.[41] Es gibt bislang keine zugelassenen RNA-Impfstoffe auf samRNA-Basis.[42]
Herstellung
Die Herstellung erfolgt meistens per In-vitro-Transkription. Oftmals wird Nukleosid-modifizierte mRNA hergestellt, um überschießende Impfreaktionen zu vermeiden.[43] Die RNA trägt eine Cap-Struktur und einen Poly-A-Schwanz zur Verlangsamung des Abbaus der RNA.[44] Es werden zusätzlich in der RNA bestimmte 5' und 3'-UTR verwendet, um den Abbau der RNA weiter zu verlangsamen.[45][46] Qualitätskriterien der erzeugten RNA sind unter anderem Stabilität, Unversehrtheit, Identität, Reinheit und Homogenität.[35]
Um die RNA in die Zelle einzuschleusen, wird sie mit einem Transfektionsreagenz injiziert,[35] elektroporiert,[47] per Genkanone verabreicht,[40] oder die Impfung erfolgt ex vivo mit anschließendem adoptivem Zelltransfer.[48] Als Transfektionsreagenz werden basische Lipide in Liposomen[49] (damit entstehen Lipid-Nanopartikel, LNP),[50][51] zellpenetrierende Peptide,[52] Proteine, Protamin,[53] kationische Polymere oder Gold-Nanopartikel mit einem Durchmesser von etwa 80 nm verwendet (AuNPs).[51][35][54]
Beim RNA-Impfstoff mRNA-1273 wird als kationisches Lipid SM-102 verwendet, während bei Tozinameran ALC-0315 zum Einsatz kommt.[55] Daneben werden noch neutrale Lipide (Helferlipide) verwendet, um die Liposomen zu stabilisieren (bei Tozinameran u. a. ALC-0159), und Puffersubstanzen, um den pH-Wert zu stabilisieren.[55] Durch die positiv geladenen Nanopartikel wird RNA nach Injektion in vivo von Zellen aufgenommen, daneben wird der Abbau der RNA durch Transfektionsreagenzien verlangsamt.[56] Die Aufnahme der RNA in die Zelle erfolgt bei der Transfektion durch rezeptorvermittelte Endozytose.[57][58] Es gibt zumindest bei DNA (bei der die gleichen Methoden wie bei RNA angewendet werden und die über die gleichen Mechanismen von Zellen aufgenommen wird) allerdings nur eine schwache Korrelation zwischen der Aufnahme in Zellkultur und in vivo[59] und keine Korrelation zwischen der Aufnahme in Zellkultur und der Impfwirkung.[60] Das bedeutet, dass die Impfwirkung frühestens ab der Phase der präklinischen Studien abgeschätzt werden kann, da erst dann eine Impfwirkung gemessen werden kann. Beide Impfstoffe enthalten Saccharose als Frostschutzmittel,[55] um entstehende Eiskristalle beim Einfrieren klein zu halten und so Scherkräfte durch größere Eiskristalle zu vermeiden, welche die RNA fragmentieren können. Die regulatorischen Anforderungen der Europäischen Union zur Herstellung von RNA-Impfstoffen wurden 2017 publiziert.[61]
Hürden bei der Impfstoffentwicklung
Ein Problem bei der Entwicklung von RNA-Impfstoffen ist, dass die RNA über die Aktivierung der angeborenen Immunantwort eine übermäßige Immunreaktion auslösen kann.[35][62] Die Aktivierung der angeborenen Immunantwort erfolgt durch Bindung der RNA an Toll-like-Rezeptoren (darunter TLR 7[63]), RIG-I und Proteinkinase R.[64] Um eine übermäßige Immunreaktion gegen die RNA zu minimieren, sollen die mRNA-Impfstoffsequenzen diejenigen nachahmen, die von Säugetierzellen produziert werden.[65] Daneben kann eine Immunreaktion gegen die RNA durch modifizierte Nukleoside (Pseudouridin,[66] N1-Methylpseudouridin,[67] 5-Methylcytidin,[66] 2′-O-methylierte Nukleoside)[62][68][69] oder durch Codon-Optimierung und Verwendung bestimmter untranslatierter Regionen (einem Randbereich der mRNA, der nicht für das eigentliche Protein codiert)[64][70] gemindert werden, wodurch auch ein Abbau der RNA verlangsamt wird. Weiterhin können abgebrochene Transkripte und RNA-Interferenz gegen doppelsträngige Bruchstücke der mRNA, die zum vorzeitigen Abbau der mRNA führt, die Wirkdauer mindern.[35] Daher ist eine mehrstufige RNA-Reinigung notwendig, um möglichst saubere, einzelsträngige mRNA in gewünschter Länge zu erhalten.[35][71][70] Unerwünschte doppelsträngige RNA kann vergleichsweise kostengünstig durch Adsorption an Cellulose entfernt werden.[72] Bestimmte Aufreinigungstechniken etwa durch Fast Protein Liquid Chromatography (FPLC) steigern die Translation und somit die Wirksamkeit.[73] Der größte Anteil an RNA, der in Endosomen von Zellen aufgenommen wird, kommt vermutlich nicht im Zytosol an und kann dort nicht wirken, sondern wird abgebaut. Daher soll die Transfektionseffizienz gesteigert werden, um weniger RNA in einer Impfdosis verwenden zu müssen.[74] Extrazelluläre RNA ist als prokoagulatorischer und permeabilitätsteigernder Faktor bekannt. Eine gesteigerte Permeabilität von Endothelzellen kann zu Ödemen führen, und eine Anregung der Blutgerinnung birgt die Gefahr der Thrombenbildung.[75]
Vergleich mit anderen Impfstofftypen
Im Gegensatz zu DNA-Impfstoffen werden RNA-Impfstoffe nicht in den Zellkern transportiert und sind nicht vom Import in den Zellkern und von der Transkription abhängig.[35] Es besteht im Gegensatz zu DNA-Impfstoffen auch keine Gefahr einer Insertion in die genomische DNA[41] oder Hinweise auf Erbgutschädigungen, hierfür wären zwei zusätzliche Enzyme nötig, die in menschlichen Zellen nicht vorkommen.[76] mRNA hat eine vergleichsweise kurze biologische Halbwertszeit.[77] Ein dauerhafter Verbleib in der Zelle ist damit ausgeschlossen,[35] zumal diese im Zuge der Immunantwort durch cytotoxische T-Zellen ohnehin zerstört wird. RNA ist im Vergleich zu DNA relativ empfindlich für abbauende Enzyme (bei RNA sind das RNasen), die ubiquitär vorkommen.[78] RNA ist kostenintensiver herzustellen als Plasmid-DNA.[24] Bei viralen Vektoren, DNA-, RNA- und Untereinheitenimpfstoffen wird kein vollständiger Erreger zur Produktion verwendet, wodurch für die Produktionsstätte keine zusätzliche Zulassung notwendig ist, in Deutschland nach dem Infektionsschutzgesetz und der Biostoffverordnung. Die Herstellung von RNA-Impfstoffen per In-vitro-Transkription erfolgt zudem ohne eine Verwendung lebender Zellen (zellfreie Produktion).[73]
Im Gegensatz zu attenuierten (aus in ihrer Wirkung abgeschwächten Erregern bestehenden) Impfstoffen kann keine Reversion (Rückmutation) zu einem Pathogen auftreten, da nur einzelne Bestandteile eines Pathogens verwendet werden.[35] Des Weiteren können RNA-Impfstoffe vergleichsweise schnell in großen Mengen produziert werden und die Produktion gilt als relativ kostengünstig.[79][80] Im Vergleich zu viralen Vektoren erzeugt RNA (wie DNA) keine Vektorimmunität,[24] da RNA-Lipid-Nanopartikel keine Proteine aufweisen, die sonst bei viralen Vektoren und ihrer erneuten Anwendung zu einem vorzeitigen Abbau eines Anteils der viralen Vektoren führen. Im Gegensatz zu älteren Impfstofftypen wie Totimpfstoffe, Untereinheitenimpfstoffe und Peptidimpfstoffe wird bei genetischen Impfstoffen (DNA-Impfstoffe, RNA-Impfstoffe oder virale Vektorimpfstoffe) das Antigen im Zytosol erzeugt, wodurch nicht nur eine humorale, sondern auch eine zelluläre Immunantwort ausgelöst wird.
Die im Vergleich zu anderen Impfstofftypen stärkeren Nebenwirkungen der RNA-Impfstoffe werden im Wesentlichen auf Verunreinigungen zurückgeführt, die aus dem Herstellungsverfahren herrühren und die man vermutlich nicht ganz verhindern kann. Insoweit besteht das Ziel darin, diese immer weiter zu verringern, um die Impfstoffe verträglicher zu machen.[81]
Klinische Studien
COVID-19
→ Für eine Darstellung aller SARS-CoV-2-Impfstoff-Kandidaten, auch derjenigen, die keine RNA-Impfstoffe sind, siehe SARS-CoV-2-Impfstoffkandidaten.
Verschiedene RNA-Impfstoffe sind Impfstoffkandidaten bei der Entwicklung eines Coronavirusimpfstoffs, speziell seit Ende 2019 eines SARS-CoV-2-Impfstoffes. Als eine Herausforderung wird die Logistik für diese Art Impfstoffe angesehen, die teils tiefgekühlt bei Temperaturen unterhalb von −70 °C gelagert und transportiert werden müssen.[82][83]
BNT162
Am 22. April 2020 wurden vom Paul-Ehrlich-Institut und der Ethik-Kommission der Landesärztekammer Baden-Württemberg erstmals in Deutschland eine klinische Studie für einen solchen Impfstoff genehmigt, es handelt sich um den Kandidaten BNT162 der deutschen Biotech-Firma Biontech und ihres US-Partners Pfizer.[84][85] Die mRNA-Formate sind die Uridin-haltige mRNA (uRNA), nukleosid-modifizierte mRNA (modRNA) und selbstamplifizierende mRNA (saRNA) mit hoher Immunogenität.[86] Als mRNA-Transfektionsreagenz werden Lipidnanopartikel (LNPs) verwendet. Diese LNPs sind nach Injektion stabil und können zusammen mit der mRNA in Zellen eindringen.[87] Sie erzeugen eine starke Antikörperantwort und starke T-Zell-Antwort (CD8, CD4).
- Phase-I-Studie
Am 29. April 2020 begann die klinische Prüfung mit einer Phase-I-Studie bei Biontech. Von 20 Impfstoffvarianten wurden die vier meistversprechenden Kandidaten ausgesucht. Sie tragen die Unterbezeichnungen a1, b1, b2, c2. Sie sollten weiter an Studienteilnehmern getestet werden – auch an Risikopatienten. Vorgesehen waren die Altersgruppen 18 bis 55 Jahre, 65 bis 85 Jahre und 18 bis 85 Jahre. Geplant waren die Phasen wie folgt; Phase I: Identifizierung der bevorzugten Impfstoffkandidaten, Dosisstufe (n), Anzahl der Dosen und Verabreichungsplan (wobei die ersten 15 Teilnehmer bei jeder Dosisstufe jedes Impfstoffkandidaten eine Sentinel-Kohorte umfassen); Phase II: eine erweiterte Kohortenstufe; und Phase III; ein Endkandidat-/Dosis-Großstadium.[88]
- BNT162b1
Im Juli 2020 wurden die vorläufigen klinischen Daten für den Kandidaten für die nukleosid-modifizierte Messenger-RNA (modRNA) mit der Bezeichnung BNT162b1, der ein optimiertes Antigen der SARS-CoV-2-Rezeptorbindungsdomäne (RBD) codiert, auf einem Online-Preprint-Server veröffentlicht.[89]
- BNT162b2
Eine weitere Variante, BNT162b2, wurde nach vielversprechenden Ergebnissen für die weitere Überprüfung mit Phase-II- und Phase-III-Studien ausgewählt. Nach Abschluss der Studien im November 2020 wurde eine Wirksamkeit von 95 % ermittelt.[90] Anfang Dezember genehmigte die britische Arzneimittelbehörde MHRA die Lieferung des Impfstoffs, für dessen Wirkstoff der internationale Freiname Tozinameran vorgeschlagen wurde, zur Notfallversorgung („temporäre Notfallzulassung“); es folgten weitere Notfall- bzw. vorläufige Zulassungen in anderen Ländern, unter anderem Kanada und den USA. In der EU erfolgte am 21. Dezember eine bedingte Marktzulassung unter dem Handelsnamen Comirnaty. In zahlreichen weiteren Ländern befindet sich der Impfstoff im Zulassungsprozess (siehe Tozinameran: Zulassung).
mRNA-1273
mRNA-1273 ist ein Impfstoff der Firma Moderna. Eine Phase-3-Studie mit 30.000 Probanden und Dosierungen zwischen 25 µg und 100 µg wurde ab Juli 2020 in den USA durchgeführt.[91] In der EU wurde im Januar 2021 die Zulassung erteilt.[92]
CVnCoV
CVnCoV ist ein Impfstoffkandidat von Curevac, der seit Mitte Dezember 2020 in einer kombinierten Phase-2b/3-Studie mit mehr als 36.500 Probanden erprobt wird.[93][94]
COVAC1
Das Imperial College London begann im Juni 2020 mit der Studie zu einer Lipidnanopartikelformulierung (lipid nanoparticle, LNP) von selbstamplifizierender RNA (saRNA) (LNP-nCoVsaRNA), die unter der Bezeichnung COVAC1 läuft.[95] Unterstützt wird die Studie unter anderem vom Medical Research Council und dem National Institute for Health Research.
Weitere Impfstoffe
Weiterhin werden RNA-Impfstoffe in klinischen Studien zur Verwendung als Krebsimpfstoff[96][97][63][98] sowie als Influenzaimpfstoff[99] und als Tollwutimpfstoff (CV7201) untersucht.[100]
Influenza-Impfstoff
Influenzaimpfstoffe aus mRNA werden in der Europäischen Union beispielsweise durch CORDIS, einen Forschungs- und Entwicklungsinformationsdienst der Europäischen Gemeinschaft,[101] und durch das UniVax-Projekt, mit elf Einrichtungen aus sieben EU-Staaten, unterstützt.[102] Über RNA-Impfstoffe soll einerseits bewirkt werden, dass das Influenzavirus im Körper der geimpften Personen keine vermehrungsfähigen Abkömmlinge mehr produziert. Zum andern soll das Immunsystem auf zukünftige Varianten des Influenzavirus besser vorbereitet werden.[103]
Tollwut-Impfstoff
Eines der neuen Konzepte für eine Tollwut-Impfung ist die Verwendung von mRNA bei der Codierung des Haupt-Tollwutvirus-Antigens, des Hüllglykoproteins (RABV-G). Präklinische Studien mit RABV-G-mRNA, die in Lipidnanopartikeln eingekapselt war, zeigen eine verbesserte Reaktion sowohl bei Mäusen als auch bei nichtmenschlichen Primaten. Die Ergebnisse werden derzeit in klinischen Studien am Menschen weiterverfolgt.[104]
Krebs-Impfstoff
Die Entwicklung von auf stabilisierter RNA-basierten Impfstoffen zur klinischen Anwendung bei Krebserkrankungen befindet sich derzeit in den frühen Phasen der klinischen Prüfung. Ausgehend von einem Produktionsplasmid wird hierzu mittels rekombinanter RNA-Polymerasen die mRNA transkribiert und anschließend in einem mehrstufigen Aufreinigungsprozess von der DNA-Matrize, von fehlerhaften, zu kurzen und zu langen Transkripten sowie Nukleotiden getrennt. Der Beweis für das Potenzial dieser neuartigen Wirkstoffe für die Bekämpfung derzeit nicht therapierbarer Krebserkrankungen beim Menschen muss noch erbracht werden.[105]
Präklinische Studien zu Infektionskrankheiten
Humanbereich
mRNA ist zudem für eine therapeutische Verwendung denkbar. Eine Tierversuchsstudie zeigte, dass die Verabreichung von nanoverkapselter mRNA, die für Teile eines breit neutralisierenden Anti-HIV-Antikörpers kodiert, humanisierte Mäuse gegenüber einer HIV-Exposition schützte. Die Daten legen nahe, dass die Verwendung von nukleosid-modifizierter mRNA für die passive Immuntherapie gegen HIV, Cytomegalovirus (CMV), humanes Papilomvirus (HPV) usw. erweitert werden könne.[106]
Veterinärbereich
mRNA-Impfstoffe können auch im Veterinärbereich infrage kommen, um Infektionskrankheiten bei Tieren zu verhindern. Es konnte gezeigt werden, dass die Immunisierung mit in vitro transkribierter mRNA bei Mäusen einen Schutz gegen das Maul-und-Klauenseuche-Virus induzierte. Ein selbstamplifizierender mRNA-Impfstoff, der für das Rabiesvirus-Glykoprotein kodiert, induzierte bei Mäusen eine Immunantwort und ist möglicherweise zur Vorbeugung von Tollwut bei Hunden einsetzbar. Ein verkapselter modifizierter mRNA-Impfstoff, der für prM- und E-Gene des Hirschzecken-Powassan-Virus (POWV) kodiert, induzierte eine humorale Immunantwort nicht nur gegen POWV-Stämme, sondern auch gegen das verwandte Langat-Virus.[106]
mRNA-Impfstoffe sind moderne biomedizinische Arzneimittel, die in der EU und dem Europäischen Wirtschaftsraum nur gemeinsam in einem zentralisierten Verfahren, koordiniert durch die Europäische Arzneimittel-Agentur EMA (European Medicines Agency), durch die Europäische Kommission zugelassen werden können. Zwei Mitgliedstaaten werden im Rahmen eines solchen Verfahrens mit der federführenden Bearbeitung beauftragt.[107]
Arzneimittelrechtliche Einordnung
Da mRNA-Impfstoffe gegen Infektionskrankheiten nicht die DNA in den Körperzellen verändern, sind sie keine Gentherapeutika. Das wirkt sich arzneimittelrechtlich gemäß Anhang I, Teil IV, Abschnitt 2.1 der Richtlinie 2001/83/EG auf ihr Zulassungsverfahren in der Europäischen Union aus.[108]
Literatur
- Jörg Blech, Claus Hecking: Die Medizin von morgen. Forscher entwickeln Spritzen gegen Krebs, Herzinfarkt und Alzheimer. In: Der Spiegel. Nr. 25, 19. Juni 2021, S. 92.
- Elie Dolgin: How COVID unlocked the power of RNA vaccines. In: Nature. Band 589, Nr. 7841, 14. Januar 2021, ISSN 0028-0836, S. 189–191, doi:10.1038/d41586-021-00019-w (nature.com [abgerufen am 14. März 2021] deutsche Übersetzung unter dem Titel Siegeszug der RNA-Impfstoffe. In: Spektrum der Wissenschaft. Heft 3/2021, S. 53–57.).
- Norbert Pardi et al.: mRNA vaccines - a new era in vaccinology. In: Nature Reviews Drug Discovery. Band 17, Nr. 4, April 2018, S. 261–279, doi:10.1038/nrd.2017.243.
Weblinks
- Nicole Schuster: mRNA-Vakzine. Impfen mit Genen. In: Pharmazeutische Zeitung. 23. Mai 2018.
- Lars Fischer: Wie DNA- und RNA-Impfungen funktionieren. In: Scilogs. 12. August 2020, abgerufen am 9. November 2020.
- Arndt Reuning: mRNA als neues Konzept der Medizin: Es beginnt mit einer Impfung. In: Deutschlandfunk. 17. Januar 2021, abgerufen am 23. Januar 2021.
- Akademie der Naturwissenschaften Schweiz (SCNAT): Covid-19-Impfung erklärt – mRNA Impfstoffe. Auf: naturwissenschaften.ch; abgerufen am 5. August 2021.
Einzelnachweise
- Forum Genforschung der Akademie der Naturwissenschaften Schweiz: mRNA-Impfstoffe gegen das Coronavirus. Abgerufen am 5. August 2021.
- Nicole Schuster: mRNA-Vakzine – Impfen mit Genen. In: Pharmazeutische Zeitung. Ausgabe 21/ 2018; und Auf: pharmazeutische-zeitung.de; abgerufen am 4. Februar 2021.
- Paul-Ehrlich-Institut: Wie funktionieren mRNA-Impfstoffe und was sind ihre Vorteile? Auf: pei.de vom 30. Juli 2020; abgerufen am 4. Februar 2021.
- U. Elia, S. Ramishetti, R. Rosenfeld u. a.: Design of SARS-CoV-2 hFc-Conjugated Receptor-Binding Domain mRNA Vaccine Delivered via Lipid Nanoparticles. In: ACS Nano. 22. Juni 2021, Band 15, Nr. 6, S. 9627-9637, PMID 33480671.
- Siegfried Hofmann: Kampf gegen Infektionskrankheiten: Erster mRNA-Impfstoff: Diese Technologie könnte Covid-19 besiegen – und nicht nur das. Auf: handelsblatt.com vom 2. Dezember 2020, zuletzt abgerufen am 23. August 2021.
- Fernando P. Polack et al.: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. In: The New England Journal of Medicine. Band 383, Nr. 27, 31. Dezember 2020, S. 2603–2615, doi:10.1056/NEJMoa2034577, PMID 33301246, PMC 7745181 (freier Volltext).
- Ugur Sahin et al.: Personalized RNA mutanome vaccines mobilize poly-specific therapeutic immunity against cancer. In: Nature. Band 547, Nr. 7662, 13. Juli 2017, S. 222–226, doi:10.1038/nature23003, PMID 28678784.
- Martin Alberer et al.: Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. In: The Lancet. Band 390, Nr. 10101, Juli 2017, S. 1511–1520, doi:10.1016/S0140-6736(17)31665-3.
- Norbert Pardi et al.: Recent advances in mRNA vaccine technology. In: Current Opinion in Immunology. Band 65, August 2020, S. 14–20, doi:10.1016/j.coi.2020.01.008.
- Norbert Pardi et al.: mRNA vaccines – a new era in vaccinology. In: Nature Reviews Drug Discovery. Band 17, April 2018, S. 261–279, doi:10.1038/nrd.2017.243.
- Oliver Klein und Katja Belousova: Impfstoffe: Warum es keine Langzeit-Nebenwirkungen gibt. In: ZDF. 6. Januar 2021, abgerufen am 14. Januar 2021.
- S. Brenner, F. Jacob, M. Meselson: An unstable intermediate carrying information from genes to ribosomes for protein synthesis. In: Nature. Band 190, Mai 1961, S. 576–581, doi:10.1038/190576a0, PMID 20446365.
- Khalid A. Hajj & Kathryn A. Whitehead: Tools for translation: non-viral materials for therapeutic mRNA delivery. In: Nature Reviews Materials (2017), Band 2, Artikelnummer 17056.
- C. D. Lane, G. Marbaix, J. B. Gurdon: Rabbit haemoglobin synthesis in frog cells: the translation of reticulocyte 9 s RNA in frog oocytes. In: Journal of Molecular Biology. Band 61, Nr. 1, 14. Oktober 1971, ISSN 0022-2836, S. 73–91, doi:10.1016/0022-2836(71)90207-5 (sciencedirect.com [abgerufen am 31. Dezember 2021]).
- G. J. Dimitriadis: Translation of rabbit globin mRNA introduced by liposomes into mouse lymphocytes. In: Nature. Band 274, Nummer 5674, August 1978, S. 923–924, doi:10.1038/274923a0, PMID 683336.
- Marc J. Ostro, Dario Giacomoni, Don Lavelle, William Paxton, Sheldon Dray: Evidence for translation of rabbit globin mRNA after liposomemediated insertion into a human cell line. In: Nature. Band 274, Nr. 5674, August 1978, ISSN 1476-4687, S. 921–923, doi:10.1038/274921a0 (nature.com [abgerufen am 31. Dezember 2021]).
- R. W. Malone, P. L. Felgner, I. M. Verma: Cationic liposome-mediated RNA transfection. In: Proceedings of the National Academy of Sciences. Band 86, Nummer 16, August 1989, S. 6077–6081, doi:10.1073/pnas.86.16.6077, PMID 2762315, PMC 297778 (freier Volltext).
- Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt, Heleen Dewitte: Three decades of messenger RNA vaccine development. In: Nano Today. 28, 2019, S. 100766, doi:10.1016/j.nantod.2019.100766.
- J. A. Wolff, R. W. Malone, P. Williams, W. Chong, G. Acsadi, A. Jani, P. L. Felgner: Direct gene transfer into mouse muscle in vivo. In: Science. Band 247, Nr. 4949, Teil 1, März 1990, S. 1465–1468, doi:10.1126/science.1690918, PMID 1690918.
- P. Löffler: Review: Vaccine Myth-Buster - Cleaning Up With Prejudices and Dangerous Misinformation. In: Frontiers in immunology. Band 12, 2021, S. 663280, doi:10.3389/fimmu.2021.663280, PMID 34177902, PMC 8222972 (freier Volltext).
- F. Martinon, S. Krishnan, G. Lenzen, R. Magné, E. Gomard, J. G. Guillet, J. P. Lévy, P. Meulien: Induction of virus-specific cytotoxic T lymphocytes in vivo by liposome-entrapped mRNA. In: European journal of immunology. Band 23, Nr. 7, Juli 1993, S. 1719–1722, doi:10.1002/eji.1830230749, PMID 8325342.
- X. Zhou, P. Berglund, G. Rhodes, S. E. Parker, M. Jondal, P. Liljeström: Self-replicating Semliki Forest virus RNA as recombinant vaccine. In: Vaccine. Band 12, Nr. 16, Dezember 1994, S. 1510–1514, doi:10.1016/0264-410x(94)90074-4, PMID 7879415.
- R. M. Conry, A. F. LoBuglio, M. Wright, L. Sumerel, M. J. Pike, F. Johanning, R. Benjamin, D. Lu, D. T. Curiel: Characterization of a messenger RNA polynucleotide vaccine vector. In: Cancer Research. Band 55, Nummer 7, April 1995, S. 1397–1400, PMID 7882341.
- P. Borah, P. K. Deb, N. A. Al-Shar'i, L. A. Dahabiyeh, K. N. Venugopala, V. Singh, P. Shinu, S. Hussain, S. Deka, B. Chandrasekaran, D. M. Jaradat: Perspectives on RNA Vaccine Candidates for COVID-19. In: Frontiers in Molecular Biosciences. Band 8, 2021, S. 635245, doi:10.3389/fmolb.2021.635245, PMID 33869282, PMC 8044912 (freier Volltext).
- E. Gilboa, J. Vieweg: Cancer immunotherapy with mRNA-transfected dendritic cells. In: Immunological reviews. Band 199, Juni 2004, S. 251–263, doi:10.1111/j.0105-2896.2004.00139.x, PMID 15233739.
- K. Karikó, M. Buckstein, H. Ni, D. Weissman: Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. In: Immunity. Band 23, Nr. 2, August 2005, S. 165–175, doi:10.1016/j.immuni.2005.06.008, PMID 16111635.
- M. A. McNamara et al.: RNA-Based Vaccines in Cancer Immunotherapy. In: Journal of immunology research. Band 2015, 2015, S. 794528, doi:10.1155/2015/794528, PMID 26665011, PMC 4668311 (freier Volltext).
- T. Kramps, K. Elbers: Introduction to RNA Vaccines. In: Methods in molecular biology. Band 1499, 2017, S. 1–11, doi:10.1007/978-1-4939-6481-9_1, PMID 27987140.
- FAQ – Häufig gestellte Fragen. Paul-Ehrlich-Institut, 17. Dezember 2020, abgerufen am 20. Dezember 2020 (unter „Sind bereits humane mRNA-Impfstoffe zugelassen?“): „Für mehrere Kandidaten, insbesondere therapeutische Impfstoffe gegen Krebserkrankungen, laufen klinische Prüfungen. Bislang ist aber kein humaner mRNA-Impfstoff zugelassen.“
- COVID-19-Impfstoff von BioNTech/Pfizer: BNT162b2. In: arznei-telegramm. 18. Dezember 2020, S. 92–102, 92, abgerufen am 20. Dezember 2020 (Ausgabe 12/2020).
- Namit Chaudhary et al.: mRNA vaccines for infectious diseases: principles, delivery and clinical translation. In: Nature Reviews Drug Discovery. 25. August 2021, S. 1–22, doi:10.1038/s41573-021-00283-5.
- D. Pushparajah, S. Jimenez, S. Wong, H. Alattas, N. Nafissi, R. A. Slavcev: Advances in gene-based vaccine platforms to address the COVID-19 pandemic. In: Advanced drug delivery reviews. Band 170, 03 2021, S. 113–141, doi:10.1016/j.addr.2021.01.003, PMID 33422546, PMC 7789827 (freier Volltext).
- T. Kramps, K. Elbers: Introduction to RNA Vaccines. In: Methods in molecular biology. Band 1499, 2017, S. 1–11, doi:10.1007/978-1-4939-6481-9_1, PMID 27987140.
- Eukaryontische Genregulation: RNA-Stabilität in Eukaryonten. In: ChemgaPedia. Wiley Information Services GmbH, abgerufen am 9. Juni 2020.
- C. Poveda, A. B. Biter, M. E. Bottazzi, U. Strych: Establishing Preferred Product Characterization for the Evaluation of RNA Vaccine Antigens. In: Vaccines. Band 7, Nr. 4, September 2019, S. , doi:10.3390/vaccines7040131, PMID 31569760, PMC 6963847 (freier Volltext).
- M. A. Marć, E. Domínguez-Álvarez, C. Gamazo: Nucleic acid vaccination strategies against infectious diseases. In: Expert opinion on drug delivery. Band 12, Nr. 12, 2015, S. 1851–1865, doi:10.1517/17425247.2015.1077559, PMID 26365499.
- A. Rodríguez-Gascón, A. del Pozo-Rodríguez, M. Solinís: Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. In: International journal of nanomedicine. Band 9, 2014, S. 1833–1843, doi:10.2147/IJN.S39810, PMID 24748793, PMC 3986288 (freier Volltext).
- K. C. McCullough, P. Milona, L. Thomann-Harwood, T. Démoulins, P. Englezou, R. Suter, N. Ruggli: Self-Amplifying Replicon RNA Vaccine Delivery to Dendritic Cells by Synthetic Nanoparticles. In: Vaccines. Band 2, Nr. 4, Oktober 2014, S. 735–754, doi:10.3390/vaccines2040735, PMID 26344889, PMC 4494254 (freier Volltext).
- A. B. Vogel, L. Lambert, E. Kinnear et al.: Self-Amplifying RNA Vaccines Give Equivalent Protection against Influenza to mRNA Vaccines but at Much Lower Doses. In: Molecular therapy: the journal of the American Society of Gene Therapy. Band 26, Nr. 2, 02 2018, S. 446–455, doi:10.1016/j.ymthe.2017.11.017, PMID 29275847, PMC 5835025 (freier Volltext).
- N. Pardi, M. J. Hogan, F. W. Porter, D. Weissman: mRNA vaccines – a new era in vaccinology. In: Nature reviews. Drug discovery. Band 17, Nr. 4, 04 2018, S. 261–279, doi:10.1038/nrd.2017.243, PMID 29326426, PMC 5906799 (freier Volltext).
- Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt, Heleen Dewitte: Three decades of messenger RNA vaccine development. In: Nano Today. Nr. 28, 2019, S. 100766, doi:10.1016/j.nantod.2019.100766.
- I. Knezevic, M. A. Liu, K. Peden, T. Zhou, H. N. Kang: Development of mRNA Vaccines: Scientific and Regulatory Issues. In: Vaccines. Band 9, Nr. 2, Januar 2021, S. , doi:10.3390/vaccines9020081, PMID 33498787, PMC 7910833 (freier Volltext).
- K. Karikó, H. Muramatsu, J. Ludwig, D. Weissman: Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. In: Nucleic acids research. Band 39, Nummer 21, November 2011, S. e142, doi:10.1093/nar/gkr695, PMID 21890902, PMC 3241667 (freier Volltext).
- D. R. Gallie: The cap and poly(A) tail function synergistically to regulate mRNA translational efficiency. In: Genes & development. Band 5, Nummer 11, November 1991, S. 2108–2116, doi:10.1101/gad.5.11.2108, PMID 1682219.
- M. Kozak: An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. In: Nucleic acids research. Band 15, Nummer 20, Oktober 1987, S. 8125–8148, doi:10.1093/nar/15.20.8125, PMID 3313277, PMC 306349 (freier Volltext).
- Alexandra G. Orlandini von Niessen et al.: Improving mRNA-Based Therapeutic Gene Delivery by Expression-Augmenting 3' UTRs Identified by Cellular Library Screening. In: Molecular Therapy: The Journal of the American Society of Gene Therapy. Band 27, Nr. 4, 10. April 2019, S. 824–836, doi:10.1016/j.ymthe.2018.12.011, PMID 30638957, PMC 6453560 (freier Volltext).
- K. E. Broderick, L. M. Humeau: Electroporation-enhanced delivery of nucleic acid vaccines. In: Expert review of vaccines. Band 14, Nr. 2, Februar 2015, S. 195–204, doi:10.1586/14760584.2015.990890, PMID 25487734.
- D. Benteyn, C. Heirman, A. Bonehill, K. Thielemans, K. Breckpot: mRNA-based dendritic cell vaccines. In: Expert review of vaccines. Band 14, Nr. 2, Februar 2015, S. 161–176, doi:10.1586/14760584.2014.957684, PMID 25196947.
- Günther Strobl: Schlüsselrolle für österreichische Firma Polymun Scientific bei Covid-Vakzin, derstandard.at vom 12. November 2020, abgerufen am 12. November 2020.
- A. M. Reichmuth, M. A. Oberli, A. Jaklenec, R. Langer, D. Blankschtein: mRNA vaccine delivery using lipid nanoparticles. In: Therapeutic delivery. Band 7, Nr. 5, 2016, S. 319–334, doi:10.4155/tde-2016-0006, PMID 27075952, PMC 5439223 (freier Volltext).
- Gómez-Aguado, Rodríguez-Castejón, Vicente-Pascual, Rodríguez-Gascón, Ángeles Solinís, Pozo-Rodríguez: Nanomedicines to Deliver mRNA: State of the Art and Future Perspectives In: Nanomaterials. 20 Februar 2020, doi:10.3390/nano10020364.
- V. K. Udhayakumar, A. De Beuckelaer, J. McCaffrey et al.: Arginine-Rich Peptide-Based mRNA Nanocomplexes Efficiently Instigate Cytotoxic T Cell Immunity Dependent on the Amphipathic Organization of the Peptide. In: Advanced healthcare materials. Band 6, Nr. 13, Juli 2017, S. , doi:10.1002/adhm.201601412, PMID 28436620.
- B. Weide, S. Pascolo, B. Scheel, E. Derhovanessian, A. Pflugfelder, T. K. Eigentler, G. Pawelec, I. Hoerr, H. G. Rammensee, C. Garbe: Direct injection of protamine-protected mRNA: results of a phase 1/2 vaccination trial in metastatic melanoma patients. In: Journal of immunotherapy. Band 32, Nummer 5, Juni 2009, S. 498–507, doi:10.1097/CJI.0b013e3181a00068, PMID 19609242.
- T. Démoulins, P. C. Englezou, P. Milona, N. Ruggli, N. Tirelli, C. Pichon, C. Sapet, T. Ebensen, C. A. Guzmán, K. C. McCullough: Self-Replicating RNA Vaccine Delivery to Dendritic Cells. In: Methods in molecular biology. Band 1499, 2017, S. 37–75, doi:10.1007/978-1-4939-6481-9_3, PMID 27987142.
- D. J. Crommelin, T. J. Anchordoquy, D. B. Volkin, W. Jiskoot, E. Mastrobattista: Addressing the Cold Reality of mRNA Vaccine Stability. In: Journal of pharmaceutical sciences. Band 110, Nummer 3, 03 2021, S. 997–1001, doi:10.1016/j.xphs.2020.12.006, PMID 33321139, PMC 7834447 (freier Volltext).
- S. Sohail Ahmed, Ronald W. Ellis, Rino Rappuoli: Technologies for Making New Vaccines. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin's Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 1297, doi:10.1016/B978-0-323-35761-6.00066-3 (elsevier.com).
- J. Probst, B. Weide, B. Scheel, B. J. Pichler, I. Hoerr, H. G. Rammensee, S. Pascolo: Spontaneous cellular uptake of exogenous messenger RNA in vivo is nucleic acid-specific, saturable and ion dependent. In: Gene therapy. Band 14, Nr. 15, August 2007, S. 1175–1180, doi:10.1038/sj.gt.3302964, PMID 17476302.
- C. Lorenz, M. Fotin-Mleczek, G. Roth, C. Becker, T. C. Dam, W. P. Verdurmen, R. Brock, J. Probst, T. Schlake: Protein expression from exogenous mRNA: uptake by receptor-mediated endocytosis and trafficking via the lysosomal pathway. In: RNA biology. Band 8, Nr. 4, 2011 Jul-Aug, S. 627–636, doi:10.4161/rna.8.4.15394, PMID 21654214.
- K. Paunovska, C. D. Sago, C. M. Monaco, W. H. Hudson et al.: A Direct Comparison of in Vitro and in Vivo Nucleic Acid Delivery Mediated by Hundreds of Nanoparticles Reveals a Weak Correlation. In: Nano letters. Band 18, Nr. 3, 03 2018, S. 2148–2157, doi:10.1021/acs.nanolett.8b00432, PMID 29489381, PMC 6054134 (freier Volltext).
- S. E. McNeil, A. Vangala, V. W. Bramwell, P. J. Hanson, Y. Perrie: Lipoplexes formulation and optimisation: in vitro transfection studies reveal no correlation with in vivo vaccination studies. In: Current Drug Delivery . 2010, Band 7, Nr. 2, S. 175–187, PMID 20158478.
- Thomas Hinz et al.: The European Regulatory Environment of RNA-Based Vaccines. In: Methods in Molecular Biology (Clifton, N.J.). Band 1499, 2017, S. 203–222, doi:10.1007/978-1-4939-6481-9_13, PMID 27987152.
- Katalin Karikó, H. Muramatsu, J. Ludwig, D. Weissman: Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. In: Nucleic acids research. Band 39, Nr. 21, November 2011, S. e142, doi:10.1093/nar/gkr695, PMID 21890902, PMC 3241667 (freier Volltext).
- M. Fotin-Mleczek, K. M. Duchardt, C. Lorenz, R. Pfeiffer, S. Ojkić-Zrna, J. Probst, K. J. Kallen: Messenger RNA-based vaccines with dual activity induce balanced TLR-7 dependent adaptive immune responses and provide antitumor activity. In: Journal of immunotherapy. Band 34, Nr. 1, Januar 2011, S. 1–15, doi:10.1097/CJI.0b013e3181f7dbe8, PMID 21150709.
- A. Thess, S. Grund, B. L. Mui, M. J. Hope, P. Baumhof, M. Fotin-Mleczek, T. Schlake: Sequence-engineered mRNA Without Chemical Nucleoside Modifications Enables an Effective Protein Therapy in Large Animals. In: Molecular therapy: the journal of the American Society of Gene Therapy. Band 23, Nr. 9, September 2015, S. 1456–1464, doi:10.1038/mt.2015.103, PMID 26050989, PMC 4817881 (freier Volltext).
- University of Cambridge, PHG Foundation: RNA vaccines: an introduction. Abgerufen am 20. April 2020.
- L. Warren, P. D. Manos, T. Ahfeldt et al.: Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. In: Cell stem cell. Band 7, Nr. 5, November 2010, S. 618–630, doi:10.1016/j.stem.2010.08.012, PMID 20888316, PMC 3656821 (freier Volltext).
- Christina Krienke et al.: A noninflammatory mRNA vaccine for treatment of experimental autoimmune encephalomyelitis. In: Science (New York, N.Y.). Band 371, Nr. 6525, 8. Januar 2021, S. 145–153, doi:10.1126/science.aay3638, PMID 33414215.
- K. Karikó, M. Buckstein, H. Ni, D. Weissman: Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. In: Immunity. Band 23, Nr. 2, August 2005, S. 165–175, doi:10.1016/j.immuni.2005.06.008, PMID 16111635.
- N. Pardi, D. Weissman: Nucleoside Modified mRNA Vaccines for Infectious Diseases. In: Methods in molecular biology. Band 1499, 2017, S. 109–121, doi:10.1007/978-1-4939-6481-9_6, PMID 27987145.
- N. Pardi, M. J. Hogan, D. Weissman: Recent advances in mRNA vaccine technology. In: Current opinion in immunology. [elektronische Veröffentlichung vor dem Druck] März 2020, doi:10.1016/j.coi.2020.01.008, PMID 32244193.
- G. Hager: Nonclinical Safety Testing of RNA Vaccines. In: Methods in molecular biology. Band 1499, 2017, S. 253–272, doi:10.1007/978-1-4939-6481-9_16, PMID 27987155.
- M. Baiersdörfer, G. Boros, H. Muramatsu, A. Mahiny, I. Vlatkovic, U. Sahin, K. Karikó: A Facile Method for the Removal of dsRNA Contaminant from In Vitro-Transcribed mRNA. In: Molecular therapy. Nucleic acids. Band 15, April 2019, S. 26–35, doi:10.1016/j.omtn.2019.02.018, PMID 30933724, PMC 6444222 (freier Volltext).
- K. Bloom, F. van den Berg, P. Arbuthnot: Self-amplifying RNA vaccines for infectious diseases. In: Gene therapy. Band 28, Nr. 3–4, April 2021, S. 117–129, doi:10.1038/s41434-020-00204-y, PMID 33093657, PMC 7580817 (freier Volltext).
- Z. Wu, T. Li: Nanoparticle-Mediated Cytoplasmic Delivery of Messenger RNA Vaccines: Challenges and Future Perspectives. In: Pharmaceutical research. Band 38, Nummer 3, März 2021, S. 473–478, doi:10.1007/s11095-021-03015-x, PMID 33660201, PMC 7928182 (freier Volltext).
- Deutsche Forschungsgemeinschaft: Funktionelle Bedeutung des extrazellulären RNA/RNase Systems für die vaskuläre Homöostase. Auf: gepris.dfg.de, abgerufen am 25. Mai 2020.
- Paul-Ehrlich-Institut wirft Impfgegnern unbegründete Angstmache vor. In: Deutsches Ärzteblatt. 19. November 2020, abgerufen am 21. November 2020.
- T. Schlake, A. Thess, M. Fotin-Mleczek, K. J. Kallen: Developing mRNA-vaccine technologies. In: RNA biology. Band 9, Nr. 11, November 2012, S. 1319–1330, doi:10.4161/rna.22269, PMID 23064118, PMC 3597572 (freier Volltext).
- S. C. Tan, B. C. Yiap: DNA, RNA, and protein extraction: the past and the present. In: Journal of biomedicine & biotechnology. Band 2009, 2009, S. 574398, doi:10.1155/2009/574398, PMID 20011662, PMC 2789530 (freier Volltext).
- Genbasierte Impfstoffe: Hoffnungsträger auch zum Schutz vor SARS-CoV-2 Ärzteblatt. Abgerufen am 17. Juli 2020.
- Impfen mit Genen Pharmazeutische Zeitung. Abgerufen am 17. Juli 2020.
- Elie Dolgin: How COVID unlocked the power of RNA vaccines. In: Nature. Band 589, Nr. 7841, 14. Januar 2021, ISSN 0028-0836, S. 189–191, doi:10.1038/d41586-021-00019-w (nature.com [abgerufen am 14. März 2021] deutsche Übersetzung unter dem Titel Siegeszug der RNA-Impfstoffe. In: Spektrum der Wissenschaft. Heft 3/2021, S. 53–57).
- Bis minus 80 °C: Wer soll Corona-Impfstoff liefern? apotheke adhoc, 3. September 2020.
- Pharmafirmen vor Mammutaufgabe bei Corona-Impfstoff. cash.ch, 29. Juni 2020.
- Erste klinische Prüfung eines COVID-19-Impfstoffs in Deutschland genehmigt. Paul-Ehrlich-Institut, 22. April 2020, abgerufen am 22. April 2020.
- hessenschau de, Frankfurt Germany: Erste Studie zu Corona-Impfstoff in Deutschland läuft an. 22. April 2020, abgerufen am 3. Dezember 2020.
- Cluster für Individualisierte ImmunIntervention (Ci3): Erste Covid-19-Impfstoffstudie in Deutschland genehmigt. 11. Mai 2020, abgerufen am 3. Dezember 2020.
- Paul-Ehrlich-Institut: Hintergrundinformationen zur Entwicklung von SARS-CoV-2-Impfstoffen anlässlich der Genehmigung der ersten klinischen Prüfung eines SARS-CoV-2-Impfstoffs in Deutschland. Auf: pei.de vom 22. April 2020. Abgerufen am 21. Mai 2020.
- NCT04368728 Study to Describe the Safety, Tolerability, Immunogenicity, and Potential Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults. Auf: clinicaltrials.gov Stand 5. Juni 2020; abgerufen am 12. Juni 2020.
- Phase 1/2 Study to Describe the Safety and Immunogenicity of a COVID-19 RNA Vaccine Candidate (BNT162b1) in Adults 18 to 55 Years of Age: Interim Report, www.medrxiv.org, 1. Juli 2020.
- Biontech/Pfizer-Corona-Impfstoff: 95 Prozent Wirksamkeit nach Phase-3-Auswertung. 19. November 2020, abgerufen am 19. November 2020.
- SARS-CoV-2: Erste Impfstoff-Studie hat in den USA begonnen. Auf: aerzteblatt.de vom 17. März 2020, abgerufen am 19. Mai 2020.
- Europäische Kommission erteilt zweite Zulassung für sicheren und wirksamen Impfstoff gegen COVID-19. In: ec.europa.eu. Europäische Kommission, 6. Januar 2021, abgerufen am 6. Januar 2021.
- CureVac beginnt die globale, zulassungsrelevante Phase 2b/3-Studie für seinen COVID-19-Impfstoffkandidaten CVnCoV. In: curevac.com. CureVac, 14. Dezember 2020, abgerufen am 4. Januar 2021.
- A Study to Determine the Safety and Efficacy of SARS-CoV-2 mRNA Vaccine CVnCoV in Adults. In: clinicaltrails.gov. 8. Dezember 2020, abgerufen am 4. Januar 2021 (englisch).
- First volunteer receives Imperial COVID-19 vaccine. Ryan O’Hare, 23. Juni 2020. Abgerufen am 26. Juni 2020.
- Benjamin Weide et al.: Results of the first phase I/II clinical vaccination trial with direct injection of mRNA. In: Journal of Immunotherapy (Hagerstown, Md.: 1997). Band 31, Nr. 2, Februar 2008, S. 180–188, doi:10.1097/CJI.0b013e31815ce501, PMID 18481387.
- Benjamin Weide et al.: Direct injection of protamine-protected mRNA: results of a phase 1/2 vaccination trial in metastatic melanoma patients. In: Journal of Immunotherapy (Hagerstown, Md.: 1997). Band 32, Nr. 5, Juni 2009, S. 498–507, doi:10.1097/CJI.0b013e3181a00068, PMID 19609242.
- Megan A. McNamara et al.: RNA-Based Vaccines in Cancer Immunotherapy. In: Journal of Immunology Research. Band 2015, 2015, doi:10.1155/2015/794528, PMID 26665011, PMC 4668311 (freier Volltext).
- F. B. Scorza, N. Pardi: New Kids on the Block: RNA-Based Influenza Virus Vaccines. In: Vaccines. Band 6, Nr. 2, April 2018, S. , doi:10.3390/vaccines6020020, PMID 29614788, PMC 6027361 (freier Volltext).
- N. Armbruster, E. Jasny, B. Petsch: Advances in RNA Vaccines for Preventive Indications: A Case Study of A Vaccine Against Rabies. In: Vaccines. Band 7, Nr. 4, September 2019, S. , doi:10.3390/vaccines7040132, PMID 31569785, PMC 6963972 (freier Volltext).
- EU-Kommission: A “Universal” Influenza Vaccine through Synthetic, Dendritic Cell-Targeted, Self-Replicating RNA Vaccines. Auf: cordis.europa.eu; abgerufen am 27. Mai 2020.
- UniVax-Projekt: Selbstbeschreibung. Auf: univax-fp7.eu; zuletzt abgerufen am 6. Februar 2021.
- Francesco Berlanda Scorza, Norbert Pardi: New Kids on the Block: RNA-Based Influenza Virus Vaccines. 1. April 2018, PMC 6027361 (freier Volltext).
- Nicole Armbruster et al.: Advances in RNA Vaccines for Preventive Indications: A Case Study of a Vaccine against Rabies. In: Vaccines. Band 7, Nr. 4, Dezember 2019, S. 132, doi:10.3390/vaccines7040132.
- Messenger RNA-basierte Impfstoffe zur Behandlung von Krebserkrankungen. Auf: biospektrum.de, abgerufen am 28. Mai 2020.
- C. Zhang et al.: Advances in mRNA Vaccines for Infectious Diseases. In: Frontiers in Immunology. Band 10, 27. März 2019, doi:10.3389/fimmu.2019.00594.
- FAQ zum Presse-Briefing des Paul-Ehrlich-Instituts. Paul-Ehrlich-Institut vom 22. April 2020, S. 5 (Volltext als PDF).
- Wissenschaftliche Dienste: Sachstand: Regelungen zu genbasierten Impfstoffen. Begriffliche Einordnung und arzneimittelrechtliche Zulassung. In: WD 9 - 3000 - 116/20. Deutscher Bundestag, 25. Januar 2021, S. 7 f., abgerufen am 13. November 2021 (unter Bezugnahme auf BT-Drs. 19/6321, S. 75 f.).