Hantaviren
Die Familie Hantaviridae aus der Ordnung der Bunyavirales umfasst neben wenigen Spezies der Gattungen Loanvirus, Mobatvirus und Thottimvirus vor allem zahlreiche Arten der Gattung Orthohantavirus: unter anderem die humanpathogenen Arten Hantaan-Virus (HTNV), Puumala-Virus (PUUV), Dobrava-Belgrad-Virus (DOBV), Seoul-Virus (SEOV), Sin-Nombre-Virus (SNV) und Andes-Virus (ANDV). Diese behüllten Einzel-Strang(−)-RNA-Viren [ss(−)RNA] verursachen je nach Virustyp verschiedene Erkrankungen. Dazu zählen schwere Lungenerkrankungen (Pneumonie), ein akutes Nierenversagen (nephrotisches Syndrom) oder hämorrhagische Fiebererkrankungen. Die Viren sind weltweit verbreitet und treten auch in Mitteleuropa auf. Sie werden durch den Kot oder Urin infizierter Nagetiere (Mäuse und Ratten), der als Staub eingeatmet wird, auf den Menschen übertragen. Die infizierten Nagetiere selbst zeigen keine Krankheitssymptome. Die menschlichen Erkrankungen verlaufen unterschiedlich schwer. Während die in Mitteleuropa auftretenden Puumala-Virus-Infektionen in weniger als 1 Prozent der klinisch auffälligen Fälle tödlich verlaufen, beträgt die Letalität bei Infektionen mit dem in Ostasien auftretenden Hantaan-Virus und mit dem auf dem Balkan zu findenden Dobrava-Virus bis zu 15 Prozent und bei den amerikanischen Hantaviren (Sin-Nombre-Virus, Andes-Virus und andere) etwa 30–40 Prozent.[3]
| Hantaviren | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Sin-Nombre-Virus | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Hantaviridae | ||||||||||||||||
| Links | ||||||||||||||||
|
Der Name Hanta geht auf den Fluss Hantan in Südkorea zurück, an dem in den 1950er-Jahren während des Koreakrieges mehr als 3.000 amerikanische Soldaten an einem ungewöhnlich starken Fieber häufig mit einem anschließenden Nierenversagen erkrankten. Erst 1977 gelang es Ho Wang Lee und anderen, das bis dahin unbekannte Hantaan-Virus (HTNV) zu isolieren.[4] Auf diese Historie geht die Bezeichnung Korea-Fieber für durch humanpathogene Orthohantaviren verursachte Erkrankungen (englisch Hantavirus hemorrhagic fever with renal syndrome, HFRS) zurück.
Übertragung und Inkubationszeit
Die Übertragung geschieht durch verschiedene Nager, die mit dem Speichel, den Fäkalien und dem Urin (Virurie) große Mengen an Erregern ausscheiden. Bei den Nagern sind vor allem Mäuse, in Deutschland besonders die Rötelmaus, als Überträger festgestellt, die jedoch selbst nicht erkranken, auch wenn sie, einmal infiziert, lebenslang infektiös bleiben.[4] Die Übertragung auf den Menschen erfolgt sowohl durch Kontaktinfektion als auch durch orale, überwiegend jedoch durch respiratorische Aufnahme der Erreger durch die Atemwege, seltener durch Nagetierbisse.[5] Eine typische Situation, bei der eine Übertragung mit relativ hoher Wahrscheinlichkeit erfolgen kann, ist beispielsweise das Ausfegen einer im Winter nicht genutzten Hütte im Frühjahr. Generell sind vor allem Personen gefährdet, die in der Land- und Forstwirtschaft arbeiten oder sich viel in der Natur aufhalten. In Asien sind häufig Reisbauern betroffen. Eine Mensch-zu-Mensch-Übertragung ist nur bei einem Ausbruch in Südamerika 1996 beschrieben worden.[6][7]
Die Inkubationszeit beträgt je nach Virustyp zwischen 5 und 60 Tagen.
Verursachte menschliche Erkrankungen
Hantaviren in Europa und Asien

Bei den europäischen und asiatischen Hantaviren stehen eine Nierenschädigung, die bis zum (meist reversiblen) akuten Nierenversagen führen kann, sowie eine fieberhafte Erkrankung mit Störung der Blutgerinnung und Blutungsneigung im Vordergrund. Der Symptomkomplex wird oft als „hämorrhagisches Fieber mit renalem Syndrom“ (HFRS) bezeichnet. In Europa kommen das Dobrava-Belgrad-Virus und Puumala-Virus vor, die leichte bis mittelschwere Verläufe verursachen. Als Überträger sind für das Puumala-Virus die Rötelmaus, für das Dobrava-Virus die Brandmaus und die Gelbhalsmaus identifiziert worden.[3] Die durch das auch in Deutschland und Skandinavien häufig vorkommende Puumala-Virus ausgelöste Nierenschädigung wird auch als Nephropathia epidemica[8] (NE) bezeichnet. Dabei treten sehr selten Blutungen auf.[5]
Klinisch äußert sich die Infektion mit abrupt einsetzendem Fieber, Kopfschmerzen, Gliederschmerzen, Blutdruckabfall, neurologischen Symptomen (Sehstörungen) und Zeichen der Nierenschädigung. Labormedizinisch kommt es zu Blutbildveränderungen (Thrombozytopenie), zu einem Anstieg von Serum-Kreatinin, zu einer Mikrohämaturie, zu einer Proteinurie und zu einem Rückgang der glomerulären Filtrationsrate. Akute Glaukomanfälle, eine Beteiligung des zentralen Nervensystems (ZNS), Myokarditiden und intestinale (den Darm betreffende) Blutungen können als Komplikationen auftreten. Die Erkrankung heilt meist folgenlos aus.[3][9]
Die durch die südosteuropäische Variante des Dobrava-Virus hervorgerufenen HFRS-Erkrankungen neigen zu signifikant schwereren Verläufen und weisen eine Letalität von bis zu 12 % auf. Ähnliches gilt für das durch den Hantaan-Genotyp verursachte ostasiatische Erkrankungsbild, bei dem die Todesrate etwa 15 % beträgt.[10]
Erkrankungen durch Hantaviren müssen bei schwerem Verlauf im Krankenhaus behandelt werden, andernfalls kann die Erkrankung zum Tode führen. Eine Anämie kann Monate fortdauern. Der Nachweis von Hantaviren oder einer Hantavirus-Infektion ist in Deutschland seit dem 1. Januar 2001 meldepflichtig.[5]
Hantaviren in Nord- und Südamerika


Bei den auf dem amerikanischen Doppelkontinent vorkommenden Hantaviren stehen in der Regel nicht die Nierenschädigung oder ein hämorrhagisches Fieber im Vordergrund, sondern eine schwere Lungenentzündung (Pneumonie) mit Lungenödem (Hantavirus-assoziiertes pulmonales Syndrom, abgekürzt HPS, synonym auch Hantavirus cardiopulmonary syndrome, HCPS). Die Erstbeschreibung dieser Erkrankung erfolgte im Jahr 1993, nachdem im Grenzgebiet der vier Bundesstaaten New Mexico, Utah, Arizona und Colorado (einer Region, die als „Four Corners“ bekannt ist) mehrere Fälle einer schweren Lungenentzündung bei Navajo-Indianern auftraten, von denen einige tödlich endeten.[11] Die Umstände und die Epidemiologie dieses Ausbruchs wiesen auf eine infektiöse Ursache der Lungenentzündung hin. Wissenschaftler der Centers for Disease Control and Prevention (CDC) konnten in der Folge nachweisen, dass die Erkrankung durch ein neues, bis dahin nicht bekanntes Hantavirus verursacht wurde. Das Virus wurde sowohl am CDC als auch am United States Army Medical Research Institute of Infectious Diseases (USAMRIID) isoliert und erhielt zunächst den Namen Muerto Canyon virus, später geändert in Sin Nombre virus (SNV, „namenloses Virus“).[11]
Da bekannt war, dass Hantaviren durch Nagetiere übertragen werden, wurde eine umfangreiche Suche nach dem Überträger dieser lokalen Hantavirus-Epidemie in der betroffenen Region eingeleitet. Zahlreiche Nagetiere wurden in Fallen gefangen und untersucht. Dabei stellte sich heraus, dass Weißfußmäuse (Peromyscus maniculatus, englisch deer mouse) die Hauptüberträger dieses neu entdeckten Hantavirus waren. Diese Neuweltmäuse leben häufig in der Nähe menschlicher Ansiedlungen oder auch direkt in älteren Häusern. Untersuchungen noch im selben Jahr 1993 ergaben, dass auch andere verwandte Hantaviren ein ähnliches Krankheitsbild auslösen können. Bei zwei Personen aus Louisiana und aus Florida mit HPS wurden zwei neue Hantaviren entdeckt, das später so benannte Bayou virus und das Black Creek Canal virus. Als Überträger wurden Reisratten (Oryzomys) bzw. Baumwollratten (Sigmodon hispidus) identifiziert.
Bei den nordamerikanischen Hantaviren ("new world hanta viruses") und besonders beim Sin-Nombre-Virus beträgt die Inkubationszeit zwei bis vier Wochen, gefolgt von einer Prodromalphase. Dabei tritt ein hohes Fieber auf, es kommt zu Muskelschmerzen, zu starken Kopf- und Nackenschmerzen, zu einem allgemeinen Krankheitsgefühl, zu einer Körperschwäche, zu Bauchschmerzen, zu Übelkeit und Erbrechen und gelegentlich zu einem Durchfall. Es entwickeln sich eine schwere Leukozytose mit Bandämie und eine Thrombozytopenie. Nieren und Leber sind typischerweise nicht involviert. Abrupt kann es nach drei bis fünf Tagen zu einer Verschlechterung und zu einer Progression in die "kardiopulmonale Phase" mit Atemnot, nichteitriger Sekretion, bis hin zum akuten Lungenversagen und myokardialen Dekompensation kommen, die mit einer Letalität von 40 % verbunden ist. Sehr früh werden spezifische Antikörper gebildet, neben IgM auch innerhalb weniger Tage IgG-Antikörper.[12]
Später wurden weitere Hantaviren bei Patienten mit Lungensymptomen in Argentinien, Brasilien, Kanada, Chile, Paraguay und Uruguay beschrieben.[11] Im Südkegel Südamerikas gilt die Langschwanz-Zwergreisratte Oligoryzomys longicaudatus als Hauptüberträger von Hantaviren, die je etwa in der Hälfte der Erkrankungsfälle die fiebrige Nierenform (HFRS) und die sehr gefährliche Herz-Lungenform (HCPS) der Hantavirenkrankheit verursachen.[13] Der dominierende Erreger ist das 1998 in Argentinien identifizierte Andes-Virus (ANDV), das neben HPS/HCPS häufiger als das Sin-Nombre-Virus auch HFRS hervorruft.[14][15][16]
Diagnose
Die Diagnose einer Hantavirus-Infektion wird zum einen aufgrund des typischen Krankheitsbildes (siehe oben) und zum anderen aufgrund von spezifischen Laborwerten gestellt. Die direkte Erregerisolation ist im Tierversuch und in Zellkulturen zu Krankheitsbeginn möglich, aber ungebräuchlich. Der serologische Nachweis (d. h. Nachweis von Antikörpern gegen das Virus im Blut) wird im Immunfluoreszenztest und mittels ELISA erbracht. IgM-Antikörper sind nur einige Wochen nachweisbar, wohingegen die 14 Tage nach Krankheitsbeginn auftretenden IgG-Antikörper jahrelang bestehen bleiben können.
Therapie
Die Therapie ist vor allem symptomatisch und unterstützend mit ausreichender Flüssigkeitszufuhr, intensivmedizinischer Versorgung und Intubation bei Ausbildung eines akuten Lungenversagens bzw. mit einer Dialyse bei akuter Niereninsuffizienz.
Das antiviral wirksame Ribavirin zeigt im Laborversuch zwar eine gute Aktivität gegen Hantaviren, die therapeutischen Ergebnisse sind aber uneindeutig und die schweren Nebenwirkungen führen dazu, dass es in der Regel nicht verwendet wird.[12]
Vorsorge
Hygiene
Zur Infektionsverhütung können Nagetiere im Umfeld menschlicher Siedlungen bekämpft werden. Ist ein Kontakt nicht zu vermeiden, zum Beispiel beim Reinigen befallener Bereiche, wird empfohlen, Nagetierkadaver nur mit Einmalhandschuhen zu entfernen.[21] Ein Anfeuchten betroffener Flächen, beispielsweise in Schuppen oder Scheunen, vermindert das Aufwirbeln von Staub. Bei Reinigungsarbeiten sollten Mundschutz und Handschuhe getragen werden. Auch dicht schließende Mülleimer sowie regelmäßiges Reinigen und Lüften gehören zu den vom Robert Koch-Institut empfohlenen Vorbeugemaßnahmen.[4] Verschmutzte Flächen sollten nach dem Reinigen desinfiziert werden.[22]
Vorkommen
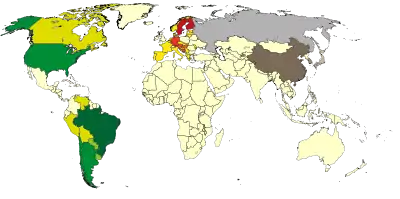
Europa (NE)
NE = Nephropathia epidemica
HFRS = Hämorrhagisches Fieber mit renalem Syndrom
HPS = Hantavirus-assoziiertes pulmonales Syndrom
Hantaviren sind weltweit verbreitet. Für die meisten Länder existieren aber keine genauen epidemiologischen Kennzahlen. Einen Eindruck vermittelt die nebenstehende Karte. Es ist davon auszugehen, dass viele Hantavirus-Infektionen, insbesondere in Ländern mit weniger entwickeltem Gesundheitssystem, nicht erkannt werden, da z. B. nicht an die Möglichkeit einer infektiösen Ursache gedacht wird.[3][5]
Asien
In China wurde am 24. März 2020 ein Todesfall und weitere Verdachtsfälle in der Provinz Yunnan gemeldet.[24]
Europa
Die höchsten Fallzahlen werden aus Schweden und Finnland gemeldet. In Mitteleuropa sind beispielsweise einige Regionen in Niedersachsen, Hessen, Bayern und Baden-Württemberg sowie in Österreich Teile der Steiermark als Endemiegebiete für das Puumala-Virus bekannt, während in Norddeutschland, vor allem aber in Ost- und Südosteuropa, das Dobrava-Belgrad-Virus endemisch ist. Besonders im Frühjahr kann es dadurch zu Erkrankungen mit plötzlichem Nierenversagen kommen.
Deutschland
Da Hantavirus-Erkrankungen in Deutschland erst seit 2001 meldepflichtig sind, liegen für die Erkrankungsraten aus früheren Jahren keine verlässlichen Daten vor. Etwa 1–2 Prozent der Bevölkerung weisen Hantavirus-spezifische Antikörper auf.[3] Die Zahl der gemeldeten Erkrankungen liegt jedoch weit darunter, was zum einen darauf hinweist, dass die Infektion häufig ohne klinische Symptome abläuft. Zum anderen wird aber auch bei entsprechenden klinischen Symptomen (Nierenschaden) nicht immer an eine infektiöse Ursache gedacht. Mit 2017 gemeldeten Fällen gehörten Hantavirus-Infektionen im Jahr 2010 zu den fünf häufigsten meldepflichtigen Viruserkrankungen in Deutschland (nach Noroviren (140519), Rotaviren (54051), Hepatitis C (5301) und Influenza (3468)). Auffällig sind die jährlich großen Unterschiede der Erkrankungsfälle: Während in einigen Jahren weit über 1000 Fälle gemeldet wurden, lagen die Fallzahlen in anderen Jahren zum Teil nur bei wenigen Hundert. Im Jahr 2006 wurden sogar nur 72 Erkrankungen gemeldet. 2016 wurden bundesweit 282 Fälle erfasst, 2017 hingegen 1731.[25][26] Auch regionale Unterschiede bestehen: Hohe Fallzahlen wurden 2007 und 2010 aus Baden-Württemberg von der Schwäbischen Alb gemeldet,[4] aber auch aus dem Bayerischen Wald, aus dem Spessart, aus Köln und aus dem Münsterland. Es wird ein Zusammenhang mit dem Vorkommen von Buchenwäldern vermutet, da sich die Rötelmaus von Bucheckern ernährt.[4] Im Frühjahr 2021 ist von einer Gruppe Wissenschaftler um Jörg Hoffmann in Deutschland die erste Infektion von Menschen mit einem Tula-Virus berichtet worden.[27] Tula-Viren, die zu den Hanta-Viren zählen, werden wahrscheinlich durch Feldmäuse übertragen und haben bei dem betroffenen 21-Jährigen zu einem akuten Nierenversagen geführt.[28]
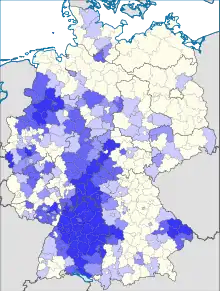
| Jahr | Anzahl der Infektionen* |
|---|---|
| 2001 | 182 |
| 2002 | 228 |
| 2003 | 144 |
| 2004 | 242 |
| 2005 | 447 |
| 2006 | 72 |
| 2007 | 1.687 |
| 2008 | 243 |
| 2009 | 181 |
| 2010 | 2.016 |
| 2011 | 305 |
| 2012 | 2.825 |
| 2013 | 161 |
| 2014 | 574 |
| 2015 | 829 |
| 2016 | 282 |
| 2017 | 1.731 |
| 2018 | 235 |
| 2019 | 1.757 |
| 2020 | 230 |
| 2021 | 1.664 |
| Gesamt | 16.003 |
| Quelle: RKI;[29] Stand: 6. Januar 2022* | |
*) nur klinisch-labordiagnostische Fälle
Österreich
In Österreich ist das Puumala-Virus das am häufigsten nachgewiesene Hantavirus.[30] In den Jahren 2004 bis 2011 wurden landesweit durchschnittlich 20 Infektionen bekannt, allerdings mit großen Unterschieden zwischen einzelnen Jahren. So gab es 2007 knapp 80 Infektionen. Im Jahr 2012 zeigte sich wie auch in Deutschland eine ungewöhnliche Häufung von Hantavirus-Infektionen; in den ersten sieben Monaten wurden schon 180 Fälle gezählt. Die Letalität wird mit 0,2 % angegeben.[31] Im Jahr 2011 wurde erstmals auch eine vermutlich in Österreich erworbene Infektion mit Dobravaviren diagnostiziert, die schwerere Krankheitsverläufe auslösen.[30] Die meisten der zwischen 1993 und 2010 dokumentierten Hantavirusinfektionen ereigneten sich in der Steiermark, in Kärnten (vor allem im Bezirk Wolfsberg), im südlichen Burgenland und im Bezirk Rohrbach in Oberösterreich. Aus den Bundesländern Tirol und Vorarlberg waren dagegen 2012 noch keine Fälle bekannt.[30]
Schweiz
In der Schweiz sind Hantavirus-Infektionen bisher nur als Einzelfälle beschrieben worden.[32]
Luxemburg
Es liegen keine Daten zu in Luxemburg erworbenen Hantavirus-Infektionen vor.
Vereinigte Staaten
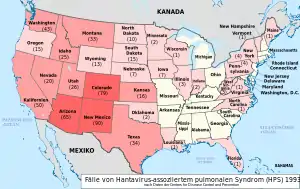

In den Vereinigten Staaten wurden zwischen 1993 und 2011 insgesamt 587 Fälle von Hantavirus-assoziiertem pulmonalem Syndrom registriert, wovon im Durchschnitt 37 % tödlich verliefen.[33] Ganz überwiegend sind die Bundesstaaten im Südwesten betroffen.
| Jahr | Anzahl der Infektionen | Tödlicher Ausgang (in Prozent) |
|---|---|---|
| 1993 | 48 | 56,3 |
| 1994 | 32 | 37,5 |
| 1995 | 24 | 41,7 |
| 1996 | 22 | 31,8 |
| 1997 | 23 | 21,7 |
| 1998 | 33 | 27,3 |
| 1999 | 43 | 32,6 |
| 2000 | 46 | 23,9 |
| 2001 | 11 | 27,3 |
| 2002 | 23 | 43,5 |
| 2003 | 31 | 29,0 |
| 2004 | 27 | 18,5 |
| 2005 | 34 | 29,4 |
| 2006 | 41 | 41,5 |
| 2007 | 29 | 41,4 |
| 2008 | 24 | 50,0 |
| 2009 | 20 | 25,0 |
| 2010 | 21 | 29,0 |
| 2011 | 24 | 50,0 |
| 2012 | 30 | 40,0 |
| Gesamt | 586 | 34,9 |
| Quelle: CDC | ||
Im Sommer 2012 kam es zu einer Reihe von HPS-Erkrankungen mit drei Todesfällen bei Touristen, die im kalifornischen Yosemite-Nationalpark übernachtet hatten.[34] Der genaue Ort der Infektion konnte bislang nicht ermittelt werden: Nachdem zunächst Nagetiere im Umfeld von Zeltkabinen verdächtigt wurden, trat ein weiterer Fall in einem anderen Teil des Parks auf. Daraufhin wurden im September 2012 alle Parkbesucher der Sommersaison gewarnt und aufgefordert, beim Auftreten von Symptomen einer Lungenerkrankung sofort ärztliche Hilfe zu suchen und auf den Parkbesuch hinzuweisen.[35][36]
Lateinamerika
Aus verschiedenen süd- und mittelamerikanischen Staaten sind Hantavirus-Infektionen dokumentiert. Hierzu zählen Argentinien, Bolivien, Brasilien, Chile, Ecuador, Paraguay, Panama, Uruguay und Venezuela.[7] In Mexiko, Kolumbien und Costa Rica wurden Hantaviren gefunden, die dem Sin-Nombre-Virus ähneln, aber beim Menschen anscheinend keine Erkrankung auslösen.[7] Die meisten Fälle traten in Brasilien auf. Die Letalität des Hantavirus-assoziierten pulmonalen Syndroms entsprach dort mit etwa 37 % derjenigen in den Vereinigten Staaten.[37]
In Argentinien und Chile dominiert das 1998 identifizierte Andes-Virus (ANDV), das sowohl die fiebrige Nieren-Form (HFRS) als auch die gefährliche Herz-Lungen-Form (HCPS) der Hantavirenkrankheit verursacht. In Chile wurden zwischen 1993 und 2001 204 HCPS-Erkrankungsfälle gezählt, von denen anfänglich mehr als die Hälfte, zuletzt etwa ein Drittel tödlich verliefen. In Argentinien, wo das Andes-Virus im Anschluss an die schweren HPS-Ausbrüche der Jahre 1995 und 1996 erstmals isoliert wurde, soll auch die Übertragbarkeit des Virus von Mensch zu Mensch beobachtet worden sein.[7][14][15][16]
Systematik
Nach ICTV mit Stand Herbst 2018 gliedert sich die Familie Hantaviridae wie folgt:
- Genus: Orthohantavirus[38]
- Spezies Amga orthohantavirus
- Spezies Andes orthohantavirus
- Spezies Asama orthohantavirus
- Asama-Virus
- Spezies Asikkala orthohantavirus
- Asikkala virus[39]
- Spezies Bayou orthohantavirus
- Bayou-Virus (BAYV) – HCPS.
- Catacamas-Virus (CATV)[41]
- Spezies Black Creek Canal orthohantavirus
- Black-Creek-Canal-Virus (BCCV) – HCPS
- Spezies Bowe orthohantavirus
- Spezies Bruges orthohantavirus
- Bruges-Virus
- Spezies Cano Delgadito orthohantavirus
- Cano-Delgadito-Virus (CALV) – keine humane Erkrankung assoziiert (khE)
- Spezies Cao Bang orthohantavirus
- Spezies Choclo orthohantavirus
- Choclo-Virus
- Spezies Dabieshan orthohantavirus
- Spezies Dobrava-Belgrade orthohantavirus (DOBV)
- Spezies El Moro Canyon orthohantavirus
- Spezies Fugong orthohantavirus
- Spezies Fusong orthohantavirus
- Spezies Hantaan orthohantavirus
- Spezies Jeju orthohantavirus
- Spezies Kenkeme orthohantavirus
- Spezies Khabarovsk orthohantavirus
- Khabarovsk-Virus (KHAV) – khE
- Topografov-Virus (TOPV)[41] – khE
- Spezies Laguna Negra orthohantavirus
- Spezies Luxi orthohantavirus
- Spezies Maporal orthohantavirus
- Spezies Montano orthohantavirus
- Montano-Virus
- Spezies Necocli orthohantavirus
- Spezies Oxbow orthohantavirus
- Oxbow-Virus
- Spezies Prospect Hill orthohantavirus
- Prospect-Hill-Virus (PHV) – khE
- Spezies Puumala orthohantavirus
- Spezies Rockport orthohantavirus
- Rockport-Virus
- Spezies Sangassou orthohantavirus
- Sangassou-Virus (SANGV) – vermutlich HFRS
- Spezies Seewis orhtohantavirus
- Seewis virus[39]
- Spezies Seoul orthohantavirus
- Seoul-Virus (SEOV oder SOUV) – HFRS[39]
- Spezies Sin Nombre orthohantavirus
- Sin-Nombre-Virus (SNV) alias Four-Corner-Virus, Muerto-Canyon-Virus, Convict-Creek-Virus[43][39] – HCPS
- New-York-Virus (NYV)[41]
- Blue-River-Virus
- Monongahela-Virus
- Spezies Thailand orthohantavirus
- Spezies Tula orthohantavirus
- Spezies Yakeshi orthohantavirus
- Genus: Loanvirus
- Spezies Longquan loanvirus (LQUV) in China
- Brünn-Virus alias Brno virus (BRNV) in Tschechien
- Genus: Mobatvirus
- Spezies Laibin mobatvirus (LBV) in China
- Spezies Nova mobatvirus
- Nova-Virus
- Spezies Quezon mobatvirus auf den Philippinen
- Genus: Thottimvirus
- Spezies Imjin thottimvirus
- Imjin-Virus (MJNV) befällt die Weißzahnspitzmaus Crocidura lasiura (en.: Ussuri white-toothed shrew)[45]
- Spezies Thottopalayam thottimvirus
- Thottopalayam-Virus (TPMV) – khE, befällt die Moschusspitzmaus Suncus murinus[45]
Die folgenden Viren der Gattung Orthohantavirus ohne Zuordnung einer Spezies werden vom ICTV wegen zu schlechter Datenlage nicht mehr gelistet:
- Isla-Vista-Virus (ISLAV) – khE, möglicherweise zu Puumala orthohantavirus,[43]
- Muleshoe-Virus (MULV) – khE
- Rio-Segundo-Virus (RIOSV)[43] – khE
Die folgenden Hantaviren von Fledermäusen wurden von ICTV noch nicht aufgenommen:[46][47]
- Spezies „Mouyassue-Virus“ („Mouyassué virus“, „MOYV“) in Sierra Leone, wahrscheinlich gleiche Spezies wie Magboi-Virus[48]
- „Magboi-Virus“ (MGBV) – Erstes Fledermaus-assoziiertes Hantavirus, in Sierra Leone und Elfenbeinküste, khE, wahrscheinlich zu „Mouyassue-Virus“
- „Huangpi-Virus“ (HUPV)[49] in China
- „Makokou-Virus“ (Makokou-Hantavirus, MAKV)[50] in Gabun
- „Xuan-Son-Virus“ (XSV)[51] in Vietnam
Weitere Vorschläge:
- „Azagny-Virus“ (AZGV) befällt die Weißzahnspitzmaus Crocidura obscurior (en.: African pygmy shrew)[45]
- „Bloodland-Lake-Virus“ (BLV), zu Puumala orthohantavirus[52][43]
- „Calabazo-Virus“[53]
- „Gou-Virus“[54]
- „Limestone-Canyon-Virus“[55]
- „Playa-de-Oro-Virus“ in Mexico,[56] befällt die Reisratten Oryzomys couesi und die Baumwollratte Sigmodon mascotensis[57]
- „Tanganya-Virus“ (TGNV)[58] befällt die Weißzahnspitzmaus Crocidura theresae (en.: Therese's shrew)[59]
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von Hantaviren namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes, soweit der Nachweis auf eine akute Infektion hinweist. Meldepflichtig sind vor allem die Leitungen der Labore usw. (§ 8 IfSG).
Hanta-Virus-Infektionen sind in Österreich gemäß § 1 Abs. 1 Nummer 2 Epidemiegesetz 1950 bei Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
In der Schweiz ist der positive und negative laboranalytische Befund zu einem Hanta-Virus meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldepflichtig ist das untersuchende Labor. Zudem ist die Erkrankung Hanta-Fieber meldepflichtig nach den genannten Normen und Anhang 1 der genannten Verordnung des EDI. Meldepflichtig sind Ärzte, Spitäler usw.
Literatur
- D. H. Krüger, R. G. Ulrich, J. Hofmann: Hantaviren als zoonotische Krankheitserreger in Deutschland. In: Deutsches Ärzteblatt International. Band 110, Nr. 27–28, 2013, S. 461–467, doi:10.3238/arztebl.2013.0461.
- Steffen Geis, Judith Koch, Helmut Uphoff, Anja M. Hauri: Aktuelles zu Hantaviren (PDF; 1,1 MB) – Hessisches Ärzteblatt 4/2009.
- Connie Sue Schmaljohn, S. T. Nichol, Stuart T. Nichol: Hantaviruses. Springer 2001, ISBN 3-540-41045-7.
- Christian G. Meyer: Tropenmedizin: Infektionskrankheiten. ecomed Medizin, Landsberg 2007, ISBN 978-3-609-16334-5, S. 64–66 (Auszug (Google))
- Matthew J. Hepburn, David P. Dooley: Hantaviruses. In: Robert H. Gates: Infectious Disease Secrets. Elsevier Health Sciences 2003, ISBN 1-56053-543-1, S. 409–414 (Auszug (Google))
- Lothar Zöller, Sandra Essbauer: Hantaviren. In: Lexikon der Infektionskrankheiten des Menschen: Erreger, Symptome, Diagnose, Therapie und Prophylaxe. Springer-Verlag, Berlin / Heidelberg 2012, ISBN 978-3-642-17157-4, S. 354–360 (Auszug (Google))
Weblinks
- RKI Merkblatt – Informationen zur Vermeidung von Hantavirus-Infektionen
- Konsiliarlabor für Hantaviren, Institut für Medizinische Virologie, Charité-Universitätsmedizin Berlin
- Hantavirus-Infektionen – Informationen des Robert Koch-Instituts
- Veterinärmedizinische Universität Wien – Bunyaviridae (im Webarchiv)
- Robert Koch-Institut: Abfrage der Meldedaten nach Infektionsschutzgesetz (IfSG) über das Web
- Bundesanstalt für Arbeitsschutz und Arbeitsmedizin: Berufliche Gefährdung der Landwirte durch Hantaviren
- waldwissen.net: Hantaviren – Informationen für Personen, die im Wald arbeiten
- Günter Stockinger: Gefährliches Hantavirus – Die Seuche kommt mit dem Wind auf Spiegel Online vom 29. August 2008
- Infektionen mit dem Hantavirus häufen sich
- ICTV Virus Taxonomy, 2016 release. Order: Bunyavirales, Family: Hantaviridae
- Lars Fischer: HANTAVIRUS: Warum gibt es immer mehr Hantainfektionen?, auf: spektrum.de vom 23. Juni 2017
- Detlev H. Krüger, Rainer G. Ulrich, Jörg Hofmann: Hantaviruses as Zoonotic Pathogens in Germany, in: Deutsches Ärzteblatt International 110(27–28) vom 8. Juli 2013, S. 461–467, doi:10.3238/arztebl.2013.0461, PMC 3722641 (freier Volltext), PMID 23964302
Einzelnachweise
- ICTV Master Species List 2018b v1 MSL #34, Feb. 2019
- ICTV: ICTV Taxonomy history: Akabane orthobunyavirus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Detlev Krüger: Hantavirus-Infektionen. (PDF; 66 kB) Gesellschaft für Virologie e. V., abgerufen am 10. Dezember 2018., in Web-Archiv, Archiv-Datum 26. April 2005
- Andreas Frey: Virus auf der Durchreise – Achtung, Maus: Das Hantavirus grassiert in Baden-Württemberg, es trifft aber nur Schwaben – warum? In: Badische Zeitung. 4. August 2010, gesundLEBEN, S. 29 (Online).
- Robert Koch-Institut (Hrsg.): Epidemiologisches Bulletin 24/2011: RKI-Ratgeber für Ärzte: Hantaviren. 20. Juni 2011 (rki.de [abgerufen am 22. September 2012]).
- P. Padula u. a.: Epidemic outbreak of Hantavirus pulmonary syndrome in Argentina. Molecular evidence of person to person transmission of Andes virus. In: Medicina (Buenos Aires), Jg. 2004, Heft 58-1, S. 27–36.
- Hantavirus: International HPS Cases. CDC, 29. August 2012, abgerufen am 12. Juni 2018 (englisch).
- Peter Reuter: Springer Klinisches Wörterbuch 2007/2008, 1. Auflage, Springer-Verlag, Heidelberg 2007, ISBN 978-3-540-34601-2, S. 1267.
- 2012 – ein erneutes Rötelmaus- und Hantavirusjahr? (Nicht mehr online verfügbar.) Friedrich-Loeffler-Institut, 23. März 2012, archiviert vom Original am 16. September 2012; abgerufen am 9. September 2012. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Lothar Zöller, Sandra Essbauer: Hantaviren. In: Lexikon der Infektionskrankheiten des Menschen. Erreger, Symptome, Diagnose, Therapie und Prophylaxe. Springer, 2012, S. 354–360 (hier: 356).
- Tracking a Mystery Disease: The Detailed Story of Hantavirus Pulmonary Syndrome (HPS). CDC, 29. August 2012, abgerufen am 4. September 2012 (englisch).
- Nicolas Barros, Shaunagh McDermott, Alexandra K. Wong, Sarah E. Turbett: Case 12-2020: A 24-Year-Old Man with Fever, Cough, and Dyspnea New England Journal of Medicine 2020, Band 382, Ausgabe 16 vom 16. April 2020, Seiten 1544–1553, doi:10.1056/NEJMcpc1916256
- Carlos Martínez: Ojo con el Virus Hanta. In: InfoGate, 2. Februar 2017, abgerufen am 11. Juni 2018 (spanisch).
- Constanza Castillo H., Gonzalo Ossa A.: Síndrome pulmonar por hantavirus Andes en Chile. In: Revista chilena de enfermedades respiratorias, Band 18, Nr. 1 (Januar 2002), doi:10.4067/S0717-73482002000100005.
- Andes-Virus. In: DocCheck Flexikon, abgerufen am 12. Juni 2018.
- Fact Sheet about Andes Virus. Centers for Disease Control and Prevention, letztes Review: Februar 2018, abgerufen am 12. Juni 2018.
- D. M. Custer, E. Thompson, C. S. Schmaljohn, T. G. Ksiazek, J. W. Hooper: Active and Passive Vaccination against Hantavirus Pulmonary Syndrome with Andes Virus M Genome Segment-Based DNA Vaccine. In: Journal of Virology. 2003 September, 77(18), S. 9894–9905, doi:10.1128/JVI.77.18.9894-9905.2003, PMC 224585 (freier Volltext)
- J. Klingström, K. I. Falk, Å. Lundkvist: Delayed viremia and antibody responses in Puumala hantavirus challenged passively immunized cynomolgus macaques. In: Archives of Virology. Volume 150, Number 1 / Januar 2005, doi:10.1007/s00705-004-0389-5, S. 79–92.
- Experimental Hantavirus Vaccine Elicits Strong Antibody Response in Primates (Memento vom 30. Dezember 2006 im Internet Archive) – News Release, U.S. Army Medical Research Institute of Infectious Diseases, Fort Detrick, Maryland
- D. H. Krüger, R. Ulrich, A. A. Lundkvist: Hantavirus infections and their Prevention. In: Microbes Infect. 2001 Nov;3(13), S. 1129–1244, PMID 11709294.
- RWTH Aachen, Universitätsklinikum, Virologie: Mäuse, Fieber, Hantaviren.
- Universitätsklinikum Aachen, www.ukaachen.de, aus: Aachener Nachrichten vom 18. Mai 2005: Uni-Klinikum spricht von „Mini-Epidemie“ (Memento des Originals vom 12. Januar 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- nach Daten von Douglas Goodin, Kansas State University, publiziert in: C. B. Jonsson, L. T. Moraes Figueiredo, O. Vapalahti: A Global Perspective on Hantavirus Ecology, Epidemiology, and Disease. In: Clin Microbiol Rev. 2010, 23(2), S. 412. doi:10.1128/CMR.00062-09
- Deutsche Wirtschaftsnachrichten, In China ist nun auch das Hanta-Virus ausgebrochen, erster Toter in Yunnan, abgerufen am 25. März 2020.
- Meldedaten nach Infektionsschutzgesetz (IfSG).
- Epidemiologisches Bulletin d. Robert Koch-Instituts 03/2018, 18. Januar 2018.
- Jörg Hoffmann et al.: Tula Virus as Causative Agent of Hantavirus Disease in Immunocompetent Person, Germany. Abgerufen am 9. März 2021.
- Erste Tulavirus-Infektion in Deutschland. Ärztezeitung, abgerufen am 24. März 2021.
- http://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2022/Ausgaben/01_22.pdf?__blob=publicationFile
- Stephan Aberle: Hantavirus Infektionen in Österreich. In: Department für Virologie der Medizinischen Universität Wien (Hrsg.): Virusepidemiologische Information. Nr. 08, 2012 (541 kB [PDF; abgerufen am 4. September 2012]). Online (Memento des Originals vom 10. Juli 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Hantavirus: Starke Zunahme in Österreich. In: Der Standard, 3. September 2012, abgerufen am 30. Juni 2018.
- Hanta-Virus-Infektionen. (Nicht mehr online verfügbar.) Eidgenössisches Departement des Innern: Bundesamt für Gesundheit, archiviert vom Original am 26. Juli 2013; abgerufen am 5. September 2012.
- Annual U.S. HPS Cases and Case-fatality, 1993-2011. Centers for Disease Control and Prevention, abgerufen am 1. September 2012 (englisch).
- Ronnie Cohen: Yosemite extends hantavirus warning; death toll rises. (Nicht mehr online verfügbar.) Reuters, 6. September 2012, archiviert vom Original am 26. November 2012; abgerufen am 9. September 2012 (englisch).
- National Park Service: Hantavirus in Yosemite, 13. September 2012.
- Todesfälle nach Hantavirus-Infektionen im Yosemite-Nationalpark: Pressemitteilung des Robert Koch-Instituts (RKI). Robert Koch-Institut, 17. September 2012, abgerufen am 5. Januar 2013.
- M. R. Elkhoury, M. Y. Wada, E. H. Carmo, E. J. A. Luna, A. N. S. M. Elkhoury, K. G. Teixeira, M. L. Nunes, N. P. Barbosa: Aspectos Epidemiológicos da Infecção e da Patogenicidade por Hantavírus no Brasil (PDF; 454 kB). In: Boletim eletrônico epidemiológico, 5. Jg., Nr. 3 (15. November 2005), S. 1–5.
- SIB: Orthohantavirus, auf: ViralZone
- Detlev H. Krüger, R. G. Ulrich, J. Hofmann: Hantaviruses as Zoonotic Pathogens in Germany, in: Dtsch Arztebl Int 110(27-28), 18. April 2013, : S. 461-467.
- U.S. Army Outbreak Investigation Reveals “Super-Spreader” Potential of Andes Virus, auf: SciTechDaily vom 7. Dezember 2020
- Piet Maes, Sergey V. Alkhovsky, Yīmíng Bào, Martin Beer, Monica Birkhead, Thomas Briese, Michael J. Buchmeier, Charles H. Calisher, Rémi N. Charrel, Il Ryong Choi, Christopher S. Clegg, Juan Carlos de la Torre, Eric Delwart, Joseph L. DeRisi, Patrick L. Di Bello et al.: Taxonomy of the family Arenaviridae and the order Bunyavirales: update 2018, in: Archives of Virology, Springer August 2018, Band 163, Ausgabe 8, Seiten 2295–2310, https://doi.org/10.1007/s00705-018-3843-5
- Boris Klempa, Tatjana Avsic-Zupanc, Jan Clement, Tamara K. Dzagurova, Heikki Henttonen: Complex evolution and epidemiology of Dobrava-Belgrade hantavirus: definition of genotypes and their characteristics. In: Archives of Virology. Band 158, Nr. 3, 23. Oktober 2012, ISSN 0304-8608, S. 521–529, doi:10.1007/s00705-012-1514-5, PMID 23090188, PMC 3586401 (freier Volltext).
- Brian Hjelle, M.D.: Hantaviruses, with emphasis on Four Corners Hantavirus, University of New Mexico School of Medicine, 14. März 1995, im WebArchiv
- doi:10.3238/arztebl.2013.0461
- Hae Ji Kang, Blaise Kadjo, Sylvain Dubey, François Jacquet and Richard Yanagihara: Molecular evolution of Azagny virus, a newfound hantavirus harbored by the West African pygmy shrew (Crocidura obscurior) in Côte d'Ivoire, in: Virology Journal2011 8:373, doi:10.1186/1743-422X-8-373
- Luiz Tadeu Moraes Figueiredo, Gilberto Sabino-Santos Jr, Ronaldo Bragança Martins, Felipe Gonçalves Motta Maia: Museum specimens of terrestrial vertebrates are sensitive indicators of environmental change in the Anthropocene, Januar 2019 (gepl.) PHILOS T R SOC B, online seit Juni 2018
- Petra Straková: 'Zoonotické viry u volně žijících endotermních obratlovců - Dizertační práce' (Dissertation über Viren bei wilden endothermen Wirbeltieren), MASARYKOVA UNIVERZITA, PŘÍRODOVĚDECKÁ FAKULTA, Brno 2017, Tab. 8: Shrnutí všech dosud publikovaných netopýřích a kaloních hantavirů (Eine Zusammenfassung aller bisher veröffentlichten Hantaviren von Fledermäusen)
- NCBI: Mouyassue virus (species)
- NCBI: Huangpi virus (species)
- NCBI: Makokou virus (species)
- NCBI: Xuan son virus (species)
- The Hantaviruses of Europe: from the Bedside to the Bench, 1st International Conference on Emerging Zoonoses, Jerusalem, Israel, 24.–28. November 1996, in: Emerging Infectious Diseases, Vol. 3, No. 2, April–June 1997, S. 205–211
- NCBI: Azagny virus (species)
- NCBI: Gou virus (species)
- NCBI: Limestone Canyon virus (species)
- NCBI: Playa de Oro hantavirus (species)
- Carolina Montoya-Ruiz, Francisco J. Diaz, Juan D. Rodas: Recent Evidence of Hantavirus Circulation in the American Tropic, in: Viruses 2014, 6(3), 1274–1293, {DOI|10.3390/v6031274}
- NCBI: Tanganya virus (species)
- ICTV 9th Report (2011)