Denguefieber
Das Denguefieber [ˈdɛŋge-], auch Dandyfieber, Polkafieber, Knochenbrecherfieber,[1] Siebentagefieber[2] und kurz Dengue ist eine Krankheit, deren Ursache eine Infektion mit dem Dengue-Virus ist. Bei dem Virus handelt es sich um ein 40 bis 60 nm großes, behülltes RNA-Virus mit positiver Polarität aus der Familie der Flaviviren.
| Klassifikation nach ICD-10 | |
|---|---|
| A90 | Denguefieber [Klassische Dengue] |
| A91 | Hämorrhagisches Denguefieber |
| ICD-10 online (WHO-Version 2019) | |
Das Virus wird durch den Stich einer Stechmücke übertragen und ist in tropischen und subtropischen Gebieten verbreitet. Die einzigen bekannten Wirte des Virus sind Primaten und verschiedene Stechmückenarten. Es existieren vier verschiedene Serotypen (Untergruppen) des Virus, die innerhalb der letzten 2000 Jahre in Asien sehr wahrscheinlich unabhängig voneinander von nichtmenschlichen Primaten auf den Menschen übersprangen.[1] Seit dem Zweiten Weltkrieg und der folgenden Globalisierung ist das Denguefieber unter anderem durch die Verbreitung seines Überträgers auf dem Vormarsch und wird oft auch als emerging disease (sich ausbreitende Krankheit) bezeichnet.[3] Bei Denguefieber handelt es sich um die sich am schnellsten ausbreitende, virale, von Stechmücken übertragene Krankheit; die Fallzahlen haben sich von 1960 bis 2010 verdreißigfacht.[4]
Die Krankheit äußert sich häufig mit unspezifischen Symptomen oder solchen, die einer schweren Grippe ähneln; es kann aber auch zu inneren Blutungen kommen. Bei einem schweren Krankheitsverlauf können ein sogenanntes „Hämorrhagisches Denguefieber“ (DHF) oder ein Dengue-Schock-Syndrom (DSS) auftreten, die beide zum Tode führen können. Die WHO schätzt, dass jährlich 50 bis 100 Millionen Personen erkranken, 500.000 Personen einen schweren Krankheitsverlauf durchleiden und 22.000 Personen an Denguefieber sterben; die meisten der Todesopfer sind Kinder. Wissenschaftler aus Oxford und Heidelberg berichteten im April 2013 in der Zeitschrift Nature, dass sich tatsächlich aber laut ihren Untersuchungen jährlich rund 390 Millionen Menschen mit dem Erreger des Dengue-Fiebers infizierten.[5]
Lange gab es gegen die Erkrankung keine spezifische antivirale Behandlung. Ende 2015 wurde der erste Impfstoff „Dengvaxia“ von Sanofi zugelassen, der gegen alle vier Varianten des Virus wirksam sein und einen Impfschutz von 93 % bieten soll.[6] Allerdings zeigten spätere Studien, dass diejenigen, die nie an Dengue-Fieber erkrankt waren und dann mit „Dengvaxia“ geimpft wurden, sich später dennoch infizieren und dann sogar stärkere Symptome entwickeln können als Personen, die nicht geimpft wurden.[7] In Deutschland, Österreich und der Schweiz besteht eine Meldepflicht bei Verdacht, Erkrankung, Tod, direktem und indirektem Erregernachweis oder hämorrhagischem Krankheitsverlauf.
Erreger
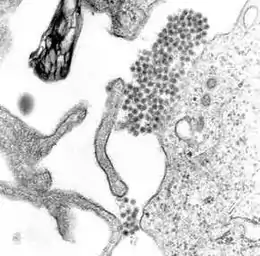
Denguefieber wird durch einen der vier Serotypen (DENV-1 bis DENV-4) des Dengue-Virus verursacht, es handelt sich um ein rundes behülltes Virus mit einem Durchmesser von 40 bis 60 nm aus der Familie der Flaviviren. Das virale Genom besteht (im Gegensatz zu der von allen Lebewesen verwendeten DNA) aus Ribonukleinsäure (RNA). Das Genom ist etwa 11.000 Nukleotide lang und ist positivsträngig, kann also von Ribosomen direkt abgelesen und mit dessen Information ein Protein (Aminosäurenkette) gebildet werden. Das Genom umfasst nur einen offenen Leserahmen, der für ein Polyprotein codiert (eine lange Aminosäurekette, die nachher noch in die einzelnen funktionalen Proteine geschnitten werden muss).[8]
Während einer Infektion heften sich die Viren über spezifische Rezeptoren an der Zelloberfläche einer Wirtszelle an und werden durch ein sich ausbildendes Endosomvesikel aufgenommen. Normalerweise dienen diese Vesikel dazu, Stoffe zu verdauen, das Virus nutzt sie aber als Transportmöglichkeit, um ins Innere der Zelle zu gelangen. Im Innern des Endosoms induziert der saure pH-Wert die Fusion von Endosommembran und Virushülle, was dem Virus-Inhalt erlaubt, ins Zytosol einzudringen. Danach wird das virale Genom im rauen Endoplasmatischen Retikulum (ER) und in so genannten vesicle packets repliziert, und nach einer Reifung im Golgi-Apparat entstehen infektiöse Viruspartikel. Diese verlassen die Zelle und befallen weitere Wirtszellen.[8]
Die vier unterschiedlichen Serotypen kommen entweder in abgegrenzten oder sich überlappenden Endemiezonen vor. Phylogenetische Analysen erlauben es, die einzelnen Serotypen in Genotypen zu unterteilen. Dabei werden DENV-1 und DENV-2 in jeweils fünf, DENV-3 und DENV-4 in jeweils vier Genotypen unterteilt. Molekularbiologische Untersuchungen ergaben, dass sich die endemischen Genotypen von den in Wäldern oder im Dschungel vorkommenden (silvatischen) Genotypen in den letzten 2000 Jahren abspalteten. DENV-2 sprang danach vor ungefähr 1000 Jahren auf den Menschen über, DENV-4 vor 600 Jahren und DENV-1 vor 200 Jahren (alle Angaben ±50 %). Von DENV-3 wurde bisher kein silvatischer Stamm isoliert, und folglich ist auch keine Aussage über einen möglichen Zeitpunkt der Abspaltung des Virus möglich.[1]
Übertragung

Die wichtigsten Überträger (Vektoren) der Denguefieberviren sind die Weibchen der Gelbfiebermücke (Aedes aegypti, auch Ägyptische Tigermücke oder Denguemücke genannt, Synonym Stegomyia aegypti) und der sich auch in Europa ausbreitenden Asiatischen Tigermücke (Aedes albopictus, Synonym Stegomyia albopicta).[9] In bestimmten Regionen kommen weitere Mückenarten als Überträger von Denguefieber infrage, z. B. die Polynesische Tigermücke (Aedes (Stegomyia) polynesiensis) im südlichen Pazifik[10] oder Aedes (Stegomyia) scutellaris in Neuguinea.[11] Bei anderen Mückenarten wurde ebenfalls eine Eignung zur Erregerübertragung (Vektorkompetenz) gezeigt.[12][13]
Wie bei anderen von Stechmücken übertragenen Arboviren wird das Dengue-Virus von einer weiblichen Stechmücke, die das Blut einer infizierten Person saugt, aufgenommen. Dabei gelangen die Viren in den Magen der Mücke und falls die Viruskonzentration hoch genug ist, können die Virionen die Magenepithelzellen befallen und sich dort vermehren. Von dort gelangen sie ins Hämozöl (das Blutsystem der Mücke) und weiter in die Speicheldrüsen. Wenn die Mücke das nächste Mal Blut saugt, injiziert sie ihren Speichel in die Wunde, womit das Virus in den Blutkreislauf des gestochenen Primaten gelangt. Es gibt auch Hinweise für eine vertikale Infektion des Dengue-Virus, also die Übertragung von der weiblichen Mücke auf ihr Gelege und damit die Larven.[12][13][14][15] Diese Infektion der Vektoren ohne vorherige Blutmahlzeit scheint bei der Aufrechterhaltung eines Virusreservoirs zwischen einzelnen Ausbrüchen eine Rolle zu spielen.[16]
Es existieren zwei epidemiologisch unterscheidbare Infektionszyklen,[1] in denen das Virus von Mücken auf Menschen oder andere Primaten übertragen wird. Am sogenannten urbanen Zyklus sind die Gelbfiebermücke und die Asiatische Tigermücke beteiligt, welche gut an große urbane Zentren angepasst sind und dort neben Denguefieber auch weitere Krankheiten übertragen.
Neben dem urbanen Zyklus existiert sowohl in Afrika als auch in Asien, sehr wahrscheinlich aber nicht in Amerika, ein silvatischer Zyklus (Waldzyklus oder Dschungelzyklus), in dem die Mücken Aedes (Diceromyia) furcifer und Aedes (Stegomyia) luteocephala als Vektor dienen. Dabei werden im Dschungel hauptsächlich nicht-humane Primaten infiziert. Während in Afrika ausschließlich DENV-2 silvatisch zirkuliert, ist dies in Asien sehr wahrscheinlich bei allen vier Serotypen der Fall. Es gibt keinen Hinweis, dass der silvatische Zyklus an vergangenen Dengueepidemien beteiligt war, es ist aber bekannt, dass die Erreger des silvatischen Zyklus auch Menschen infizieren können.[1]
Verbreitung
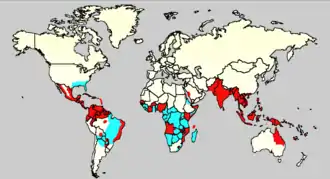
Denguefieber ist in tropischen und subtropischen Gebieten endemisch, wobei 75 % der globalen Fälle von Dengue auf die Region Asien/Pazifik entfallen.[4] Zu den Hauptverbreitungsgebieten gehören Lateinamerika, Zentralafrika, Indien, Südostasien, Teile des Pazifiks (u. a. Neukaledonien und Hawaii[17]) und der Süden der USA.
Weltweit lebt ungefähr die Hälfte aller Menschen in endemischen Gebieten, und die offiziellen Schätzungen der WHO belaufen sich auf jährlich 50 bis 100 Millionen Erkrankungen, 500.000 schwere Krankheitsverläufe und 22.000 Todesfälle. In Asien entfallen über 90 % der schweren Erkrankungen auf Kinder.[3][18] Laut Angaben der WHO hat sich die Zahl der Erkrankungen von 2000 bis 2010 ungefähr verdoppelt. Laos und die Philippinen seien von dieser Entwicklung besonders betroffen.
In Europa ist Dengue nicht endemisch, mit Ausbreitung der Überträgermücken Aedes aegypti und vor allem Ae. albopictus steigt aber das Risiko vor Ort (autochthon) übertragener Infektionen, die von importierten Fällen ausgehen. So kam es zwischen September 2012 und März 2013 auf der portugiesischen Atlantikinsel Madeira zu einem Dengue-Ausbruch mit 1.080 nachgewiesenen Fällen. Es gab keine schweren klinischen und keine Todesfälle. Die Überträgermücke war Aedes aegypti, die 2005 auf die Insel eingeschleppt worden war.[19] Die Asiatische Tigermücke Aedes albopictus ist inzwischen in Südeuropa weit verbreitet und dehnt ihr Siedlungsgebiet weiter aus. Im Jahr 2010 traten erste autochthone Denguefieber-Fälle in Südfrankreich und in Kroatien auf.[20] 2013 wurde in der Nähe von Aix-en-Provence (Südfrankreich) eine weitere vor Ort übertragene Dengueinfektion nachgewiesen.[21] Im August 2015 wurden im südfranzösischen Nîmes zwei autochthon erworbene Fälle von Dengue entdeckt.[22] Im Oktober 2018 wurden weitere fünf autochthon erworbene Fälle in Saint-Laurent-du-Var bekannt.[23]
Symptome
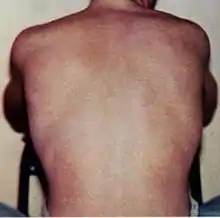
Dengue wird durch einen Mückenstich übertragen und hat eine Inkubationszeit von 3 bis 14 Tagen. Die meisten Fälle verlaufen mild („oligosymptomatisch“, also mit wenigen Symptomen einhergehend), wie oft bei einem grippalen Infekt beobachtet. Die Symptome umfassen Fieber (bis 40 °C) mit Schüttelfrost und starken Kopf-, Muskel- und Gliederschmerzen. Zusammen mit einem Ausschlag (Exanthem) werden diese Symptome auch als Denguetrias bezeichnet. Als Spätmanifestation kann es bis zu zwei Monate nach Krankheitsbeginn zu einem diffusen Haarausfall kommen.[24]
Die Krankheit klingt bei den meisten Patienten nach 3 bis 7 Tagen wieder ab. In 2 bis 4 Prozent[18] der Fälle nimmt die Krankheit jedoch einen schweren Verlauf und ein Dengue-Hämorrhagisches Fieber (DHF) oder ein Dengue shock syndrome (DSS) tritt auf. Die Sterblichkeitsrate dieser schweren Verläufe beträgt 1 bis 5 Prozent, kann aber bei einzelnen Epidemien auch 15 Prozent erreichen.[18]
Das hämorrhagische Denguefieber (DHF) ist ein akutes Schocksyndrom mit Hämorrhagien, in dessen Verlauf die Durchlässigkeit (Permeabilität) der Blutgefäßwände größer wird und deshalb unkontrollierte Blutungen auftreten. Die hämorrhagische Form beginnt wie das normale Denguefieber, der Zustand der Erkrankten verschlechtert sich aber nach 2 bis 6 Tagen dramatisch. Der Blutkreislauf bricht zusammen und es kommt zur Rötung des Gesichtes, zu (inneren) Blutungen, Flüssigkeitsverlust, hirnbedingten (zerebralen) Krampfanfällen, Koma, Zahnfleischbluten, Bluterbrechen, Teerstuhl, einem Anschwellen der Leber und den allgemeinen Zeichen eines Schocks (Tachykardie, Hypotonie, kaltschweißige Haut, Blässe). Zusätzlich können in dieser Phase disseminierte Petechien auftreten. Dies sind mikrozirkuläre Einblutungen der Haut, die als rote Punkte auffallen.
Wird die Infektion überstanden, besteht für kurze Zeit Immunität gegen alle Serotypen und lebenslange Immunität gegen den infizierenden Stamm.[4]
Infektionsverstärkende Antikörper
Während der Infektion mit einem der vier Dengue-Serotypen (DENV-1, DENV-2, DENV-3 und DENV-4) werden nur Antikörper gegen diesen bestimmten Serotypen produziert. Dabei bleibt die infizierte Person weiterhin durch Viren eines anderen Serotyps angreifbar.
Bei einer Zweitinfektion durch ein Virus eines anderen Serotyps sind die Antikörper gegen den ersten Serotyp – die durch eine vorangegangene Erkrankung erworben oder von Müttern auf ihre Kinder übertragen werden können – nicht in der Lage, die neuen Virionen zu neutralisieren. Stattdessen bilden sich Antikörper-Viren-Komplexe, welche von Makrophagen aufgenommen werden, von diesen aber nicht vernichtet werden, sondern den Viren erlauben, sich weiter zu vermehren. Dies führt bei einer Zweitinfektion zu einer höheren Viruslast als bei einer Erstinfektion (man spricht bei diesen unwirksamen Antikörpern von infektionsverstärkenden Antikörpern oder ADE für Antibody-dependent enhancement of infection). Auf der molekularen Ebene wird beobachtet, dass Zellen mit Fcγ-Rezeptoren oder Komplementrezeptoren bei niedrigen Antikörperkonzentrationen besonders anfällig für das Virus sind. So wird erklärt, wieso Kinder, deren schützende mütterliche Antikörperkonzentration gerade abnimmt, besonders oft von DHF betroffen sind. Weiterhin wird vermutet, dass die Antikörper gegen einen bestimmten Virusstamm einen zweiten Stamm mit reduzierter Avidität binden und deshalb ebenfalls zu einer ADE führen. Eine mögliche Erklärung für dieses Phänomen ist, dass die Antikörper dazu führen, dass das Virus effizienter an die Zelle bindet.[25]
Diese Hypothese wird als sehr wahrscheinlich angesehen, wie folgendes Beispiel aus Kuba zeigt: 1977 hatte eine DENV-1-Epidemie die Insel erfasst und 44 % der Bevölkerung infiziert, wobei nur milde Symptome beobachtet wurden. 1981 wurde dann eine DENV-2-Epidemie mit mehr als 10.000 Fällen von DSS/DHF registriert. Die Todesrate von Kindern im Alter von 3 bis 14 Jahren war fast 15-mal höher als die von Erwachsenen. 2001 brach eine DENV-3-Epidemie in Havanna aus. Es waren nur Erwachsene von DSS/DHF betroffen, da die Kinder zu jung waren, um die DENV-2-Epidemie von 1981 erlebt zu haben.[18]
Diagnose
Die klinische Diagnosestellung ist wegen der Vielzahl der möglichen Erreger für Infektionskrankheiten mit ähnlichen Anfangssymptomen schwierig. Sporadische und nur milde Verläufe sind nur durch eine virologische Untersuchung sicher zu erkennen.
Bei Verdacht auf eine Infektion kann das Dengue-Virus mittels reverser Transkriptase-Polymerase-Kettenreaktion (RT-PCR) nachgewiesen werden, bei der das Erbgut des Virus vervielfältigt und damit direkt nachgewiesen wird.[18] Der direkte Erregernachweis kann auch über eine Virusisolierung mittels Anzucht in der Zellkultur erfolgen, wobei dieses Verfahren ein bis vier Wochen dauern kann. Beide Verfahren werden mit Blutplasma durchgeführt, die PCR auch mit Blutserum. Serologisch kann ein enzymgekoppelter Immunadsorptionstest in der akuten Phase meist keine Dengue-spezifischen IgM-Antikörper nachweisen, aber bei Positivität nach Abklingen der Symptome die Diagnose bestätigen. Der spezifische IgG-Titer kann zwischen einer Erstinfektion und einer Zweitinfektion unterscheiden (bei einer Erstinfektion treten in den ersten 8 Tagen keine IgG-Antikörper auf). Ein vierfacher Anstieg des spezifischen Antikörpertiters im Vergleich zu einer Vorprobe gilt als sicherer Nachweis. Da die serologischen Testverfahren häufig auch mit anderen Flaviviren kreuzreagieren, sind diese indirekten Verfahren jedoch nie beweisend für eine Infektion.[18]
Antigen-Tests basierend auf dem direkten Nachweis des NS1-Proteins (das innerhalb der vier Serotypen stark konserviert ist) sind ebenfalls kommerziell erhältlich. Sie zeichnen sich durch ihre einfache Handhabung (kein Labor notwendig) aus,[18] sind aber deutlich weniger sensitiv und spezifisch als aufwendigere Testverfahren.
Der Umgang mit sämtlichem Untersuchungsmaterial des Patienten, insbesondere Blut, unterliegt strengen Sicherheitsvorschriften und darf nur in Laboren der Schutzstufe 3 durchgeführt werden.
Differentialdiagnose
Bei Verdacht auf Dengue-Fieber sollten andere virale (Influenza, Masern, Rubella, Chikungunyafieber, Gelbfieber und Japanische Enzephalitis) und bakterielle (Typhus, Leptospirose, Sepsis, Meningokokken und Rickettsien) Erkrankungen sowie Malaria ausgeschlossen werden.[18]
Nach Empfehlungen der WHO sollte das Blut eines Patienten mit Verdacht auf Denguefieber immer dann auf Antikörper gegen das Chikungunya-Virus untersucht werden, wenn eine Infektion mit Dengueviren nicht nachgewiesen werden kann und der Patient sich in einem Gebiet aufgehalten hat, in dem das Chikungunyafieber vorkommt.[26]
Meldepflicht
Dengue-Fieber ist in Österreich gemäß § 1 Abs. 1 Z 1 Epidemiegesetz 1950 bei Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz).
In der Schweiz besteht Meldepflicht bei positiven laboranalytischen Befunden für die Erkrankung Dengue-Fieber bzw. für den Erreger Dengue-Virus durch Ärzte, Spitäler usw. bzw. durch das untersuchende Labor. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
In Deutschland ist Denguefieber gemäß § 6 Infektionsschutzgesetz (IfSG) bei Verdacht auf ein virusbedingtes hämorrhagisches Fieber[27] bzw. gemäß § 7 IfSG bei Nachweis des Krankheitserregers Dengue-Virus seitens des Arztes bzw. des Labors namentlich meldepflichtig. Meldepflichtig sind im zweiten Fall vor allem die Leitungen der Labore usw., nur bei hämorrhagischem Fieber auch der feststellende Arzt (§ 8 IfSG).
Behandlung
Für Denguefieber existiert wie für alle von Flaviviren ausgelösten Krankheiten keine ursächliche Therapie. In schweren Fällen ist eine Einweisung in ein Krankenhaus (Hospitalisierung) vorzunehmen und aufgrund des in manchen Fällen sich schnell verschlechternden Krankheitszustandes ist eine intensivmedizinische Überwachung angebracht. Eine symptomatische Behandlung umfasst Maßnahmen zur Flüssigkeitsauffüllung (Rehydratation) und Gabe von Mitteln wie Paracetamol zur Schmerzlinderung. Auf Acetylsalicylsäure (z. B. Aspirin) ist aufgrund ihrer gerinnungshemmenden Wirkung zu verzichten, da diese im Falle von inneren Blutungen, die bei Denguefieber auftreten können, verheerende Folgen für den Patienten hat. Weiterhin kann die frühe, intravenöse Gabe von Flüssigkeit von entscheidender Bedeutung sein.[18]
Vorbeugung
Als Larvenbiotope reichen unverschlossene Wasserbehälter und kleine Mengen stehenden Wassers aus, das sich in Eimern, Dosen, Flaschen, Autoreifen oder Plastikfolien sammelt. Zudem sind die Eier der Tigermücken trockenresistent und können so Trockenzeiten überdauern. All dies erschwert es, die Mücken zu bekämpfen.
Die persönlichen Vorbeugemaßnahmen gegen Denguefieber umfassen das Vermeiden von Mückenstichen in Gebieten, in denen Denguefieber endemisch vorkommt. Institutionelle Maßnahmen zur Prävention von Denguefieber umfassen Maßnahmen zur Kontrolle der krankheitsübertragenden Stechmücken.
Persönliche Vorbeugung
Stiche können insbesondere durch geeignete Kleidung und Repellentien wie mückenabweisende Sprays vermieden werden. Da die erwachsenen Tigermücken tagaktiv sind, kann man sich nur beschränkt durch Bettnetze schützen, die beispielsweise gegen Malaria wirkungsvoll sind. Mückenabweisende Sprays mit einem hohen DEET-Gehalt können das Risiko eines Stiches weiterhin vermindern.
Impfung
Strategische Vorbeugung


Obwohl es seit Ende 2015 einen ersten Impfstoff gegen Dengueviren gibt, kommt aber nach wie vor der Bekämpfung der Überträgermücken eine zentrale Rolle zu. Die Gelbfiebermücke Stegomyia aegypti brütet bevorzugt in Wasseransammlungen, die von Bewohnern in Gebieten mit problematischer Trinkwasserversorgung selbst angelegt wurden oder die sich im Hausmüll ansammeln; insbesondere in Reifen, aber auch in alten Dosen und Plastikgefäßen. Besonders in der Nähe von urbanen Zentren von Entwicklungsländern sind diese Bedingungen oft anzutreffen und bilden ein ausgezeichnetes Habitat für die Gelbfiebermücke. Bei der Bekämpfung der Mücke werden zwei Strategien verfolgt:
- Bekämpfung der sich entwickelnden Larven. Eine der zurzeit wichtigsten Strategien fußt auf der möglichst umfassenden und durch die Allgemeinheit unterstützten Beseitigung der Larvengewässer.[28] Neben Maßnahmen zur Verminderung der Larvengewässer werden vor allem chemische Larvizide sowie larvenfressende Fische und Ruderfußkrebse[29] (Copepoda) eingesetzt, welche direkt die Anzahl der Larven und somit indirekt die Anzahl der krankheitsübertragenden Mücken verringern. Die vietnamesische Regierung experimentiert seit 1998 systematisch mit Ruderfußkrebsen der Gattung Mesocyclops zur biologischen Kontrolle der Denguefieber-Erreger. Dies führte dazu, dass in den betroffenen Gebieten zwischen 2002 und 2005 kein Fall von Denguefieber mehr auftrat.[30] Das erfolgreiche Programm wurde in der Folge auf weitere Regionen ausgeweitet, unter Einbeziehung der Lokalbevölkerung. Als chemisches Larvizid wird vorwiegend Pyriproxyfen empfohlen, da es für Menschen ungefährlich und bereits in kleinen Mengen wirksam ist.[18]
- Bekämpfung der erwachsenen Gelbfiebermücken. Dabei werden Vorhänge und Abdeckungen von Wasserbehältern mit Insektizid behandelt. Sie töten ruhende oder auf der Suche nach Eiablagegewässern befindliche Mückenweibchen.[31] Weiterhin kann Insektizid in den Innenräumen versprüht werden, was aber von der WHO nicht empfohlen wird.[18] Eine neuere Methode ist der Einsatz spezieller, für den Fang von Tigermücken optimierter Fallen mit einer Lockstoffmischung.[32]
- die Verbreitung von Mücken, die durch Bakterien der Art Wolbachia pipientis gegen das Virus immunisiert sind.[33][34] In einer Studie um die Forschungsgruppe von Adi Utarini mit mehr als 8000 Freiwilligen in der indonesischen Stadt Yogyakarta reduzierte sich mit dieser Methode die Zahl der Infektionen um 77 Prozent, die Zahl der Krankenhauseinweisungen wegen Denguefieber ging um 86 Prozent zurück.[35][36]
Weitere Ansätze sind:
- die Ausbringung genetisch veränderter Männchen der Gelbfiebermücke.[37][38] Gegen die Freisetzung von etwa 10 Millionen gentechnisch veränderten männlichen Mücken in Brasilien gab und gibt es zahlreiche Bedenken.[39]
- ein parasitärer Pilz (Beauveria bassiana), der die Mücken tötet oder schwächt.[40]
- die systematische Verfolgung und physische Tötung in den Haushalten. Ruhende Stechmücken können mit geeigneten Gegenständen (z. B. Fliegenklatsche), fliegende mit etwas Übung mit den Händen oder mit einer elektrischen Fliegenklatsche unschädlich gemacht werden.
Geschichte
Die Herkunft des Namens dengue ist nicht eindeutig geklärt. Eine frühe Bezeichnung dafür war dandy fever; später kam die spanische Bezeichnung dengue auf, welche auf eine schmerzbedingte, auffällig eigenartige Veränderung der Körperhaltung und Verhaltensweise bei erkrankten Personen hindeutet. Nach anderen Quellen kommt dengue aus dem afrikanischen Sprachraum (Swahili: dinga) und steht für einen Krampfanfall, welcher von einem bösen Geist ausgelöst wird.[1][41]
Die erste Erwähnung der Krankheit wird von manchen bereits in der chinesischen Jin-Dynastie (265–420) und auch später noch im 1. Jahrtausend unserer Zeitrechnung gesehen. Die nächsten Berichte von Denguefieber gab es aus Panama (1635, 1699), Jakarta (1779–1788), Kairo (1881, 1883), Philadelphia (1789) und Spanien (1881) und zeigen die weite Verbreitung der Krankheit zu diesem Zeitpunkt.[1]
1927–1929 wütete eine Dengueepidemie in Griechenland mit mehr als einer Million infizierten Personen – die letzte Epidemie vor der Ausrottung der Gelbfiebermücke (Stegomyia aegypti) im Mittelmeerraum und dem Verschwinden von Dengue aus diesem Gebiet.[1] Die Mobilität von Truppen während des Zweiten Weltkriegs führte zu größeren Dengueepidemien zwischen 1941 und 1945. Bereits in den 1960er Jahren stieg die Verbreitung des Virus stark an und die vier Serotypen zirkulierten in Asien. In den 1990er Jahren war die globale Verbreitung von Dengue abgeschlossen, verursacht insbesondere durch die Aufgabe der Vektorkontrollprogramme, vermehrter Urbanisierung und Globalisierung (individuelle Mobilität). 1998 wurde eine weltweite Pandemie mit mehr als 1,2 Millionen Fällen in 56 Ländern registriert.[42] Dengue befindet sich auf dem Vormarsch und wird als emerging disease (sich ausbreitende Krankheit) bezeichnet.[1][3]
Durch eine Politik der Vektorkontrolle gingen die Denguefallzahlen während der 1960er und 1970er Jahre auf dem amerikanischen Kontinent zurück. Seit den 1980er Jahren steigt die Anzahl der Denguefieberfälle in Südamerika jedoch wieder an und die Gelbfiebermücke ist in die urbanen Zentren in Südamerika zurückgekehrt, unter anderem weil die Vektorkontrollprogramme aufgegeben wurden.[43] Auf dem amerikanischen Kontinent folgten größere Ausbrüche von Denguefieber in Brasilien (2002, 2007), Paraguay (2007) und Mexiko (2007).[1] In einigen Ländern ist eine Folge von Epidemien zu beobachten, bei welchen sich die Serotypen jeweils abwechseln. So waren in Kuba Ausbrüche in den Jahren 1977 (DENV-1), 1981 (DENV-2) und 2001 (DENV-3) und in Brasilien Ausbrüche in den Jahren 1986 (DENV-1), 1990/1998 (DENV-2), 2002–2005 (DENV-3) sowie 2007/2008 (DENV-2)[44] zu verzeichnen.
2019 waren in Süd- und Mittelamerika Brasilien, Mexiko, Nicaragua, Kolumbien und Honduras am stärksten betroffen.[45]
Forschung
Im 20. Jahrhundert wurden die ersten Schritte zur Identifizierung und Bekämpfung des Erregers der Krankheit unternommen. Nach der erfolgreichen wissenschaftlichen Untersuchung des Gelbfieber-Virus durch Finlay, Reed und andere wurde die Aufmerksamkeit auf das Denguefieber gelenkt. Percy[46] M. Ashburn und Charles F. Craig zeigten 1907, dass Denguefieber durch einen nichtfiltrierbaren Faktor verursacht wird, also ein Virus genauso wie Gelbfieber.[47] Stegomyia aegypti wurde 1926 von Joseph Franklin Siler, Milton W. Hall und Arthur Parker Hitchens als Vektor identifiziert.[1]
Ende der 1960er Jahre und Anfang der 1970er Jahre stellte Scott B. Halstead seine Hypothese zu infektionsverstärkenden Antikörpern auf, die besagt, dass eine Zweitinfektion gefährlicher sein kann als eine Erstinfektion. 1970 wurde durch Isolation eines Virus aus einem Menschen die Hypothese bestätigt, dass silvatische Erreger auch Menschen infizieren können.[1]
Denguefieber wurde von der US-amerikanischen Regierung als potentielle biologische Waffe untersucht.[48] Dieses Programm wurde 1970 offiziell eingestellt.[49] Dennoch wurden die Vereinigten Staaten beschuldigt, für den Ausbruch von Dengue im Jahr 1981 in Kuba verantwortlich zu sein.[50][51]
Die von privaten und öffentlichen Stellen finanzierte sogenannte Pediatric Dengue Vaccine Initiative versucht, einen sicheren Dengue-Virus-Impfstoff zu entwickeln. Verschiedene Impfstämme befinden sich bereits erfolgreich in den klinischen Testphasen I, II[52] und III.[53] Der französische Pharmakonzern Sanofi Pasteur MSD hat im Oktober 2010 erklärt, bis 2015 einen Impfstoff zu entwickeln.[54] Dieser tetravalente Impfstoff gegen alle vier bekannten Subtypen von Dengue ist mittlerweile bereits in einer Phase-III-Studie erfolgreich getestet worden.[55] Andere Forscher versuchten mit Hilfe von Wolbachia die Übertragung zu stoppen.[56]
Als erstes mögliche Gegenmittel gegen das Dengue-Fieber haben Forschende bei der Überprüfung tausender Wirkstoff-Kandidaten durch Tests in Zellkulturen und an lebenden Mäusen einen Wirkstoff mit der Bezeichnung JNJ-A07 entdeckt, der das Dengue-Virus und die von diesem verursachte Erkrankungen effektiv bekämpfen und auch zur Vorbeugung eingesetzt werden kann.[57] Der gefundene Hemmstoff blockiert dabei die Interaktion zwischen zwei Virenproteinen des Erregers, die für seine Replikation entscheidend sind, und verhindert damit seine Vermehrung. Bei Tests in Menschen- und Mosquito-Zellen hat sich gezeigt, dass „JNJ-A07“ sehr effektiv gegen alle vier Untergruppen des Dengue-Virus eingesetzt werden könnte. Laut dem Forscherteam sind bis zum Einsatz in der Praxis aber noch weitere Untersuchungen, Experimente und vor allem klinische Studien an Menschen erforderlich.
Literatur
- World Health Organization (Hrsg.): Dengue – Guidelines for Diagnosis, Treatment, Prevention and Control – New edition. 2009, ISBN 978-92-4154787-1 (englisch, who.int).
- T. Scott, R. Velayudhan: Handbook for clinical management of dengue – WHO and Special Programme for Research and Training in Tropical Diseases (TDR) report. World Health Organization, Genf 2012, ISBN 978-92-4150471-3 (englisch, who.int).
- David W. Kimberlin, Elizabeth D. Barnett, Ruth Lynfield, Mark H. Sawyer: Red Book: 2021–2024 Report of the Committee on Infectious Diseases (32ND EDITION). Hrsg.: American Academy of Pediatrics. 2021, ISBN 978-1-61002-578-2, Kapitel Dengue, doi:10.1542/9781610025782 (englisch).
- Tyler M. Sharp, Marc Fischer u. a.: Dengue and Zika Virus Diagnostic Testing for Patients with a Clinically Compatible Illness and Risk for Infection with Both Viruses. In: MMWR. Recommendations and Reports. Band 68, Nr. 1. CDC – U.S. Department of Health & Human Services, 14. Juni 2019, doi:10.15585/mmwr.rr6801a1 (englisch).
- Tobey Audcent, Andrea Hunter: Fever in the returning child traveller: Highlights for health care providers. In: Paediatrics & Child Health. Band 23, Nr. 8, Dezember 2018, S. 553, doi:10.1093/pch/pxy138 (englisch).
Impfung
- Eakachai Prompetchara, Chutitorn Ketloy, Stephen J. Thomas, Kiat Ruxrungtham: Dengue vaccine: Global development update. In: Asian Pacific Journal of Allergy and Immunology. Band 3, Nr. 38, September 2020, S. 178–185, doi:10.12932/AP-100518-0309, PMID 30660171 (englisch, Review).
Geschichte
- J. G. Rigau-Pérez: The early use of break-bone fever (Quebranta huesos, 1771) and dengue (1801) in Spanish. In: American Journal of Tropical Medicine and Hygiene. Band 59, Nr. 2, August 1998, S. 272–274, PMID 9715945.
- G. Kuno: Emergence of the severe syndrome and mortality associated with dengue and dengue-like illness: historical records (1890 to 1950) and their compatibility with current hypotheses on the shift of disease manifestation. In: Clinical Microbiology Reviews. Band 22, Nr. 2, April 2009, S. 186–201, doi:10.1128/CMR.00052-08, PMID 19366911, PMC 2668235 (freier Volltext).
- N. Vasilakis, S. C. Weaver: The history and evolution of human dengue emergence. In: Advances in Virus Research. Band 72, 2008, S. 1–76, doi:10.1016/S0065-3527(08)00401-6, PMID 19081488.
Weblinks
- Denguefieber – Informationen des Robert Koch-Instituts
- Dengue. Informationen des Centers for Disease Control and Prevention (englisch)
- Dengue. Informationen der Weltgesundheitsorganisation (englisch)
- DengueMap. healthmap.org, abgerufen am 7. September 2012
Einzelnachweise
- N. Vasilakis, S. C. Weaver: The history and evolution of human dengue emergence. In: Advances in Virus Research. Band 72, 2008, S. 1–76, doi:10.1016/S0065-3527(08)00401-6, PMID 19081488.
- Meyers großes Taschenlexikon in 24 Bänden. Band 5 (Con-Dug). Mannheim 1992, S. 116.
- Dengue and dengue haemorrhagic fever. WHO, abgerufen am 14. Juni 2010.
- Dengue – Guidelines for diagnosis, treatment, prevention and control. (PDF; 1,5 MB) WHO, abgerufen am 14. Juni 2010 (englisch).
- Samir Bhatt, Peter W. Gething, Oliver J. Brady u. a.: The global distribution and burden of dengue. In: Nature. Nr. 496, 25. April 2013, S. 504–507, doi:10.1038/nature12060 (Volltext).
- Alexandra Jane Oliver: Tropenkrankheit: Mexiko lässt weltweit ersten Dengue-Impfstoff zu. Spiegel Online, 10. Dezember 2015.
- Drug firm warns of 'severe disease' from dengue vaccine for people with no prior infection. In: CNN Philippines. 30. November 2017, abgerufen am 14. Juli 2018 (englisch).
- A. Sampath, R. Padmanabhan: Molecular targets for flavivirus drug discovery. In: Antiviral Research. Band 81, Nr. 1, Januar 2009, S. 6–15, doi:10.1016/j.antiviral.2008.08.004, PMID 18796313.
- D. Fontenille, A.B. Failloux, R. Romi: Should we expect Chikungunya and Dengue in Southern Europe? In: W. Takken, B. G. J. Knols (Hrsg.): Emerging pests and vector-borne diseases in Europe. Band 1. Wageningen Academic Publishers, Wageningen 2007, ISBN 978-90-8686-053-1.
- L. Rosen, L.E. Rozeboom, B.H. Sweet & A.B. Sabin: The transmission of dengue by 'Aedes polynesiensis’ Marks. In: American Journal of Tropical Medicine and Hygiene. 1954, Nr. 3, S. 878–882.
- I.M. Mackerras: Transmission of dengue fever by Ae. (Stegomyia) scutellaris Walk. in New Guinea. In: Transactions of the Royal Society of Tropical Medicine and Hygiene. 1946, Nr. 40, S. 294–312.
- J. E. Freier, L. Rosen: Vertical transmission of dengue virus by mosquitoes of the 'Aedes scutellaris’ group. In: American Journal of Tropical Medicine and Hygiene. 1987, Band 37, Nr. 3, S. 640–647.
- J. E. Freier, L. Rosen: Vertical transmission of dengue virus by ‚Aedes mediovittatus‘. In: American Journal of Tropical Medicine and Hygiene. 1988, Band 39, Nr. 2, S. 218–222.
- J. Günther, J. P. Martínez-Muñoz, D. G. Pérez-Ishiwara, J. Salas-Benito: Evidence of vertical transmission of dengue virus in two endemic localities in the state of Oaxaca, Mexico. In: Intervirology. Band 50, Nr. 5, 2007, S. 347–352, doi:10.1159/000107272, PMID 17700030.
- V. Thenmozhi, J. G. Hiriyan, S. C. Tewari u. a.: Natural vertical transmission of dengue virus in Aedes albopictus (Diptera: Culicidae) in Kerala, a southern Indian state. In: Japanese Journal of Infectious Diseases. Band 60, Nr. 5, September 2007, S. 245–249, PMID 17881861.
- B. Angel, V. Joshi: Distribution and seasonality of vertically transmitted dengue viruses in Aedes mosquitoes in arid and semi-arid areas of Rajasthan, India. In: Journal of Vector Borne Diseases. Band 45, Nr. 1, März 2008, S. 56–59, PMID 18399318.
- Aktuelle Hinweise, reisemedizinische Meldungen und Outbreak News für Ihr Reisezieltropen. tropeninstitut.de; abgerufen am 19. November 2020.
- M. A. Tolle: Mosquito-borne diseases. In: Current Problems in Pediatric and Adolescent Health Care. Band 39, Nr. 4, April 2009, S. 97–140, doi:10.1016/j.cppeds.2009.01.001, PMID 19327647.
- Dengue outbreak in Madeira, Portugal, March 2013. (PDF) European Centre for Disease Prevention and Control, Stockholm 2014, ISBN 978-92-9193-564-2.
- J. Schmidt-Chanasit, M. Haditsch, I. Schöneberg, S. Günther, K. Stark, C. Frank: Dengue virus infection in a traveller returning from Croatia to Germany. In: Eurosurveillance, 2010, Band 15, Nr. 40, S. 19677, PMID 20946759.
- Marchand u. a.: Autochthonous case of dengue in France, October 2013. In: Eurosurveillance, Band 18, Nr. 50, 2013, S. 20661.
- Chikungunya et dengue – Données de la surveillance renforcée en France métropolitaine en 2015. Mitteilung vom 24. August 2015 auf der Website des französischen Institut de Veille Sanitaire (InVS). Abgerufen am 24. August 2015.
- Nice Matin, 19. Oktober 2018 (Zeitung).
- Haarausfall durch Denguefieber? tropenmedizin-wien.at; abgerufen am 19. November 2020.
- T. C. Pierson, M. S. Diamond: Molecular mechanisms of antibody-mediated neutralisation of flavivirus infection. In: Expert Reviews in Molecular Medicine. Band 10, 2008, S. e12, doi:10.1017/S1462399408000665, PMID 18471342, PMC 2671962 (freier Volltext).
- Dengue - Chapter 4: Laboratory diagnosis. (PDF; 117 kB) who.int, Volltext
- Virale hämorrhagische Fieber. In: rki.de. Robert Koch-Institut, 28. November 2019, abgerufen am 23. März 2020.
- W. Parks, L. Lloyd: Planning Social Mobilization and Communication for Dengue Fever Prevention and Control. WHO/CDS/WMC/ 2. 2004, WHO, Genf 2004.
- S. Schaper: Beitrag zur Verwendung von Mesocyclops thermocyclopoides für die Bekämpfung der Stechmücke ’Stegomyia aegypti’ in Costa Rica. Dissertation Hannover, 2001, ISBN 3-8311-1668-7.
- B. Kay, S. N. Vu: New strategy against Aedes aegypti in Vietnam. In: The Lancet. Band 365, Nr. 9459, 2005, S. 613–617, doi:10.1016/S0140-6736(05)17913-6, PMID 15708107.
- A. Kroeger, A. Lenhart, M. Ochoa u. a.: Effective control of dengue vectors with curtains and water container covers treated with insecticide in Mexico and Venezuela: cluster randomised trials. In: BMJ. 2006, Nr. 332, S. 1247–1252.
- A. Rose, M. Geier, A. E. Eiras, M. da Gloria Teixeira, M. das Gracas Vale Barbosa, M. P. Gomes Mourao: Novel mosquito traps in the fight against urban dengue – from monitoring to control. Introduction to a feasibility study in Manaus, Brazil. In: Proceedings of the XXIII International Congress of Entomology. Durban, South Africa 2008.
- Conor J. McMeniman, Roxanna V. Lane, Bodil N. Casset u. a.: Stable Introduction of a Life-Shortening Wolbachia Infection into the Mosquito Aedes aegypti. In: Science. Band 232, Nr. 5910, 2. Januar 2009, S. 141–144, doi:10.1126/science.1165326.
- Nadine Poniewaß: Harmlose Mückenzüchtung verdrängt tödliche Artgenossen. Spiegel Online, 25. August 2011.
- A Utarini et al.: Efficacy of Wolbachia-Infected Mosquito Deployments for the Control of Dengue. In: New England Journal of Medicine. Juni 2021, Band 384, Nr. 23, S. 2177–2186, doi:10.1056/nejmoa2030243.
- Michael Simm: Denguefieber mit Bakterien bekämpft
- Cinthia Briseño: Kritiker verurteilen Tests mit Selbstmord-Moskito. Spiegel Online, 31. Oktober 2011.
- The Oxitec approach. oxitec.com; abgerufen am 22. November 2016. Zitat: After an Oxitec male mosquito has successfully mated with a wild female, any offspring that result will not survive to adulthood, so the mosquito population declines.
- Gen-Mücke soll Menschen retten. rp-online.de, 24. April 2012.
- Alexandra Jane Oliver: Parasiten-Pilz soll Dengue-Fieber bekämpfen. Spiegel Online, 23. April 2012.
- Online Etymology Dictionary. Abgerufen am 14. Juni 2010.
- Impact of Dengue. WHO, abgerufen am 7. August 2010.
- J. B. Siqueira, C. M. Martelli, G. E. Coelho, A. C. Simplicio, D. L. Hatch: Dengue and dengue hemorrhagic fever, Brazil, 1981–2002. In: Emerging Infectious Diseases. Band 11, Nr. 1, Januar 2005, S. 48–53, PMID 15705322.
- M. F. Oliveira, J. M. Galvao Araujo, O. C. Ferreira u. a.: Two lineages of dengue virus type 2, Brazil. In: Emerging Infectious Diseases. Band 16, Nr. 3, März 2010, S. 576–578, PMID 20202456.
- Dengue-Fieber Ausbruch in Süd- und Mittelamerika. In: Blick.ch. 21. November 2019, abgerufen am 21. November 2019.
- Office of Medical History. Abgerufen am 11. August 2010.
- P. M. Ashburn, C. F. Craig: Experimental investigations regarding the etiology of dengue fever. 1907. In: Journal of Infectious Diseases. Band 189, Nr. 9, Mai 2004, S. 1747–1783; discussion 1744–1746, doi:10.1086/383418, PMID 15116315.
- Chemical and Biological Weapons: Possession and Programs Past and Present. James Martin Center for Nonproliferation Studies, Middlebury College, 9. April 2002; abgerufen am 14. November 2008.
- I. History of biological warfare; B. Significant events in the history of the U.S. offensive Program. USAMRIID. „1970–1972 Total destruction of antipersonnel BW agent stocks and munitions were accomplished between 10 May 1971 and 1 May 1972. The BW plant facilities at PBA were decontaminated and turned over to the Food and Drug Administration. The offensive research program was also terminated in 1970 with a complete inventory of all BW material at Ft. Detrick and Dugway Proving Ground, and destruction of all items except those essential to defensive BW research.“
- Barry S. Levy, Victor W. Sidel: War and Public Health. American Public Health Association, 2000, ISBN 0-87553-023-0, S. 110–111, Google Books
- William Blum: Killing Hope: U. S. Military and CIA Interventions Since World War II. First Printing edition, Common Courage Press, March 1995, ISBN 1-56751-052-3, Google Books.
- R. Edelman: Dengue vaccines approach the finish line. In: Clinical Infectious Diseases. Band 45 Supplement 1, Juli 2007, S. S56–S60, doi:10.1086/518148, PMID 17582571.
- Efficacy of a Tetravalent Dengue Vaccine in Children in Latin America. In: New England Journal of Medicine.
- Impfstoff gegen Dengue-Fieber bis 2015 geplant. derstandard.at, 18. Oktober 2010; abgerufen am 1. Oktober 2014.
- Efficacy of a Tetravalent Dengue Vaccine in Children in Latin America. In: New England Journal of Medicine.
- Bakterien machen Moskitos immun. Ausbreitung des Dengue-Fiebers bald gestoppt? Auf: bild.de, 25. August 2011; abgerufen am 1. Oktober 2014.
- Suzanne J. F. Kaptein, Olivia Goethals, Dominik Kiemel, Arnaud Marchand et al.: A pan-serotype dengue virus inhibitor targeting the NS3–NS4B interaction. In: Nature., 6. Oktober 2021, doi:10.1038/s41586-021-03990-6.