Yersinia pestis
Yersinia pestis – auch Pestbakterium und Pestbazillus genannt – ist ein gramnegatives, unbegeißeltes, sporenloses, fakultativ anaerobes Stäbchenbakterium. Es zählt zu den Enterobakterien und ist der Erreger der Lungen- und Beulenpest.
| Yersinia pestis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
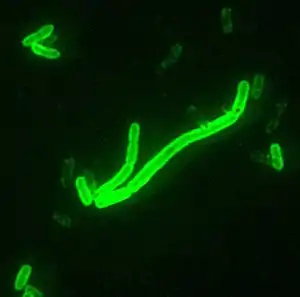
Yersinia pestis | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Yersinia pestis | ||||||||||||
| (Lehmann & Neumann 1896) van Loghem 1944 |
Yersinia pestis wurde von Alexandre Émile Jean Yersin 1894 entdeckt und von diesem Pasteurella pestis[1] genannt. Seit 1944 wird das zuvor der Gattung Pasteurella zugerechnete Bakterium in die nach Yersin benannte Gattung Yersinia gestellt.[2]
Vorgeschichte und Geschichte
Die älteste bekannte DNA eines Yersinia-pestis-Stamms wurde aus den Zähnen eines 5000 Jahre alten Jäger-und-Sammler-Skeletts in Lettland gewonnen.[3] Der Tote war sorgsam beerdigt worden, ebenso wie drei andere Personen der gleichen Stätte, deren Zähne allerdings keine Spuren von Yersinia-pestis-DNA aufwiesen. Hieraus schließen die Archäologen, dass der damalige Yersinia-pestis-Stamm nicht so hoch ansteckend und innerhalb von Tagen tödlich war wie die Stämme, die später große Epidemien, wie die Justinianische Pest oder die Pandemie des Mittelalters („Schwarzer Tod“) auslösten. Sie vermuten ein Bakterienreservoir in einheimischen Bibern (Castor fiber), die Träger eines verwandten Bakteriums sind und deren Überreste im Umkreis archäologischer Stätten der Region in großer Zahl gefunden werden.
Virulenz
Die Virulenz von Yersinia pestis entsteht durch Exotoxin-, Endotoxin- und Bakterienkapselbildung.
1980 stellten Dan Cavanaugh und James Williams fest, dass die Virulenz des Bakteriums temperaturabhängig ist. Die Körpertemperatur des Flohs liege bei 24 °C, die des Menschen bei 37 °C und die der Ratte 1,5 °C höher. Der Temperaturunterschied zwischen Floh und Ratte könne die Virulenz des Bakteriums bei der Übertragung um fast das 50-Fache steigern. Dies liege an der Fähigkeit des Bakteriums, bei höheren Temperaturen Schutzmechanismen gegen die Phagocytose, einen Bestandteil der menschlichen Immunabwehr, zu entwickeln. Bei Temperaturen, wie sie im Körper des Flohs vorherrschen, werde dieser Schutz nicht aufgebaut und das Bakterium von Leukozyten und Monozyten vernichtet. Aber 3 Stunden nach Eingang in einen Körper von 37 °C sei der Schutzmechanismus gegen Leukozyten und kurz danach derjenige gegen die Monozyten ausgebildet.[4]
Von den hunderten von bekannten Bakterienstämmen sind nur wenige virulent. Die 40–50 Stämme von Yersinia pestis haben bei Mäusen eine große Bandbreite der Dosis, bei der die Hälfte der Versuchstiere stirbt (LD50), von unter 3 bis 100 Millionen.[5]
Bricht der Krankheitserreger in die Blutbahn ein, was in 50–90 % der unbehandelten Fälle geschieht, so entsteht die Pestsepsis, also eine Streuung in die Blutbahn. Auf diesem Wege können praktisch alle Organe befallen werden. Unter anderem kommt es zur Lungenpest. Die Gefahr bei der Vermehrung innerhalb des Menschen ergibt sich aus der Ausbildung diverser Pathogenitätsfaktoren bei einer Umgebungstemperatur von 37 °C, also Körpertemperatur. So bildet Yersinia pestis bei dieser Temperatur eine antiphagozytär wirkende Kapsel aus, die als Fraktion 1 (F1) bezeichnet wird, und zwei weitere antiphagozytäre Antigene, die Virulenzantigene V und W. In Bezug auf die Virulenz des Erregers bedeutet dies, dass im Falle der Lungenpest die Übertragung von Mensch zu Mensch möglich ist, wenn es zu Kontakt mit hochinfektiösem Sputum eines an Lungenpest Erkrankten kommt. In diesem Fall kann sich innerhalb von Stunden eine primäre Lungenpest ausbilden.
Systematik und Ausbreitung
R. Devignat teilte 1951 die Pestbakterien in 3 Hauptvarianten nach den starken biochemischen Unterschieden ein: Variante 1 (später „Orientalis“ genannt) soll ihren Ausgangspunkt in Indien, Burma und im südlichen Festlandchina gehabt haben. Sie soll für die Pandemie von 1890 verantwortlich und in wenigen Jahren über die ganze Erde verbreitet worden sein. Variante 2 („Antiqua“ genannt), die er für die älteste hielt, soll in Zentral-Asien entstanden sein und sich über Zentralafrika verbreitet haben und die Justinianische Pest im sechsten Jahrhundert verursacht haben. Die dritte Variante („Medievalis“) stamme ebenfalls aus Zentralasien, soll sich in Richtung Krim und der Umgebung des Kaspischen Meeres verbreitet und dann den Schwarzen Tod in Europa und die folgenden Epidemien ausgelöst haben.[6] Dieses Modell war lange Zeit Grundlage für die Erklärung der Ausbreitungswege. Später stellte sich heraus, dass beide Hauptvarianten „Medievalis“ und „Antiqua“ in Kenia auftraten und „Orientalis“ und „Medievalis“ zusammen in der Türkei gefunden wurden.[7] Jeder dieser drei Pandemien wird einem Biovar zugeordnet, eine sich durch spezifische biochemische Eigenschaften unterscheidende Variante der Spezies Yersinia pestis.
Mark Achtmann und andere kamen 1999 in ihren Studien zu dem Ergebnis, dass Yersinia pestis ein mutierter Klon seines nahen Verwandten Yersinia pseudotuberculosis ist, ein relativ harmloses Bakterium, das Magenbeschwerden verursachen kann und nur äußerst selten zum Tode führt. Die beiden Arten haben über 90 % des Genmaterials gemeinsam und würden nach taxonomischen Regeln als Varianten der gleichen Art bezeichnet, wenn sie nicht aus klinischen Gründen scharf unterschieden werden müssten. Die Autoren meinten, dass diese Variante höchstens 20.000 Jahre alt sein könne, das unsicherere Mindestalter aber wahrscheinlich bei 1000 Jahren liege.[8]
1997 wurde ein Pestbakterienstamm beschrieben, der multiresistent gegen Antibiotika war. Da er in älteren Proben nicht zu finden war, scheint er nach den Aussagen der Forscher erst 1995 entstanden zu sein.[9]
Den ersten umfassenden durch Genomanalyse gestützten Blick auf etwa 1000 Isolate von Y. pestis gewannen Morelli und andere 2010 in einer Untersuchung, die zeigte, dass die ältesten pathogenen Stämme in China oder Russland entstanden sein mussten. Es fanden sich weitere Zusammenhänge in der Ausbreitung der Stämme mit dem Handel über die Seidenstraße, den Expeditionen von Zheng He und der dritten Pandemie von 1894.[10]
2011 schließlich hatten Bos, Schuenemann und andere die Gelegenheit, das Genom von Pestbakterien zu untersuchen, die aus Zähnen mittelalterlicher Londoner Leichen isoliert werden konnten. Ein Vergleich mit anderen bekannten Stämmen zeigte, dass es sich um Stämme handelte, die mit den ältesten Stämmen aus China am nächsten verwandt sein müssen. Das bedeutet beispielsweise, dass die mittelalterliche Epidemie tatsächlich von Asien ausging. Es bedeutet überraschenderweise auch, dass, wenn es wirklich noch frühere Pestepidemien gab, deren Stämme ausgestorben sind, da alle heute bekannten Stämme Abkömmlinge der Mittelalter-Variante sind.[11]
Virulenzfaktoren und evolutionäre Veränderung des Erregers
Verglichen mit seinem nächsten Verwandten, Yersinia pseudotuberculosis, hat Yersinia pestis im Laufe seiner Evolution die Fähigkeit verloren, im Boden zu überdauern. Im Gegenzug hat das Stäbchenbakterium zahlreiche neue Eigenschaften erworben, so diverse Virulenzfaktoren und Mechanismen zur Adaptation an entsprechende Säugetierwirte und parasitäre Vektoren.[12][13]
Die Pest befiel bereits Gemeinschaften der späten Jungsteinzeit. Spuren des Erregers lassen sich in einem Zeitraum von vor 4800 bis etwa vor 3800 Jahren in Skeletten aus ganz Europa nachweisen.[14][15]
Die frühen bronzezeitlichen Erreger konnten nur die primäre Lungenpest[16] auslösen, weil ihnen das Gen „ymt“ fehlte, welches für die stabile Besiedlung von Flöhen (Flohmagen) durch Yersinia pestis nötig ist. So bildet der Pesterreger im Vektor Floh einen Biofilm, der wie ein Vormagenblock wirkt. Der Parasit kann damit nicht mehr abschlucken, wird hungrig und beißwütig und wechselt den Wirt. Dieser wissenschaftlich bestätigte Algorithmus bewirkt eine effiziente Verbreitung des Pesterregers auf andere Säugetierindividuen oder auch den Menschen.
Die Yersinia pestis-Genome der frühen Epochen zeigten eine ausgestorbene Variante des Erregers, die auf das späte Neolithikum und die frühe Bronzezeit datiert werden konnte. Die Genome jener frühen Varianten sind in ihren genetischen Merkmalen mit den späteren Pesterregern nicht völlig identisch, so fehlen Virulenzfaktoren die sich Vektoren (Flöhe) bedienen können und die ihre Verbreitung dadurch effizienter machen, durch die Fähigkeit, in Flöhen zu überleben, was den Hauptübertragungsweg der Krankheit auf Menschen und andere Säugetiere darstellt.[17]
Damit sich die Pathogenität und Virulenz des Pesterregers über die natürlichen Nagetier-Reservoire und den Hauptvektor Floh ändern konnte, setzte es eine Veränderung (Mutation, Selektion) von Virulenzfaktoren voraus, die sowohl auf dem Bakterienchromosom als auch auf dessen Plasmiden kodiert sind.[18][19] Dabei unterschieden sich das Genom der frühen Peststämme von den späteren Varianten.[20][21] Wie bei allen Yersinien sind plasmidkodierte Virulenzfaktoren vorhanden.
Zwei Yersinia pestis-spezifische Plasmide, „pMT1“ und „pPCP1“, tragen zahlreiche Virulenz-Gene, so bildet das Proteinprodukt eine Proteinkapsel aus, das sogenannte „F1-Antigen“. Dieses schützt Yersinia pestis vor der primären Immunantwort im Säugetierorganismus. Oder, eine membran-ständige Protease, ein „Plasminogen-Aktivator“, der die fibrinolytische Aktivität beeinflusst und dem Erreger über einen langen Zeitraum hinweg ermöglicht im intravasal zu persistieren und eine komplement-meditierte Zelllyse verhindert. Anderseits können andere yersinia-assoziierte Faktoren zur Sepsis und unter Umständen zu einer Disseminierte intravasale Koagulopathie führen. Diese und weitere pathogene Eigenschaften verleihen Yersinia pestis seinen hochpathogenen Charakter.
Mutationen
Bei Yersinia sind es wohl 2 Plasmiden, die für pestis charakteristisch sind und seine Gefährlichkeit ausmachen. So wurde schon vermutet, dass eine plötzliche und umfassende Veränderung der Virulenz ein Hintergrundfaktor dafür gewesen sein kann, dass eine Pestepidemie plötzlich ausbrach und wieder verschwand, quer über die Jahrhunderte hindurch.[22] Gerade bei Viren und Bakterien ist eine Instabilität des Genmaterials zu beobachten, die zu vielen Mutationen führt. Inzwischen ist es gelungen, das gesamte Genom von Yersinia pestis zu entschlüsseln und zu kartografieren.[23] Dabei stellten die Forscher fest, dass das Bakterium genetische Besonderheiten aufweist, die auf häufige „intragenomische Rekombinationen“ hinweisen, dass es also in hohem Maße Gene anderer pathogener Organismen aufnehmen kann. Sie meinten, die Pestbakterien hätten Charakteristiken, die auf ständige Veränderungen hinwiesen.[23] Ein Jahr später entschlüsselte eine andere Forschergruppe einen anderen Bakterienstamm und bestätigte diese Einschätzung.[24] Annie Guiyoule und Bruno Rasoamanana untersuchten in Madagaskar die Gebiete mit besonders hoher Pestaktivität in den letzten Jahrzehnten. Sie isolierten 187 verschiedene Stämme aus der Zeit von 1926 bis 1996.[25]
Lebensdauer
Bei moderaten Temperaturen überlebt Yersinia pestis an den Mundwerkzeugen der Flöhe rund 3 Stunden.[26] Bereits 1944 ist festgestellt worden, dass Pestbakterien in Salzlösung und einer Temperatur um 25 °C bis zu 2 Wochen, bei 2–4 °C sogar bis zu zwei Jahre außerhalb eines Wirtstieres überleben und virulent sein können.[27] Experimente in der 1. Hälfte des 20 Jh. zeigten auch, dass Sonnenlicht die Bakterien rasch abtötet, die Lebensdauer jedoch stark von der Umgebung der Bakterien abhängt, insbesondere von deren Unterlage. In dünner Lauge auf Glas sterben die Bakterien innerhalb 1 Stunde ab, bei einer dicken Bakterienschicht vervierfachte sich die Lebensdauer und auf Stoff aus Hanf lebten sie bis zu 14 Stunden.[28] Während Temperaturen bei 55 °C tödlich sind, schaden ihnen niedrige Temperaturen nicht. In der Mandschurei wurden sogar noch virulente Bakterien in gefrorenen Pestleichen gefunden. Auch konnten die Bakterien fast einen Monat in Kornstaub überleben, der von infektiösen Ausscheidungen verunreinigt war.[29] Pestbakterien können Menschen bei Raumtemperatur und normaler Luftfeuchtigkeit in einem Zeitraum von mehr als 5 Tagen infizieren.[30]
Übertragung
Flöhe, insbesondere aber der Rattenfloh Xenopsylla cheopis können den Pesterreger übertragen. Aber auch Nosopsyllus fasciatus und der Menschenfloh Pulex irritans werden diskutiert, da Xenopsylla cheopis auf tropische Temperaturen angewiesen ist und in Europa nicht überleben kann. Flöhe sind blutsaugende Parasiten, die ihren Wirt direkt mit Yersinia pestis infizieren können. Wechselt der Rattenfloh von einem infizierten Nager – beispielsweise der Wanderratte oder der Hausratte – nach dessen Tod auf einen anderen Wirt, etwa Haustiere oder Menschen, ist er in der Lage, diese mit dem Pestbakterium zu infizieren. Dabei kann die Pesterkrankung für den Menschen ebenso tödlich sein wie für die Ratten.
Krankheitserscheinungen
An der Bissstelle kommt es zu einer lokalen Infektion, die durch die Ausbildung einer Pustel gekennzeichnet ist und zur sogenannten Bubonenpest (Beulenpest) führt.
Bei der septischen (blutvergiftenden) Form wird nicht immer eine Pestbeule entwickelt. Der Patient stirbt schnell ohne besondere äußere Symptome, aber mit einer hohen Bakterienkonzentration im Blut. Wenn diese Pestbakterien die Lunge angreifen, so wird diese Form als „sekundäre Lungenpest“ bezeichnet, die die gefährlichste Form mit dem raschesten Verlauf bildet. Neben hohem Fieber ist der blutige Auswurf eines der wenigen äußeren Symptome.
Die blutvergiftende Wirkung wird ausgelöst, wenn die Bakterien ihren normalen Lebenszyklus vollenden und absterben. Dabei werden große Mengen toxischen Sekrets direkt in den Blutkreislauf abgegeben; Nieren und Leber können nekrotisch werden, wenn sie versuchen, das System von Toxinen zu reinigen. Am Ende erliegt das Opfer einem toxischen Schock.
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von Yersinia pestis namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Diese Meldepflicht für den Erreger betrifft in erster Linie die Leitungen von Laboren (§ 8 IfSG).
In der Schweiz ist der positive und negative laboranalytische Befund zu Yersinia pestis für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Literatur
- Kirsten I. Bos u. a.: A draft genome of Yersinia pestis from victims of the Black Death. In: Nature. Band 478, Nr. 7370, 2011, S. 506–510, doi:10.1038/nature10549.
- Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie. Unter Mitarbeit von Gernot Geginat (= Duale Reihe). 4. Auflage. Thieme, Stuttgart 2009, ISBN 978-3-13-125314-9.
- Alexander Rakin: Yersinia pestis – Eine Bedrohung für die Menschheit. In: Bundesgesundheitsbl - Gesundheitsforsch - Gesundheitsschutz. Band 46, Nr. 11, 2003, S. 949–955, doi:10.1007/s00103-003-0713-3.
- Verena J. Schuenemann u. a.: Targeted enrichment of ancient pathogens yielding the pPCP1 plasmid of Yersinia pestis from victims of the Black Death. In: Proceedings of the National Academy of Sciences. Band 108, Nr. 38, 2011, S. E746–E752, doi:10.1073/pnas.1105107108.
- Alexander Rakin: Yersinia pestis: Eine Bedrohung für die Menschheit. In: Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz. Band 46, Nr. 11, 2003, S. 949–955, DOI 10.1007/s00103-003-0713-3 ( auf www.rki.de).
- Lisa Seifert: Mikroevolution und Geschichte der Pest: Paläogenetische Detektion und Charakterisierung von Yersinia pestis, gewonnen aus historischem Skelettmaterial. Dissertationsschrift, Ludwig-Maximilians-Universität München, München 2013 ( auf edoc.ub.uni-muenchen.de).
Weblinks
- Stephan Riesenberg: Das Bakterium Yersinia pestis
- Johannes Krause, Verena Schünemann: Bakterium „Yersinia pestis“ zweifelsfrei als Erreger des Schwarzen Todes belegt; Information der Universität Tübingen vom 30. August 2011 (pdf)
- Nina Weber: Pest-Genom entziffert: Am Anfang war der Schwarze Tod; Spiegel Online vom 12. Oktober 2011.
Einzelnachweise
- Gundolf Keil: Robert Koch (1843–1910). Ein Essai. In: Medizinhistorische Mitteilungen. Zeitschrift für Wissenschaftsgeschichte und Fachprosaforschung. Band 36/37, 2017/2018 (2021), S. 73–109, hier: S. 86.
- J. J. van Loghem: The classification of the plague-bacillus. In: Antonie van Leeuwenhoek. Band 10, 1944, S. 15–16.
- Cell Reports 35, 13 (29. Juni), ; Kurzfassung in Nature
- Dan C. Cavanaugh, James E. Williams: Plague: Some Ecological Interrelationships. In: R. Traub, H. Starcke (Hrg.) Fleas, Proceedings of the International Conference on Fleas. Ashton Wold, Peterborough, UK, 21–25 June 1977. Rotterdam 1980, S. 245–256, 251.
- R. D. Perry, J. D. Fetherston: Yersinia pestis—etiologic agent of plague. In: Clinical Microbiology Reviews. Band 10, Nr. 1, 1. Januar 1997, S. 35–66, hier 35–66, 41.
- R. Devignat: Variétés de l'espèce Pasteurella pestis. In: Bulletin of the World Health Organization. Band 4, Nr. 2, 1951, S. 247–263, PMC 2554099 (freier Volltext).
- A. Guiyoule, F. Grimont, I. Iteman, P. A. Grimont, M. Lefèvre, E. Carniel: Plague pandemics investigated by ribotyping of Yersinia pestis strains. In: Journal of Clinical Microbiology. Band 32, Nr. 3, 3. Januar 1994, S. 634–641.
- Mark Achtman, Kerstin Zurth, Giovanna Morelli, Gabriela Torrea, Annie Guiyoule, Elisabeth Carniel: Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis. In: Proceedings of the National Academy of Sciences. Band 96, Nr. 24, 23. November 1999, S. 14043–14048, doi:10.1073/pnas.96.24.14043.
- March Galimand, Annie Guiyoule u. a.: Multidrug Resistance in Yersinia pestis Mediated by a Transferable Plasmid. In: The New England Journal of Medicine. 327, Nr. 10, 1997, S. 677–680.
- G. Morelli, Y. Song u. a.: Yersinia pestis genome sequencing identifies patterns of global phylogenetic diversity. In: Nature genetics. Band 42, Nummer 12, Dezember 2010, S. 1140–1143. doi:10.1038/ng.705. PMID 21037571. PMC 2999892 (freier Volltext).
- Kirsten I. Bos, Verena J. Schuenemann u. a.: A draft genome of Yersinia pestis from victims of the Black Death. In: Nature. Band 478, 2011, S. 506–510, doi:10.1038/nature10549.
- Mikula KM, Kolodziejczyk R, Goldman A.: Yersinia infection tools-characterization of structure and function of adhesins. Front Cell Infect Microbiol. 2013 Jan 8;2: 169.
- Reuter S, Connor TR, Barquist L, Walker D, Feltwell T et al.: Parallel independent evolution of pathogenicity within the genus Yersinia. Proc Natl Acad Sci U S A. 2014 May 6;111(18): 6768 - 6773.
- Johannes Krause, Thomas Trappe: Die Reise unserer Gene. Eine Geschichte über uns und unsere Vorfahren. Propyläen, Berlin 2019, ISBN 978-3-549-10002-8, S. 183 ff.
- Morten E. Allentoft, Martin Sikora, Eske Willerslev: Population genomics of Bronze Age Eurasia. Nature (2015), Volume 522, S. 167–172 und
- Die primäre Lungenpest ist eine Tröpfcheninfektion die von Mensch zu Mensch übertragen wurde. Die Inkubationszeit liegt bei wenigen Stunden bis etwa 4 Tagen, sie entwickelt sich von allen Pestformen am schnellsten und ist von einer sehr hohen Kontagiosität. Durch das Einatmen des Erregers werden die Abwehrbarrieren des lymphatischen Systems umgangen. Symptomatisch stehen initial akut einsetzendes Fieber, Schüttelfrost, Abgeschlagenheit, Schwindel, Muskelschmerzen und Kopfschmerzen im Vordergrund. Um den zweiten Erkrankungstag treten dann pulmonale Zeichen wie Husten, schwarz-blutiger Auswurf, Dyspnoe, Schmerzen im Brustkorb (Pleuritis) und erhöhte Atemfrequenz auf. Der Auswurf seinerseits ist hochinfektiös.
- Maria A. Spyrou, Rezeda I. Tukhbatova1, Chuan-Chao Wang, Aida Andrades Valtueña, Aditya K. Lankapalli, Vitaly V. Kondrashin, Victor A. Tsybin, Aleksandr Khokhlov, Denise Kühnert, Alexander Herbig, Kirsten I. Bos, Johannes Krause: Analysis of 3800-year-old Yersinia pestis genomes suggests Bronze Age origin for bubonic plague. Nature Communications (2018) 9:2234, DOI: 10.1038/s41467-018-04550-9 ( auf nature.com)
- Alexander Rakin: Yersinia pestis: Eine Bedrohung für die Menschheit. In: Bundesgesundheitsbl – Gesundheitsforsch – Gesundheitsschutz. Band 46, Nr. 11, 2003, S. 949–955, DOI 10.1007/s00103-003-0713-3 ( auf www.rki.de)
- Martin Pfefer: Die Pest. In: Horst Aspöck (Hrsg.): Krank durch Arthropoden. Oberösterreichisches Landesmuseum, Biologiezentrum, Denisia 30 (2010): 625–636 (zobodat.at [PDF]).
- Simon Rasmussen, Morten Erik Allentoft, Kasper Nielsen, Rasmus Nielsen, Kristian Kristiansen, Eske Willerslev: Early Divergent Strains of Yersinia pestis in Eurasia 5,000 Years Ago. Cell (2015), Vol. 163, Issue 3, S. 571–582, Oktober 22, DOI:https://doi.org/10.1016/j.cell.2015.10.009 ( auf cell.com, zum downloaden)
- Abbildung aus Siegfried Scherer: Ist der Erreger der Beulenpest erst vor 3000 Jahren entstanden? Studium Integrale Journal, 23. Jahrgang / Heft 1, Mai 2016, S. 44–47 ( ) „Durch ein komplexes statistisches Verfahren wurde aus den fossilen und heutigen Y. pestis-Genomsequenzen sowie aus den direkten Datierungen der fossilen Proben eine molekulare Uhr berechnet. Je weiter die Aufspaltungsereignisse zurück liegen, desto größer wird der potentielle Fehler der molekularen Uhr. (Nach Rasmussen et al. 2015, Abb. 4C, http://dx.doi.org/10.1016/j.cell.2015.10.009; CC BY 4.0“)
- R. D. Perry, J. D. Fetherston: Yersinia pestis—etiologic agent of plague. In: Clinical Microbiology Reviews. Band 10, Nr. 1, 1. Januar 1997, S. 35–66, hier 38–40.
- J. Parkhill, B. W. Wren und 33 weitere Forscher: Genome sequence of Yersinia pestis, the causative agent of plague. In: Nature. Band 413, Nr. 6855, 4. Oktober 2001, S. 523–527, doi:10.1038/35097083.
- Wen Deng u. a.: Genome Sequence of Yersinia pestis KIM. In: Journal of Bacteriology. Band 184, Nr. 16, 15. August 2002, S. 4601–4611, doi:10.1128/JB.184.16.4601-4611.2002.
- A. Guiyoule, B. Rasoamanana, C. Buchrieser, P. Michel, S. Chanteau, E. Carniel: Recent emergence of new variants of Yersinia pestis in Madagascar. In: Journal of Clinical Microbiology. Band 35, Nr. 11, 11. Januar 1997, S. 2826–2833.
- V. A. Bibikova: Contemporary Views on the Interrelationships Between Fleas and the Pathogens of Human and Animal Diseases. In: Annual Review of Entomology. Band 22, Nr. 1, 1977, S. 23–32, doi:10.1146/annurev.en.22.010177.000323.
- Georges Girard: Hémoculture et bactérémie dans l'infection pesteuese. In: Bulletin of the Exotic Pathology Society. 37, 228.
- Robert Pollitzer: Plague. WHO, Genf 1954, S. 104–105.
- Robert Pollitzer, Karl F. Meyer: The Ecology of Plague. In: Jaques M. May (Hrsg.): Studies in Disease Ecology. (= Studies in Medical Geography, Vol. 2), New York 1961, S. 433–590.
- Laura J. Rose, Rodney Donlan, Shailen N. Banerjee, Matthew J. Arduino: Survival of Yersinia pestis on Environmental Surfaces. In: Applied and Environmental Microbiology. Band 69, Nr. 4, 4. Januar 2003, S. 2166–2171, doi:10.1128/AEM.69.4.2166-2171.2003.