Elektroporation
Elektroporation ist eine Methode, Zellmembranen vorübergehend permeabel (durchlässig) zu machen, um so Makromoleküle, wie DNA oder Proteine, in Zellen oder Gewebe einzuschleusen.[1] Die Elektroporation wird in der Molekularbiologie häufig zum Transfer von Nukleinsäuren in prokaryotische (Transformation) und eukaryotische (Transfektion) Zellen verwendet. Im Bereich der Lebensmittel- und Bioverfahrenstechnik kann die Elektroporation zur Besserung von Massentransportprozessen oder zur Inaktivierung von Mikroorganismen eingesetzt werden.
Prinzip
Durch ein elektrisches Feld, das in der Regel als kurzer Puls durch den Entladungsstrom eines Kondensators erzeugt wird, wird die Zellmembran von im Kondensator befindlichen Zellen aufgrund verschiedener Effekte permeabilisiert. Ob die Zellmembran dabei tatsächlich Poren bildet, ist umstritten. Es könnte von Feldstärke und Dauer der Impulse abhängen. Beispielsweise kann sich die Konformation von Membranbestandteilen verändern. Beobachtet wird auch das Abschnüren von Membranbereichen zu Vesikeln, welche den Import von Makromolekülen und Organellen erklären können. Der Effekt der Elektroporation wurde erstmals von Neumann 1982 beschrieben.[2] Durch die temporäre Permeabilisierung kommt es zur Freisetzung von intrazellulären Bestandteilen, induziert durch hydrostatische Druckunterschiede (Turgordruck) und osmotische Effekte. Außerdem können Substanzen aus dem Außenmedium in das Zellinnere aufgenommen werden (Farbstoffe, DNA, Ionen). Die Elektroporation ist mit allen Zelltypen möglich, da sich jedoch nicht alle Poren wieder schließen, sinkt die Zellviabilität, gegebenenfalls bis zum Zelltod. Die Transformationsrate von Bakterien ist bei dieser Methode höher als bei den chemischen Transformationsverfahren.
Die Elektroporation kann zur Abtötung von Mikroorganismen verwendet werden.[3][4] Ob ein industrieller Einsatz dieser Methode zur Sterilisierung diverser Substanzen (z. B. Wasser) möglich ist, wird noch diskutiert. Das zu behandelnde Gut wird durch einen Reaktionsraum gefördert, in dem anhand einer oder mehrerer Elektrodenpaare ein gepulstes elektrisches Feld erzeugt wird. Die Wiederholungsrate der Impulse wird an den Produktstrom angepasst. Die benötigte elektrische Feldstärke liegt üblicherweise in einem Bereich von 1 kV/cm für pflanzliche oder tierische Zellen bzw. 10 bis 40 kV/cm für Mikroorganismen.
Verfahren
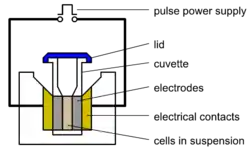

Zum Einschleusen von großen Molekülen, z. B. Plasmiden, die die Zellmembran von sich aus nicht passieren können, benutzt man einen Elektroporator – ein Gerät, das das elektrische Feld erzeugt. Der Elektroporator hat einen Platz für eine Küvette, in die man die Zellsuspension pipettiert. Die Küvette verfügt über zwei Elektroden.
Die Erfolgsrate der Elektroporation hängt stark von der Reinheit der Plasmidlösung ab; insbesondere muss die Lösung von Salzen frei sein. Eine unreine Lösung kann bei der Elektroporation zu einer kleinen Explosion führen, wobei die Zellen getötet werden.
Tumortherapie
Die Elektroporation kann zur ex vivo RNA-Transfektion von Immunzellen, wie dendritischen Zellen oder zytotoxischen T-Zellen, verwendet werden. So können T-Zellen mit einem Tumorantigen-spezifischen T-Zellrezeptor[5] oder CAR (chimerer Antigenrezeptor)[6] ausgestattet werden. Auch der Transfer von RNA, welche für Tumorantigene kodiert, in dendritische Zellen ist möglich.[7] Durch den Rücktransfer der veränderten Immunzellen in den Patienten sollen Immunantworten gegen den Tumor induziert werden.[8] Im Gegensatz zur stabilen Transfektion mit DNA, bietet die RNA-Transfektion eine sicherere, da transiente Alternative. Das Transfektionsverfahren mittels Elektroporation ist außerdem relativ einfach GMP (good manufacturing practice)-konform umzusetzen.
Ein neues Verfahren, Tumoren zu beseitigen, die Irreversible Elektroporation, beruht darauf, mit präzise lokalisierten Stromstößen die Zellen des Gewebes zu zerstören.[9] Der Vorteil gegenüber herkömmlicher Chirurgie besteht darin, dass die interzelluläre Matrix geschont wird, so dass nach Abbau der abgetöteten Zellen die ursprüngliche Struktur, z. B. von Blutgefäßen, sich durch Einwanderung neuer Zellen wiederherstellen kann.
Elektrischer Schlag
Bei Unfällen durch elektrischen Strom kommt es im Hochspannungsbereich zu Körperdurchströmungen von mehreren Ampere. Dabei treten an der Zellmembran sehr hohe elektrische Feldstärken auf, die zur Bildung von Poren führen. Die Poren können sich wieder schließen oder weiter vergrößern und die Zelle irreversibel schädigen. Je nach Ausprägung kann dies sogar zu Amputationen von Körperteilen führen. Bei einem elektrischen Schlag können alle Gewebsarten betroffen sein.[10]
Literatur
- Bruce Alberts u. a.: Molecular Biology of the Cell, Fourth Edition. Taylor & Francis, 2002, ISBN 0-8153-4072-9.
- Ulrich Zimmermann: Electromanipulation of Cells. Crc Press, 1996, ISBN 0-8493-4476-X.
Einzelnachweise
- Shi J, Ma Y, Zhu J, Chen Y, Sun Y, Yao Y: A Review on Electroporation-Based Intracellular Delivery.. In: Molecules. 23, Nr. 11, 2018. doi:10.3390/molecules23113044. PMID 30469344. PMC 6278265 (freier Volltext).
- E. Neumann, M. Schaefer-Ridder, Y. Wang, P. H. Hofschneider: Gene transfer into mouse lyoma cells by electroporation in high electric fields. EMBO Journal, Band 1(7), 1982, S. 841–845. PMID 6329708; PMC 553119 (freier Volltext).
- C. N. Haas, D. Aturaliye: Semi-quantitative characterization of electroporation-assisted disinfection processes for inactivation of Giardia and Cryptosporidium. Journal of applied microbiology. Band 86, Nummer 6, Juni 1999, S. 899–905, ISSN 1364-5072. PMID 10389240.
- C. Liu, X. Xie, W. Zhao, N. Liu, P. A. Maraccini, L. M. Sassoubre, A. B. Boehm, Y. Cui: Conducting nanosponge electroporation for affordable and high-efficiency disinfection of bacteria and viruses in water. Nano letters. Band 13, Nummer 9, September 2013, S. 4288–4293, ISSN 1530-6992. doi:10.1021/nl402053z. PMID 23987737.
- L. A. Johnson, B. Heemskerk, D. J. Powell Jr, C. J. Cohen, R. A. Morgan, M. E. Dudley, P. F. Robbins, S. A. Rosenberg: Gene transfer of tumor-reactive TCR confers both high avidity and tumor reactivity to nonreactive peripheral blood mononuclear cells and tumor-infiltrating lymphocytes. J. Immunol. 177(9), 1. Nov 2006, S. 6548–6559.
- C. Krug, M. Wiesinger, H. Abken, B. Schuler-Thurner, G. Schuler, J. Dörrie, N. Schaft: A GMP-compliant protocol to expand and transfect cancer patient T cells with mRNA encoding a tumor-specific chimeric antigen receptor. Cancer Immunol Immunother. 63(10), Okt 2014, S. 999–1008. doi:10.1007/s00262-014-1572-5. Epub 2014 Jun 18.
- J. A. Kyte, G. Gaudernack: Immuno-gene therapy of cancer with tumour-mRNA transfected dendritic cells. Cancer Immunol Immunother. 55(11), Nov 2006, S. 1432–1442. Epub 2006 Apr 13.
- S. Wilgenhof, J. Corthals, A. M. Van Nuffel, D. Benteyn, C. Heirman, A. Bonehill, K. Thielemans, B. Neyns: Long-term clinical outcome of melanoma patients treated with messenger RNA-electroporated dendritic cell therapy following complete resection of metastases. Cancer Immunol Immunother. 64(3), Mar 2015, S. 381–388. doi:10.1007/s00262-014-1642-8. Epub 2014 Dec 30.
- Michael K. Stehling, Enric Günther, Boris Rubinsky: Mit Stromstößen gegen Krebs. Spektrum der Wissenschaft. April 2014, S. 40.
- DIN IEC/TS 60479-1 (VDE V 0140-479-1):2007-05 Wirkungen des elektrischen Stromes auf Menschen und Nutztiere – Teil 1: Allgemeine Aspekte, Kap. 5.6, S. 26.