Humane Rotaviren
Die Humanen Rotaviren sind beim Menschen vorkommende Viren der Gattung Rotavirus (Familie Reoviridae, Unterfamilie Sedoreovirinae). Der Name beruht auf der radähnlichen Struktur (lateinisch rota ‚das Rad‘) der Viren unter dem Elektronenmikroskop.[3] Sie wurden 1973 durch Ruth Bishop in Dünndarmbiopsien von erkrankten Kindern entdeckt.[4] Rotaviren sind die häufigste Ursache für schwere Durchfallerkrankungen, sie tragen weltweit zu etwa 140 Millionen Fällen bei. Bei klinisch relevanten Durchfallerkrankungen sind Rotaviren mit einem Anteil von 35 bis 52 % vertreten. Nach Schätzungen der Weltgesundheitsorganisation sterben pro Jahr 527.000 Kinder unter 5 Jahren an einer Rotavirus-induzierten Dehydratation.[5]
| Rotaviren | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
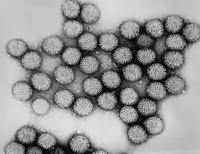
Humanes Rotavirus | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Rotavirus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| RVA bis RVJ | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Rotaviren sind auch im Tierreich weit verbreitet. Im veterinärmedizinischen Bereich haben Rotavirusinfektionen von Kälbern eine große wirtschaftliche Bedeutung.
Aufbau der Rotaviren
Humane Rotaviren sind 76 nm große RNA-Viren mit einem doppelschaligen ikosaedrischen Kapsid. Eine Virushülle ist nicht vorhanden. Das Genom besteht aus elf doppelsträngigen RNA-Segmenten von 0,6 bis 3,3 kb Länge. Jedes dieser Segmente codiert ein virales Protein. Durch die Segmentierung des Genoms besteht die Möglichkeit der Reassortantenbildung.[6]
Klassifikation
Humane Rotaviren gehören zur Familie der Reoviridae, Unterfamilie Sedoreovirinae. Insgesamt sind neun Spezies innerhalb der Gattung Rotavirus bekannt, bezeichnet mit Rotavirus A bis Rotavirus J* (International Committee on Taxonomy of Viruses (ICTV), Stand 2020).[7] Menschen sind in erster Linie mit den Spezies A, B und C infiziert, am häufigsten mit Spezies A. Letztere ist damit die klinisch wichtigste.[3] Die Spezies A bis E* verursachen auch bei Tieren Krankheiten,[8] so etwa Spezies E und H bei Schweinen, Spezies D, F und G bei Vögeln, Spezies I bei Katzen und Spezies J bei Langflügelfledermäusen.[9][10][11][12]
Für die Serotypen innerhalb der Spezies Rotavirus A[13] fand ursprünglich ein duales Klassifizierungssystem ähnlich wie beim Grippevirus Influenzavirus A[14] Anwendung, das auf der Reaktivität der Epitope zweier Proteinen auf der Oberfläche des Virions basierte. Das Glycoprotein VP7 definierte die G-Serotypen und das protease-sensitive Protein VP4 die P-Serotypen.[15] Dieses wurde abgelöst durch ein G-/P-Genotyp-System.[15] Hierbei werden die Gene von VP4 und VP7 klassifiziert.
Da die beiden Gene, die G- und P-Genotypen bestimmen, getrennt an die Tochterviren weitergegeben werden können, werden – wie bei Influenza – unterschiedliche Kombinationen gefunden.[15] Für Rotaviren der Gruppe A wurde ein Typisierungssystem für das gesamte Genom aufgestellt, das zur Bestimmung der Herkunft atypischer Linien verwendet werden kann.[16] Die Verbreitung von Rotaviren der einzelnen G- und P-Typen variiert ebenfalls wie bei den H/N-Typen der Grippeviren von Land zu Land und Jahr zu Jahr.[17] Die G- und P-Antigentypen sind variabel kombinierbar.[3] Ist der G-Genotyp bekannt, wird dies durch eine arabische Zahl dargestellt (z. B. G1), ein bekannter P-Genotyp durch eine in arabische Zahl in eckigen Klammern (z. B. P[8]).[15][8] Es sind 32 G- und 51 P-Typen bekannt,[18] humanpathogen sind davon nur wenige Kombinationen (G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] and G12P[8]).[19]
Übertragung
Die Infektion mit Rotaviren erfolgt meist klassisch fäkal-oral, wobei kontaminierte Lebensmittel und kontaminiertes Trinkwasser eine Rolle spielen können. Eine Übertragung durch Aerosole über die Luft ist experimentell möglich.[20] Im Anschluss an eine schwere Erkrankung wird der Erreger üblicherweise für ca. ein bis drei Wochen ausgeschieden. Eine Ausscheidung ist jedoch bis zu acht Wochen nach Erkrankung möglich.[21] Bei Patienten mit Immundefizienz ist eine längere Ausscheidung möglich.[22] Der Erreger kann Tage auf Oberflächen überleben und über Wochen in Wasser (hohe Tenazität). Auch auf Händen kann der Erreger überleben.[23] Eine hohe Durchseuchung bereits im Kindesalter liegt an der geringen Infektionsdosis von nur 10 Viruspartikel, der hohen Konzentrationsdichte im Durchfall (etwa 1011 infektiöse Partikel pro Milliliter) sowie der hohen Umwelttoleranz des Erregers.[3]
Epidemiologie
Rotaviren sind weltweit verbreitet. Bis zum Ende des dritten Lebensjahres haben die meisten Kinder (>90 %) bereits eine Rotavirusinfektion durchgemacht. In Deutschland werden im Schnitt pro Jahr etwa 50.000 Erkrankungsfälle gemeldet[24]. Die meisten Erkrankungsfälle treten zwischen den Monaten Februar bis April auf (gemäßigte Zonen). Dagegen treten in den Tropen Erkrankungen ganzjährig auf.[3] Im Laufe der ersten Lebensjahre werden infolge von Kontakten mit Rotaviren zunehmend Antikörper gebildet. Frühere Erkrankungen können bei einer späteren Reinfektion mit demselben bzw. anderen Rotaviren-Typen vor erneuter Erkrankung schützen. Zwar erkrankt man, wenn überhaupt, nur leicht, Infizierte scheiden aber infektiöse Viren aus und sind damit Überträger.[3] Im Erwachsenenalter treten Erkrankungen vor allem als Reisediarrhoe auf, wobei nur ca. 20 % der Reisediarrhoen durch Rotaviren entstehen. Die schwersten Krankheitsverläufe sind in der Altersgruppe zwischen sechs Monaten und zwei Jahren zu finden. In den gemäßigten Klimazonen sind Rotavirusinfektionen hauptsächlich während der Wintermonate zu beobachten. Außer bei Kindern sind schwere Erkrankungen durch Rotavirusinfektion bei Älteren oder Immunsupprimierten zu verzeichnen.
Krankheitsbilder und Physiologie
Nach einer Inkubationszeit von ein bis drei Tagen treten die klinischen Symptome auf.[3] Die Infektion kann aber auch klinisch inapparent, d. h. ohne Symptome auftreten. Häufig beginnen die Symptome mit Erbrechen, gefolgt von mäßigem Fieber und nichtblutigem Diarrhoe, Bauchschmerzen sind dagegen selten.[3] Bei schweren Krankheitsverläufen kann der Durchfall vier bis fünf Tage andauern und durch den daraus folgenden Wasser- und Elektrolytverlust zur Exsikkose führen, die potentiell lebensbedrohlich sein kann. Dies und die auftretende metabolische Azidose können zu Herzrhythmusstörungen bis zum Herzstillstand führen.[3] Die übliche Erkrankungsdauer beträgt sechs bis acht Tage. Bei Kleinkindern kann die Infektion mit Rotaviren als besondere Komplikation auch zu einer Intussuszeption des Darmes führen, die operativ behandelt werden muss. Zudem können die Viren ins Blut gelangen (Virämie) und können Nieren und Leber befallen.[3]
Die Vermehrung der Erreger findet in den apikalen Enterozyten der Dünndarmzotten statt. Vermutlich wird durch das virale Protein (NSP4), das Eigenschaften eines Enterotoxins aufweist, die Wirkung noch verstärkt.
Nach etwa 10 bis 14 Tagen stoppt die Ausscheidung an Viren, Immunkompromittierte leiden dagegen monatelang an Durchfällen und diesbezüglicher Virusausscheidung.[3]
Diagnose
Die diagnostische Untersuchung auf Rotaviren erfolgt aus dem Stuhl meist mit einem Immunassay, der spezifisch ein Kapsidprotein als Antigen nachweist. Antigentests haben oft nur geringe analytische Sensitivität. Doch in der akuten Erkrankungsphase ist viel virales Antigen im flüssigen Stuhl vorhanden, sodass die Testempfindlichkeit reicht, um Rotaviren als Ursache zu bestätigen. Das Virus ist bei längerfristiger Ausscheidung ohne akute Infektionszeichen wegen geringer Antigenmenge mittels Antigentest nicht zu bestätigen.
Einfach ist der Nachweis im Stuhl mittels Elektronenmikroskopie, da die Rotaviren an ihrer typischen Morphologie gut zu erkennen sind. Für spezielle Fragestellungen zum Ausscheiderstatus oder zur Bestimmung der Subtypen für epidemiologische Untersuchungen ist eine RT-PCR zu empfehlen. Nur noch selten wird eine klassische Virusisolierung, RNA-Elektrophorese oder Nukleinsäurehybridisierungsreaktion verwendet.
Schnelltestverfahren zum Nachweis von Antigen sind zwar möglich, aber aufgrund geringer Sensibilität und nicht ausreichender Spezifität (falsch positive Ergebnisse) nur eingeschränkt verwertbar. Serologische Methoden zum Nachweis spezifischer Antikörper gegen Rotaviren haben diagnostisch keine Bedeutung.
Prophylaxe
Als Prophylaxemaßnahme dient die Einhaltung allgemeiner Hygienestandards sowie die Isolierung von Patienten bei einer stationären Aufnahme, eventuell in einer Kohortenisolierung. Aufgrund der hohen Tenazität des Erregers ist eine hohe Compliance essentiell, zur Oberflächendesinfektion sollten viruzide Mittel verwendet werden.[3]
Impfung
In Europa stehen zwei verschiedene Rotavirusimpfstoffe zur Verfügung: Ein monovalenter Impfstoff (Rotarix® von GlaxoSmithKline) – RV1 – sowie ein pentavalenter Impfstoff RV5 (RotaTeq von Sanofi Pasteur MSD).[25] Das Impfschema besteht aus zwei bzw. drei Teilimpfungen. Es handelt sich um Schluckimpfungen. Die Immunisierung muss mit der vollendeten 24. (Rotarix) bzw. 32. (RotaTeq) Lebenswoche abgeschlossen sein. Im August 2013 wurde die Rotavirusimpfung in den Impfkalender der STIKO aufgenommen und wird in Deutschland für Säuglinge ab einem Alter von sechs Wochen empfohlen.[26][27] Ohne Impfung erkrankt bis zum fünften Lebensjahr nahezu jedes Kind an Rotaviren.[28] Neben dem Schutz vor der Rotavirusinfektion gibt es in den USA auch Hinweise auf einen Rückgang von Krampfanfällen nach Rotavirusimpfung.[29]
In Indien ist seit 2014 ein dritter, monovalenter Impfstoff zugelassen: Rotavac.[30] RV1, RV5 sowie Rotavac sind von der WHO vorqualifiziert und gelten als sicher und wirksam.[30]
Eine Schluckimpfung gegen Rotaviren (RotaShield von Wyeth Lederle) wurde 1998 in den USA in den normalen Impfplan aufgenommen, am 15. Oktober 1999 jedoch wieder zurückgezogen, nachdem landesweit 76 Fälle einer Intussuszeption (Darmeinstülpung) aufgetreten waren und ein möglicher Zusammenhang mit der Impfung angegeben wurde. Nach intensiven klinischen Studien sind seit dem 2. Quartal 2006 wieder Rotavirus-Impfungen für Kinder im Alter bis zu sechs Monaten in Europa und den USA zugelassen. Eine klinische Studie zu Rotarix – mit 615 untersuchten Intussuszeptionen aus Brasilien und Mexiko – wurde im Juni 2011 im New England Journal of Medicine publiziert.[31] In der Fallkontrollstudie wurde ein leicht erhöhtes Risiko konstatiert, aber für beide Länder eine positive Nutzen-Risiko-Bilanz.
Laut einer Studie der australischen Therapeutic Goods Administration zeigte sich (ohne Differenzierung des Impfzeitpunkts) ein um den Faktor 3,5 (0,7–10,1) gesteigertes Risiko der Intussusception, während für RotaTeq ein um den Faktor 5,3 erhöhtes Risiko (1,1–15,4) gefunden wurde.[32]
Harry Greenberg von der Stanford University deutete im NEJM die Resultate dahingehend, dass „Intussuszeptionen ein prinzipielles Risiko aller Rotavirus-Infektionen sind“, da beide Impfstoffe aus Lebendviren bestehen. Weil eine Impfung zu inapparenten Infektionen führt, könnte es aber sein, dass die Gefahr einer Erkrankung durch die Impfung geringer ist als bei einer Infektion mit dem Wildtyp. Das Risiko gilt aber als sehr gering, auf 100.000 geimpfte Säuglinge dürfte es zu 1 bis 5 Zwischenfälle kommen.[33]
Therapie
Eine spezielle Therapie existiert nicht, eine Therapie erfolgt rein symptomatisch. Es ist in jedem Fall auf eine ausreichende Flüssigkeitszufuhr (ggf. Elektrolytlösung) – oral oder parenteral – zu achten.[34] Von der Einnahme von Antidiarrhoika ist abzuraten, da diese die Ausscheidung des Erregers erschweren und somit den Krankheitsverlauf verlängern können.
Meldepflicht
Der Nachweis von Rotaviren ist in Deutschland nach § 7 Infektionsschutzgesetz (IfSG) namentlich meldepflichtig. Darüber hinaus nach § 6 IfSG Verdacht auf und die Erkrankung […] an einer akuten infektiösen Gastroenteritis, wenn der oder die Betroffene Umgang mit Lebensmittel hat, in einer Gemeinschaftseinrichtung arbeitet oder wenn nach dem epidemischem Zusammenhang ein Ausbruch zu vermuten ist (wenn zwei oder mehr gleichartige Erkrankungen auftreten, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird).[35] Zudem haben Leitungen von Gemeinschaftseinrichtungen gemäß § 34 Abs. 6 und Abs. 1 IfSG das zuständige Gesundheitsamt unverzüglich zu benachrichtigen, wenn in ihrer Einrichtung betreute Kinder, die das 6. Lebensjahr noch nicht vollendet haben und an infektiöser Gastroenteritis erkrankt oder dessen verdächtig sind.
Fußnote
Weblinks
- Rotavirus-Infektionen – Informationen des Robert Koch-Instituts
Einzelnachweise
- ICTV Master Species List 2018b v1. MSL #34, Feb. 2019
- ICTV: Bluetongue virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Cornelia Henke-Gendo: Virale Gastroenteritiserreger. In: Sebastian Suerbaum, Gerd-Dieter Burchard, Stefan H. E.Kaufmann, Thomas F. Schulz (Hrsg.): Medizinische Mikrobiologie und Infektiologie. Springer-Verlag, 2016, ISBN 978-3-662-48678-8, S. 513 ff., doi:10.1007/978-3-662-48678-8_65.
- R.&nbp;F. Bishop et al.: Virus particles in epithelial cells of duodenal mucosa from children with acute non-bacterial gastroenteritis. In: Lancet (London, England). Band 2, Nr. 7841, 8. Dezember 1973, S. 1281–1283, doi:10.1016/s0140-6736(73)92867-5, PMID 4127639.
- WHO | Rotavirus. In: www.who.int. Abgerufen am 9. Dezember 2018.
- Ulrich Desselberger: Rotaviruses. In: Virus Research. Band 190, 22. September 2014, S. 75–96, doi:10.1016/j.virusres.2014.06.016.
- International Committee on Taxonomy of Viruses (ICTV). Abgerufen am 13. April 2020 (englisch).
- Carl D. Kirkwood: Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs. In: The Journal of Infectious Diseases. 202 Suppl, 1. September 2010, S. S43–48, doi:10.1086/653548, PMID 20684716.
- Mitsutaka Wakuda et al.: Porcine rotavirus closely related to novel group of human rotaviruses. In: Emerging Infectious Diseases. Band 17, Nr. 8, August 2011, S. 1491–1493, doi:10.3201/eid1708.101466, PMID 21801631, PMC 3381553 (freier Volltext).
- Douglas Marthaler et al.: Widespread rotavirus H in commercially raised pigs, United States. In: Emerging Infectious Diseases. Band 20, Nr. 7, Juli 2014, S. 1195–1198, doi:10.3201/eid2007.140034, PMID 24960190, PMC 4073875 (freier Volltext).
- Tung G. Phan et al.: Rotavirus I in feces of a cat with diarrhea. In: Virus Genes. Band 53, Nr. 3, Juni 2017, S. 487–490, doi:10.1007/s11262-017-1440-4, PMID 28255929, PMC 7089198 (freier Volltext).
- Krisztián Bányai et al.: Candidate new rotavirus species in Schreiber’s bats, Serbia. In: Infection, Genetics and Evolution. Band 48, 1. März 2017, S. 19–26, doi:10.1016/j.meegid.2016.12.002.
- Miguel O’Ryan: The ever-changing landscape of rotavirus serotypes. In: The Pediatric Infectious Disease Journal. Band 28, 3 Suppl, März 2009, S. S60–62, doi:10.1097/INF.0b013e3181967c29, PMID 19252426.
- dort mit H und N klassifiziert
- John T. Patton: Rotavirus diversity and evolution in the post-vaccine world. In: Discovery Medicine. Band 13, Nr. 68, Januar 2012, S. 85–97, PMID 22284787, PMC 3738915 (freier Volltext).
- My V. T. Phan et al.: Unbiased whole-genome deep sequencing of human and porcine stool samples reveals circulation of multiple groups of rotaviruses and a putative zoonotic infection. In: Virus Evolution. Band 2, Nr. 2, Juli 2016, S. vew027, doi:10.1093/ve/vew027, PMID 28748110, PMC 5522372 (freier Volltext).
- Beards GM, Desselberger U, Flewett TH: Temporal and geographical distributions of human rotavirus serotypes, 1983 to 1988. In: Journal of Clinical Microbiology. Vol. 27, Nr. 12, Dezember 1989, S. 2827–33, PMID 2556435, PMC 267135 (freier Volltext).
- Susan Afua Damanka et al.: Genetic analysis of Ghanaian G1P[8] and G9P[8] rotavirus A strains reveals the impact of P[8] VP4 gene polymorphism on P-genotyping. In: PLOS ONE. Band 14, Nr. 6, 26. Juni 2019, S. e0218790, doi:10.1371/journal.pone.0218790, PMID 31242245, PMC 6594640 (freier Volltext).
- Hiroshi Suzuki: Rotavirus Replication: Gaps of Knowledge on Virus Entry and Morphogenesis. In: The Tohoku Journal of Experimental Medicine. Band 248, Nr. 4, August 2019, S. 285–296, doi:10.1620/tjem.248.285, PMID 31447474.
- D. S. Prince et al.: Aerosol transmission of experimental rotavirus infection. In: Pediatric Infectious Disease. Band 5, Nr. 2, März 1986, S. 218–222, doi:10.1097/00006454-198603000-00012, PMID 3005999.
- Simone Richardson, Keith Grimwood, Rebecca Gorrell, Enzo Palombo, Graeme Barnes: Extended excretion of rotavirus after severe diarrhoea in young children. In: The Lancet. Band 351, Nr. 9119, 20. Juni 1998, S. 1844–1848, doi:10.1016/s0140-6736(97)11257-0.
- Shou-Chien Chen, Lia-Beng Tan, Li-Min Huang, Kow-Tong Chen: Rotavirus infection and the current status of rotavirus vaccines. In: Journal of the Formosan Medical Association. Band 111, Nr. 4, 1. April 2012, S. 183–193, doi:10.1016/j.jfma.2011.09.024.
- S. A. Ansari, V. S. Springthorpe, S. A. Sattar: Survival and vehicular spread of human rotaviruses: possible relation to seasonality of outbreaks. In: Reviews of Infectious Diseases. Band 13, Nr. 3, 1. Juni 1991, S. 448–461, PMID 1866549.
- Robert Koch-Institut: SurvStat@RKI 2.0. Abgerufen am 31. Mai 2016.
- Rotavirus-Impfstoffe. Paul-Ehrlich-Institut, 23. März 2020, abgerufen am 13. April 2020.
- Neuer Impfkalender: Experten raten zur Impfung gegen Rotaviren. In: Spiegel Online. 26. August 2013, abgerufen am 21. Januar 2015.
- Epidemiologisches Bulletin 35/2013 (PDF) Robert Koch-Institut.
- Matthias Thalhammer, Lisa Demel: Rotavirus - Impfung. In: Netdoktor.at. 1. April 2011, abgerufen am 9. Dezember 2018.
- D. C. Payne, J. Baggs u. a.: Protective association between rotavirus vaccination and childhood seizures in the year following vaccination in US children. In: Clinical infectious diseases, Band 58, Nummer 2, Januar 2014, S. 173–177, ISSN 1537-6591. doi:10.1093/cid/cit671. PMID 24265355.
- Karla Soares-Weiser et al.: Vaccines for preventing rotavirus diarrhoea: vaccines in use. In: The Cochrane Database of Systematic Reviews. Band 2019, Nr. 10, 28. Oktober 2019, doi:10.1002/14651858.CD008521.pub5, PMID 31684685, PMC 6816010 (freier Volltext).
- M. M. Patel, V. R. López-Collada u. a.: Intussusception risk and health benefits of rotavirus vaccination in Mexico and Brazil. In: The New England Journal of Medicine. Band 364, Nummer 24, Juni 2011, S. 2283–2292, doi:10.1056/NEJMoa1012952. PMID 21675888.
- J. P. Buttery, M. H. Danchin u. a.: Intussusception following rotavirus vaccine administration: post-marketing surveillance in the National Immunization Program in Australia. In: Vaccine. Band 29, Nummer 16, April 2011, S. 3061–3066, doi:10.1016/j.vaccine.2011.01.088. PMID 21316503.
- Rotavirus-Impfung: Studien bestätigen minimales Risiko von Intussuszeptionen. In: Deutsches Ärzteblatt. 10. Februar 2014, abgerufen am 13. April 2020.
- Wolfgang Jilg: Rotavirus. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 267 ff.
- Rotaviren-Gastroenteritis. In: RKI-Ratgeber für Ärzte. Robert Koch-Institut, 1. Mai 2010, abgerufen am 18. März 2020.