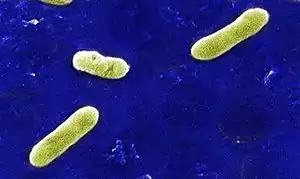
Bordetella bronchiseptica
Bordetella bronchiseptica ist ein Bakterium aus der Gattung Bordetella, dem als Erreger verschiedener Tierkrankheiten große veterinärmedizinische Bedeutung zukommt. Es handelt sich um kleine, gramnegative Stäbchen, die sich nur schwer von den verwandten Arten Bordetella pertussis und Bordetella parapertussis (die Krankheitserreger des Keuchhustens) unterscheiden lassen. Die Zellen wachsen strikt aerob, benötigen also Sauerstoff für ihre Vermehrung. Bei der Kultivierung auf Nährmedien wird manchmal eine Veränderung des Aussehens der Kolonien beobachtet, die mit einer Veränderung des virulenten Verhaltens von Bordetella bronchiseptica einhergeht.
| Bordetella bronchiseptica | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Bordetella bronchiseptica | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bordetella bronchiseptica | ||||||||||||
| (Ferry 1912) Moreno-Lopez 1952 |
Bei der Entdeckung von Bordetella bronchiseptica wurde fälschlicherweise angenommen, sie sei der Krankheitserreger der Staupe beim Hund. Erst später wurde erkannt, dass durch sie bei mehreren Säugetieren (z. B. Hund, Katze und Schwein) eine bakterielle Infektionskrankheit des Atemtraktes hervorgerufen wird. An diesen Erkrankungen sind oft auch noch andere Bakterien oder Viren beteiligt. Von einer Übertragung auf den Menschen ist in Einzelfällen berichtet worden, dies betrifft jedoch vor allem Patienten mit einem geschwächten Immunsystem. Zur Vorbeugung ist bei Haus- und Nutztieren eine Impfung möglich.
Bordetella bronchiseptica wurde 1911 von Newell S. Ferry entdeckt und zunächst als Bacillus bronchicanis bezeichnet. Das Bakterium wurde auch als Bacillus bronchisepticus benannt und ist noch unter weiteren Synonymen bekannt. Das Genom des Bakterienstammes Bordetella bronchiseptica RB50 wurde 2003 vollständig sequenziert.
Merkmale
Erscheinungsbild

Die Zellen von Bordetella bronchiseptica sind kurze bis kokkoide Stäbchen. Sie sind gramnegativ. Die Art ist im Gegensatz zu Bordetella pertussis motil,[1] sie kann sich mit Hilfe von peritrich angeordneten Geißeln selbständig bewegen.[2] Endosporen als Überdauerungsformen werden nicht gebildet.[3] Die Zellen tragen Pili (Fimbrien) auf ihrer Oberfläche[2] und sind von einer Kapsel umgeben. Sie erscheinen wie andere Vertreter der Gattung Bordetella im lichtmikroskopischen Bild einzeln, in Paaren oder in Gruppen gelagert und lassen sich nur schwer von Haemophilus-Arten unterscheiden.[4]
Auf festen Nährböden wachsen die Zellen zu sehr kleinen, transparenten Kolonien heran, deren Durchmesser 0,5–1,0 mm beträgt.[5] Im Vergleich zu Bordetella parapertussis sind die Kolonien noch kleiner. Auf Blutagar findet eine Hämolyse statt, dies gilt auch für die verwandten Arten B. pertussis und B. parapertussis.[4] Eine Pigmentbildung auf anderen Nährmedien tritt nicht auf.[6] Die Kolonien unterliegen der vierphasigen S-R-Modulation, wobei die Veränderung von der S- zur R-Form spontan erfolgen kann.[7] Die Abkürzungen S und R stehen für das Aussehen der Kolonien, von englisch smooth, „glatt“ und englisch rough, „rau“ (siehe Griffiths Experiment).
- Phase I: Die Kolonien wachsen in der S-Form, die Zellen bilden eine Kapsel aus, sind hämolysierend und virulent.
- Phase II: Übergangsform
- Phase III: Übergangsform, die Zellen bilden keine Kapsel aus.
- Phase IV: Die Kolonien bilden die R-Form aus, die Zellen sind nicht von einer Kapsel umgeben, sie sind nicht virulent.
Wachstum und Stoffwechsel
Der Stoffwechsel von Bordetella bronchiseptica beruht auf der Atmung, die Art ist strikt aerob, benötigt also Sauerstoff zum Wachsen.[3] Der Katalase-Test[8] und der Oxidase-Test verlaufen positiv.[6] Weiterhin ist der Stoffwechsel als chemoorganotroph und heterotroph zu kennzeichnen, B. bronchiseptica benutzt organische Verbindungen als Energiequelle und ebenso zum Aufbau zelleigener Stoffe. Dabei ist sie asaccharolytisch, d. h. sie kann keine Zucker (z. B. Glucose) verwerten, stattdessen gehören Aminosäuren zu den Substraten, die abgebaut werden.[3] Dies muss bei der Wahl des passenden Nährmediums zur Kultivierung berücksichtigt werden, wobei B. bronchiseptica nicht so anspruchsvoll ist wie B. pertussis.[5]
Die optimale Temperatur für das Wachstum liegt bei 35–37 °C.[9] Wachstum erfolgt in einem Temperaturbereich von 15–37 °C. Bei Temperaturen darunter (10 °C) bzw. darüber (44 °C) ist das Wachstum variabel, das bedeutet, einige der untersuchten Bakterienstämme sind noch in der Lage, sich zu vermehren. Bei 15 °C dauert es etwa 10 Tage, bis Kolonien erkennbar sind,[6] bei 35 °C wird üblicherweise 1–2 Tage inkubiert.[5] B. bronchiseptica kann geringe Mengen Natriumchlorid (Kochsalz) im Nährmedium tolerieren. Wachstum ist bei einem Gehalt von 6 % Natriumchlorid möglich, erst bei einem Gehalt von 7,5 % NaCl oder mehr erfolgt kein Wachstum mehr. Sie ist nicht halophil, da sie sich auch in Abwesenheit von Natriumchlorid vermehren kann. Auch in der Anwesenheit von Gallensalzen erfolgt Wachstum, ein Gehalt von 10 % wird toleriert, und sogar bei einem Gehalt von 40 % Gallensalzen im Nährmedium erfolgt noch das Wachstum bei einigen der untersuchten Stämme.[6]
Biochemische Merkmale, wie beispielsweise die vorhandenen Enzyme und die daraus resultierenden Stoffwechseleigenschaften können in einer Bunten Reihe zur Identifizierung von B. bronchiseptica verwendet werden. Neben dem positiven Katalase- und Oxidase-Test können folgende Merkmale herangezogen werden: Sie verhält sich positiv im Test auf Nitratreduktion, sie kann folglich Nitrat zu Nitrit reduzieren. Der Urease-Test fällt bei vielen Stämmen positiv aus, sie besitzen somit das Enzym Urease und sind in der Lage Harnstoff abzubauen. Allerdings gibt es mehrere Urease-negative Stämme, so dass das Testergebnis für die Art als variabel angegeben wird. Gelatine, Casein oder Stärke können nicht durch Hydrolyse abgebaut werden. Ebenso wenig ist sie zur Äskulinhydrolyse fähig. Sie verfügt über das Enzym Arginindihydrolase (ADH) und kann daher die Aminosäure Arginin abbauen, auch Tyrosin kann hydrolysiert werden.[6] Außerdem kann sie die Aminosäuren L-Glutaminsäure und L-Prolin abbauen.[10]
Weitere organische Verbindungen, die als Energiequelle und zum Aufbau zelleigener Stoffe verwertet werden können, sind Citrat, Pyruvat, Succinat, Acetat, Adipat und Itaconat.[10] Schwefelwasserstoff (H2S) wird nicht gebildet. Der Voges-Proskauer-Test auf Acetoin-Bildung und der Indol-Test[3] verlaufen negativ. Da keine Kohlenhydrate abgebaut werden, erfolgt auch keine Säurebildung, somit ist die Methylrot-Probe ebenfalls negativ.[6] Die Abgrenzung zu B. parapertussis und B. pertussis ist schwierig, da die drei Arten in vielen stoffwechselphysiologischen und biochemischen Merkmalen Gemeinsamkeiten zeigen, sie können allerdings anhand einiger Merkmale unterschieden werden (vergleiche Übersicht).
Serologische Merkmale
Bordetella bronchiseptica besitzt auf ihrer Zellwand aufgelagerte Lipopolysaccharide (LPS). Sie sind Bestandteil der äußeren Membran und typisch für gramnegative Bakterien. Die LPS bestehen aus fettähnlichen Bestandteilen, verbunden mit Oligosacchariden (Zuckerbestandteilen), die als Antigen wirken und serologisch für den Nachweis verwendet werden können, da sie sich von den LPS der verwandten Arten unterscheiden.[4] Weiterhin sind auch Proteine ein Bestandteil der äußeren Membran, sie werden häufig als OMP abgekürzt, nach der englischen Bezeichnung outer membrane proteins. Sie wirken ebenfalls als Antigen und bewirken eine Agglutination, wenn sie mit den passenden Antikörpern zusammentreffen.[11]
Die bereits beschriebene S-R-Modulation hat auch Auswirkungen auf das serologische Verhalten, da manche als Antigen wirkende Strukturen bei der R-Form nicht mehr vorhanden sind.[4] Auch die Virulenzfaktoren werden von der R-Form nicht mehr ausgebildet, daher ist sie nicht mehr virulent.[7] Ein ähnlicher Effekt kann durch die Veränderung der Umweltbedingungen hervorgerufen werden, so überwiegt beim Wachstum bei niedrigen Temperaturen eine Form mit veränderten Antigenen, die ebenfalls nicht mehr virulent ist. Sowohl die S-R-Modulation als auch die Antigen-Modulation sind reversibel und werden durch einen Genlocus gesteuert. Die virulenten Stämme werden auch als Bvg+ bezeichnet, die avirulenten als Bvg−.[4]
Genetik
Das Genom des Bakterienstammes Bordetella bronchiseptica RB50 (auch unter der Bezeichnung ATCC BAA-588 geführt) wurde bereits 2003 vollständig sequenziert.[12] Dabei handelt es sich um einen Stamm, der als tierpathogener Erreger von einem Kaninchen isoliert wurde. Das Genom weist eine Größe von 5339 Kilobasenpaaren (kb) auf,[9] was in etwa 115 % der Genomgröße von Escherichia coli entspricht. Es liegt als zirkuläres Bakterienchromosom vor. Es sind 4994 Proteine annotiert.[13] Der Vergleich mit der Genomgröße von B. parapertussis (4774 kb) und B. pertussis (4086 kb) zeigt, dass das Genom von B. bronchiseptica größer ausfällt. Dies wird damit erklärt, dass sich die anderen beiden Arten aus einer früheren Form von B. bronchiseptica entwickelt haben und ihre Beschränkung auf einen Wirt (den Menschen) dazu geführt hat, dass nicht mehr „benötigte“ Gene verloren gegangen sind.[12]
Bis 2013 wurde das Genom von fünf weiteren Stämmen – B. bronchiseptica 253, 1289, MO149, Bbr77 und D445 – sequenziert und veröffentlicht. Diese Stämme wurden vom Menschen oder Säugetieren isoliert. Die Genomgrößen fallen etwas kleiner aus als bei dem zuerst untersuchten Stamm und liegen in einem Bereich von 4970 bis 5264 kb. Bei dieser Untersuchung wurden auch Stämme der verwandten Arten sequenziert und bestätigt, dass deren Genomgröße geringer ist.[14] Die Ergebnisse der Sequenzierungen zeigen einen hohen GC-Gehalt (den Anteil der Nukleinbasen Guanin und Cytosin) in der Bakterien-DNA, der bei etwa 68 Mol-Prozent liegt.[13] Nach den Ergebnissen der Genomuntersuchungen von 2013 enthält kein Stamm von B. bronchiseptica ein Plasmid, diese Besonderheit wurde nur bei B. parapertussis Bpp5 (von einem Schaf isoliert) gefunden.[14]
Zu einem anderen Ergebnis kommt eine Untersuchung von 1997. Hiernach wurden 52 antibiotikaresistente Stämme, die von Katzen isoliert wurden, untersucht und bei zehn wurden Plasmide gefunden. Mit Hilfe von Konjugationsexperimenten wurde versucht, die Plasmide in den Stamm Escherichia coli K12 zu übertragen, was jedoch nur bei zwei Plasmiden gelang. Diese Plasmide sind jeweils 51 kb groß und tragen die genetische Information für eine Antibiotikaresistenz gegen Ampicillin, Tetracyclin, Streptomycin und Sulfonamide. Die Resistenz beruht zum einen auf Bildung einer Penicillinase, die den β-Lactam-Ring des Ampicillins spaltet und im Fall der Tetracyclinresistenz auf einem Effluxmechanismus.[15]
Im Genom der drei „klassischen“ Spezies fehlen die Gene für wichtige Enzyme, die am Zuckerstoffwechsel beteiligt sind. Dies betrifft die Glucokinase und die Phosphofructokinase (Enzyme der Glykolyse), sowie die Fructose-1,6-bisphosphatase, die unter anderem am Pentosephosphatweg beteiligt ist. Dies erklärt den asaccharolytischen Stoffwechsel von B. bronchiseptica.[12] Auch das Enzym Urease ist Gegenstand von genetischen Untersuchungen. Bei B. bronchiseptica sind viele Stämme Urease-positiv, sie besitzen also das Enzym, jedoch treten auch Urease-negative Stämme auf.[6] Das Urease-Operon besteht aus Strukturgenen und zusätzlichen Genen, wobei zwei davon (ureE und ureF) miteinander fusioniert sind und dadurch ein Fusionsprotein (UreEF) gebildet wird. Weiterhin ist ein Regulatorgen (B. bronchiseptica Urease-Regulator, BbuR) zu finden, das die Genexpression des Urease-Operons steuert und mit dem Schutz des Bakteriums vor lysosomaler Beschädigung in Verbindung gebracht wird. Im Promotor von BbuR auftretende Mutationen sind demnach verantwortlich für das unterschiedliche Verhalten der Exprimierung von Urease.[16]
Nachweise
Zur Kultivierung sind einfache Nährmedien geeignet, falls sie Aminosäuren oder Pepton enthalten. Häufig wird zur Kultivierung, wie auch für andere Bordetellen, Blutagar verwendet. Allerdings zeigt Bordetella bronchiseptica keine Hämolyse, falls Pferdeblut eingesetzt wird,[6] bei Verwendung von Schafblut erfolgt eine Hämolyse nur bei Kolonien der Phase I.[2] Auch die für B. parapertussis verwendeten Nährmedien Bordet-Gengou-Blutagar und Regan-Lowe-Nähmedium sind geeignet.[1] Ebenso können MacConkey-Agar[10] und Salmonella-Shigella-Agar verwendet werden. Nach Inkubation über 1–2 Tage bei 35–37 °C lassen sich Kolonien erkennen. Die auf den Nährmedien herangewachsene Bakterienkultur kann dann biochemisch untersucht werden, um sie von den verwandten Bordetella-Arten zu unterscheiden.[5][4]
Es wurde in der Vergangenheit diskutiert, ob nur Urease-positive Stämme als virulent anzusehen sind. Dies konnte durch Tierversuche mit Mäusen und Meerschweinchen als Modellorganismen widerlegt werden. Es wurde gezeigt, dass die Exprimierung von Urease keinen Einfluss auf die Ansiedelung und das Verbleiben des Bakteriums im Respirationstrakt von Mäusen hat.[17] Ebenso war eine Urease-negative Mutante von B. bronchiseptica in der Lage, den Atem- und Verdauungstrakt von Meerschweinchen zu kolonisieren.[18] Dennoch wird eine Untersuchung der phänotypischen Merkmale Urease-Aktivität und die Affinität zu Kongorot empfohlen, um virulente B. bronchiseptica-Stämme (Bvg+) zu erkennen. Die Ausbildung von Virulenzfaktoren wurde damit verglichen und festgestellt, dass bei einer Bindung von Kongorot von mindestens 26 nmol/ml (Nanomol pro Milliliter) und einer Urease-Aktivität von weniger als 2,6 U (Einheit zur Angabe der Enzymaktivität) ein virulenter Phänotyp vorliegt.[11]
Neben serologischen Nachweisen werden auch molekularbiologische Methoden eingesetzt. Mit Hilfe des PCR-Verfahrens (Polymerase-Kettenreaktion) werden bestimmte Teile des bakteriellen Genoms nachgewiesen, was wesentlich spezifischer als serologische oder biochemische Testmethoden ist. Ein 2013 in Frankreich entwickeltes Verfahren beruht auf der Real Time Quantitative PCR (q-PCR) und zielt auf den Nachweis von B. bronchiseptica und B. parapertussis ab, die damit nachgewiesen und voneinander unterschieden werden können.[19]
Vorkommen
Das Habitat von Bordetella bronchiseptica ist der Respirationstrakt verschiedener Säugetiere, darunter Hunde, Katzen, Schweine, Pferde, Kaninchen, Hamster, Ratten, Mäuse und Meerschweinchen, bei denen sie Erkrankungen der Atemwege verursachen kann.[2][4][5][13] Auch beim Menschen kann sie gefunden werden, dies ist jedoch selten und wird auf engen Kontakt mit einem erkrankten Tier zurückgeführt.[4] Anders als die verwandten Arten kann B. bronchiseptica längere Zeit in der Umwelt überleben.[13]
Entdeckung
Bordetella bronchiseptica wurde 1911 in einer Veröffentlichung von Newell S. Ferry als Bacillus bronchicanis bezeichnet. Ferry war auf der Suche nach dem Krankheitserreger der Staupe und untersuchte über mehrere Jahre daran erkrankte Hunde. Zu der damaligen Zeit wurden die Symptome der bei der Staupe ablaufenden Atemwegserkrankung mit dem Keuchhusten verglichen. Ferry nahm Abstriche des Augen- und Nasensekrets und konnte nach der Kultivierung mehrere unterschiedliche Bakterienarten, unter anderem Staphylokokken, Streptokokken und Bazillen nachweisen. Er ordnete diese als Erreger einer Sekundärinfektion ein und stellte die Hypothese auf, dass viele Todesfälle eigentlich auf diese Bakterien zurückzuführen seien und nicht auf den eigentlichen Krankheitserreger der Staupe.[20] Durch die Autopsie getöteter Hunde und die mikrobiologische Untersuchung von Proben aus Lungen-, Luftröhren- und Kehlkopfgewebe gelang es Newell S. Ferry 1908 erstmals, Reinkulturen eines „Bacillus“ anzuzüchten. In seinem Bericht erwähnte er, dass die Kolonien sehr langsam wachsen und sich nach 24 Stunden nur mit Hilfe einer Lupe auf dem Nährmedium erkennen lassen. Dieses Bakterium bezeichnete er als Bacillus bronchicanis und beschrieb in den damaligen Untersuchungen das immer noch zutreffende Erscheinungsbild der Zellen.[21]
Um zu beweisen, dass das isolierte Bakterium tatsächlich die Krankheit verursacht, befolgte Ferry die Kochschen Postulate. Dazu führte er zahlreiche Tierversuche mit jungen Hunden durch. Er achtete dabei auf eine möglichst sterile Umgebung der Hunde. Sie wurden in gereinigten Laborräumen untergebracht, zu denen nur eine beschränkte Anzahl von Personen Zutritt hatte, bei denen ebenfalls durch Desinfektionsmaßnahmen sichergestellt werden sollte, dass sie nicht andere Krankheitserreger als Kontaminanten mitführten. Die als gesund beurteilten Hunde wurden anschließend mit dem Bakterium in einem flüssigen Nährmedium infiziert, beispielsweise über die Nasenlöcher, und über erfolgte Erkrankungen Bericht geführt. Aus den verstorbenen oder getöteten Tieren wurde anschließend versucht, Bacillus bronchicanis wieder zu isolieren. Dies gelang in vielen Fällen, jedoch mit der Einschränkung, dass die Proben von Tieren in einem frühen Krankheitsstadium stammten, bei denen zwar Atemwegserkrankungen auftraten, die aber noch nicht an Ausfluss aus den Augen oder der Nase litten.[22] Newell S. Ferry war der Meinung, dass durch seine Untersuchungen schlüssig bewiesen wurde, dass Bacillus bronchicanis der Erreger der Staupe ist.[23] Tatsächlich handelt es sich um ein Virus, das Canine Staupevirus, das bereits 1905 von Henri Carré entdeckt wurde. Jedoch wurde dies erst 1926 durch die Untersuchungen von George William Dunkin und Patrick Laidlaw anerkannt.[24] Nach eigenen Angaben war es Ferry bei seinen Untersuchungen nicht gelungen, das von Carré beschriebene „filtrierbare Virus“ nachzuweisen.[21]
Ferry infizierte in weiteren Untersuchungen andere Tierarten mit dem entdeckten Bacillus bronchicanis. Da auch diese Tiere Krankheitssymptome entwickelten, die an Staupe erinnerten, änderte er die Bezeichnung des Krankheitserregers 1912 zu Bacillus bronchisepticus, um zu verdeutlichen, dass nicht bloß der Hund zu den Wirten gehört.[25][6] Die Pathogenität des Bakteriums wurde 1912 auch von anderen Wissenschaftlern bei Versuchstieren, wie Katzen, Kaninchen und Meerschweinchen entdeckt und die Krankheit zunächst ebenfalls als eine Variante der bei Hunden auftretenden Staupe gedeutet.[5] In den 1960er und 1970er Jahren schließlich wurde Bordetella bronchiseptica abermals bei Versuchstieren (Katzen und Affen) als Krankheitserreger nachgewiesen und als Verursacher einer eigenständigen Infektionskrankheit bezeichnet.[2]
Systematik
Äußere Systematik
Bordetella bronchiseptica ist eine von mehreren Arten aus der Gattung Bordetella[26] in der Familie der Alcaligenaceae, diese wird zu der Ordnung der Burkholderiales in der Klasse der Betaproteobacteria gestellt. Die Gattung Alcaligenes, der B. bronchiseptica früher zugeordnet wurde, gehört ebenfalls der Familie Alcaligenaceae an.[27] Die Gattung Haemophilus, die morphologische Ähnlichkeit mit den Bordetellen aufweist, ist zu der Klasse der Gammaproteobacteria gestellt, während die Gattung Brucella, der B. bronchiseptica früher ebenfalls zugeordnet wurde, zu der Klasse der Alphaproteobacteria gehört.[27]
Innere Systematik
Von der Gattung Bordetella sind die Arten B. bronchiseptica, B. parapertussis und B. pertussis seit der ersten Hälfte des 20. Jahrhunderts bekannt, sie werden auch als „klassische“ Bordetella-Arten bezeichnet. Weitere Arten sind seit 1984 neu entdeckt worden, z. B. B. avium. Die zuerst entdeckten Arten ähneln sich auffallend, so dass auch eine Einordnung als Unterarten diskutiert wird.[3] Eine umfassende genetische Untersuchung von sieben Bakterienstämmen brachte 2012 neue Erkenntnisse bezüglich der phylogenetischen Beziehungen. Nur etwa 50 % des „Kern-Genoms“ (englisch pan-genome) tritt bei allen Stämmen auf, diese Diversität im Genom wird als Ursache für unterschiedliche Wirte oder verschiedene Pathogenitätsfaktoren angesehen.[14]
Nach der Untersuchung von erkrankten Hunden und Isolierung eines Bakteriums wurde dieses 1911 von Newell S. Ferry zunächst als Bacillus bronchicanis bezeichnet.[21] Kurz darauf erkannte er, dass der Erreger auch bei anderen Wirten auftritt und änderte die Bezeichnung 1912 zu Bacillus bronchisepticus. Dies gilt als Erstbeschreibung, da sich andere Wissenschaftler später in den meisten Fällen auf diesen Namen bezogen haben.[6] 1952 erfolgte die Etablierung der Gattung Bordetella durch Manuel Moreno López, zu der das Bakterium dann gestellt wurde.[28] B. bronchiseptica ist unter zahlreichen Synonymen bekannt, die darauf beruhen, dass das Bakterium wegen seiner Ähnlichkeit zu Vertretern anderer Gattungen (wie Alcaligenes oder Bacillus) zunächst diesen zugeordnet wurde. Synonyme sind Bacillus bronchicanis Ferry 1911, Bacillus bronchisepticus Ferry 1912, Bacterium bronchisepticus (Ferry 1912) Evans 1918, Alcaligenes bronchisepticus (Ferry 1912) Bergey u. a. 1925, Brucella bronchiseptica (Ferry 1912) Topley & Wilson 1929, Alcaligenes bronchicanis (Ferry 1911) Haupt 1935 und Haemophilus bronchisepticus (Ferry 1912) Wilson & Miles 1946.[29]
Von der Art B. bronchiseptica sind mehr als 70 Bakterienstämme bekannt.[29] Der Stamm B. bronchiseptica ATCC 19395 ist der Typusstamm der Art.[26] Es sind mehrere Bakterienstämme in verschiedenen Sammlungen von Mikroorganismen hinterlegt.[30] Bisher (Stand 2014) wurden sechs Bakterienstämme genetisch untersucht,[12][14] weitere Stämme werden zurzeit in weiteren Genomprojekten erforscht.[13]
Etymologie
Der Gattungsname wurde zu Ehren des belgischen Mikrobiologen Jules Bordet gewählt. Das Artepitheton setzt sich aus den lateinischen Worten bronchia („Bronchien“, „Luftwege in der Lunge“) und septicus zusammen, wobei septicus auf das griechische Wort sepsis („Fäulnis“) zurückgeführt wird. Damit wird auf die Pathogenität des Bakteriums verwiesen, da es zu einer Infektion der Bronchien führen kann.[26] Die ursprünglich von Ferry gewählte Bezeichnung als Bacillus bronchicanis beinhaltet das lateinische Wort canis für „Hund“, denn aus diesem hatte er das Bakterium isoliert.[6]
Humanmedizinische Bedeutung
Bordetella bronchiseptica kann beim Menschen Erkrankungen der Atemwege verursachen.[1] Auch eine Beteiligung als Erreger von Keuchhusten wird diskutiert.[3] Sie wird jedoch nicht häufig in menschlichen Isolaten nachgewiesen.[12] Eine Infektion des Menschen tritt selten auf und wird auf engen Kontakt mit einem erkrankten Tier zurückgeführt.[4] Falls eine Infektion auftritt, sind vor allem Patienten mit geschwächtem Immunsystem betroffen.[5]
So ergab 1999 eine Untersuchung bei HIV-Infizierten, dass bei neun von ihnen B. bronchiseptica in Bakterienkultur nachweisbar war. In acht Fällen war der Respirationstrakt infiziert, wobei die Symptome von mild verlaufenden Erkrankungen der oberen Atemwege bis zur Lungenentzündung reichten. Zwei Patienten hatten in ihrem Haushalt Kontakt zu Hunden, ein Patient zu Katzen.[31] Ein 2010 dokumentierter Fall beschreibt eine Patientin mit einer Nieren-Bauchspeicheldrüsen-Transplantation. Als Folge der Transplantation musste sie Immunsuppressiva einnehmen. Nach einer weiteren Operation entwickelte sich bei der Patientin eine Lungenentzündung, die mit den verabreichten Antibiotika nicht eingedämmt werden konnte. Es folgte eine Bronchoskopie, bei der Proben entnommen wurden, bei denen in Kultur B. bronchiseptica nachgewiesen wurde. Weitere Nachforschungen ergaben, dass der Hund der Patientin kurz zuvor mit einem Lebendimpfstoff, der B. bronchiseptica enthält, geimpft wurde. Es erfolgte jedoch kein Vergleich des genetischen Materials vom Impfstamm und dem bei der Patientin gefundenen Stamm, so dass kein Beweis vorliegt, dass sie durch den Impfstoff infiziert wurde.[32]
Auch Patienten mit Mukoviszidose (zystische Fibrose) können durch B. bronchiseptica gefährdet sein. Ein 2014 veröffentlichter Bericht beschreibt die Fälle von sieben, an Mukoviszidose erkrankten Kindern, bei denen insgesamt 23-mal B. bronchiseptica nachgewiesen wurde. Die bakterielle Infektion verschlimmerte die bereits vorhandenen Krankheitssymptome.[33] Als Konsequenz der zuvor beschriebenen Fälle wird jeweils auf die mögliche Übertragung des Krankheitserregers vom Haustier auf den Menschen hingewiesen, welches als Risiko für immunsupprimierte Patienten eingeschätzt wird.[31][32]
Zu einer ähnlichen Bewertung kommt auch die Biostoffverordnung: B. bronchiseptica ist für den Menschen pathogen („krankheitserregend“), sie wird durch die Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466 der Risikogruppe 2 zugeordnet. Weiterhin ist bei der Einstufung vermerkt, dass sie pathogen für Mensch und Wirbeltiere ist, dass aber normalerweise keine Übertragung zwischen beiden Wirtsgruppen vorliegt, es sich damit nicht um einen Zoonoseerreger handelt.[34]
Veterinärmedizinische Bedeutung
Von größerer Bedeutung ist Bordetella bronchiseptica in der Veterinärmedizin, da sie bei vielen Säugetieren, sowohl Haustieren wie Wildtieren, als Krankheitserreger zu Infektionen des Respirationstraktes führt.
Pathogenität
Ähnlich wie bei einer Infektion mit B. parapertussis und B. pertussis beim Menschen, sind die zilientragenden Epithelzellen des Respirationstraktes der Angriffspunkt des Erregers. Dies wurde unter anderem an Zellkulturen mit aus Hunden isolierten Zellen erforscht. Nach Kontakt mit virulenten B. bronchiseptica (Phase I-Form) heften sich diese an die Zilien, deren Schlagfrequenz reduziert sich innerhalb von 5 Minuten deutlich, und innerhalb von 3 Stunden ist keine Bewegung des Flimmerepithels mehr zu erkennen (Ziliostase).[7] Als Folge der Ziliostase kann der gebildete Bronchialschleim nicht mehr aus dem Atemtrakt befördert werden.[5]
Die beim Menschen als Krankheitserreger bekanntere Bordetella pertussis verfügt über zahlreiche Virulenzfaktoren, wie das filamentöse Hämagglutinin (FHA) und das Pertussistoxin (PT), dabei handelt es sich um ein Protein, das als Exotoxin und Adhäsin wirkt.[1] Die meisten dieser Virulenzfaktoren finden sich auch bei B. bronchiseptica, wobei dies zum Teil noch Gegenstand der Forschung ist. Im Genom wurden Gene identifiziert, die für das Pertussistoxin codieren, allerdings werden diese nicht exprimiert, das Protein also nicht gebildet.[4] Auch das FHA wird von B. bronchiseptica gebildet. Es wirkt als Adhäsin und bindet direkt an die Glykosphingolipide in der Zellmembran der Zilien.[12]
Weiterhin finden sich das hitzelabile Toxin, die invasive Adenylatcyclase, das Tracheale Cytotoxin (TCT) und die als sogenanntes O-Antigen und Endotoxin wirkenden Lipopolysaccharide aus der äußeren Membran bei B. parapertussis, B. pertussis und B. bronchiseptica. Dem hitzelabilen Toxin wird eine hautnekrotisierende Wirkung zugeschrieben.[4][5] Verantwortlich für die Ziliostase sind die Wirkungen der Adenylatcyclase und das Tracheale Cytotoxin.[7] Bei B. bronchiseptica spielt ebenfalls das Pertactin als Adhäsin eine Rolle.[14] Außerdem wird angenommen, dass auch die Fimbrien und Proteine in der äußeren Membran (OMP) zur Bindung an die Wirtszelle beitragen.[5] Dies wurde durch die genetischen Untersuchungen bestätigt.[12] Bei gramnegativen, pathogenen Bakterien (z. B. Vibrio parahaemolyticus) findet man häufig ein Typ-III-Sekretionssystem (engl. Type III secretion system; als TTSS abgekürzt). Das TTSS ist ein wichtiger Faktor für die Pathogenität, denn mit seiner Hilfe werden bakterielle Toxine gezielt in die Zellen des Wirts eingebracht. Auch B. bronchiseptica verfügt über ein Typ-III-Sekretionssystem, dessen Aufbau und Funktionsweise aber noch nicht geklärt ist.[12]
Infektionsquellen
Der Respirationstrakt ist der Lebensraum von Bordetella bronchiseptica. Der Infektionsweg ist eine Tröpfcheninfektion, die Übertragung des Krankheitserregers erfolgt durch Tröpfchen, die erkrankte Tiere aushusten oder ausniesen. Da B. bronchiseptica eher in der Umwelt überleben kann als die verwandten Arten, wird auch eine Schmierinfektion nicht ausgeschlossen.[5]
Infektionskrankheiten
Hauptartikel: Zwingerhusten, Katzenschnupfen, Rhinitis atrophicans und ansteckender Kaninchenschnupfen
Verschiedene Säugetiere können an einer Infektion durch Bordetella bronchiseptica erkranken, betroffen ist meist der Atemtrakt (Respirationstrakt) oder Teile davon. Die Krankheit äußert sich als Schnupfen, akute Bronchitis bis hin zur Lungenentzündung und wird in der Veterinärmedizin auch als Bordetellose (englisch bordetellosis) bezeichnet, z. B. als Feline Bordetellose. Der Krankheitsverlauf kann sehr variieren, von leichten Erkrankungen der Atemwege bis hin zur Lungenentzündung mit Todesfolge,[35] wobei vor allem Jungtiere gefährdet sind.[36] Dabei ist zu beachten, dass die genannten Infektionskrankheiten alle komplex sind und im Normalfall von mehr als einem Erreger verursacht werden. Hier folgt ein Überblick über betroffene Tiergruppen und die durch B. bronchiseptica verursachten Infektionskrankheiten:
- Infektionen bei Hunden: Die Erkrankung äußert sich als Tracheobronchitis – neben den Bronchien ist auch die Luftröhre (Trachea) betroffen – und wird als Zwingerhusten bezeichnet.[5] Neben B. bronchiseptica kann sie auch durch verschiedene Viren verursacht werden, insbesondere das Canine Parainfluenzavirus Typ 2.[37]
- Infektionen bei Katzen: Am Katzenschnupfen, eine feline infektiöse Erkrankung des oberen Respirationstraktes, sind Viren beteiligt, aber auch Bakterien, wie Chlamydophila felis und B. bronchiseptica. Letztere wurde aus Katzen mit respiratorischen Erkrankungen in Zuchtstationen isoliert, die Katzen waren frei von den viralen Erregern FeHV-1 und FCV.[38] Die Infektion lässt sich durch Einatmen eines mit B. bronchiseptica versetzten Aerosols provozieren. Bei Katzenwelpen führt das zu den Symptomen einer respiratorischen Erkrankung mit Nasenausfluss, Niesen, Husten und Rasselgeräuschen bei der Auskultation.[39]
- Infektionen bei Schweinen: Ursprünglich wurde vermutet, dass B. bronchiseptica Rhinitis atrophicans („Schnüffelkrankheit“) verursacht, eine Krankheit bei Hausschweinen, die durch eine Zerstörung (Atrophie) der Nasenmuscheln gekennzeichnet ist. Durch spätere Untersuchungen wurde jedoch Pasteurella multocida als Erreger identifiziert, wobei B. bronchiseptica eine Rolle als Wegbereiter zukommt.[5] Allerdings konnte im Tierversuch gezeigt werden, dass es auch bei einer isolierten Infektion mit B. bronchiseptica nach 28 Tagen zu einer Atrophie der Knochen in den Nasenmuscheln kommt.[40] Besonders für Ferkel im Alter bis zu vier Wochen ist eine Bordetellose problematisch. Sie stecken sich zumeist bei der latent infizierten Muttersau an und entwickeln eine Lungenentzündung. Diese Erkrankung wird, unabhängig vom tatsächlichen Erreger, zum MIRD-Komplex (englisch Mycoplasma-induces respiratory Disease, „Mycoplasma-induzierte Atemwegserkrankung“) gezählt. Die Infektion wird durch eine Intensivtierhaltung begünstigt. Rhinitis atrophicans gehört zu den meldepflichtigen Tierkrankheiten.[36]
- Infektionen bei Kaninchen: Auch hier wurde zunächst B. bronchiseptica als Erreger für den ansteckenden Kaninchenschnupfen angenommen, spätere Ergebnisse weisen auf eine Infektion durch Pasteurella multocida hin, wobei abermals B. bronchiseptica als Wegbereiter für die Infektion angesehen wird. Symptome sind neben Schnupfen eine Mittelohrentzündung und Tracheobronchitis.[5]
- Infektionen bei Meerschweinchen und Ratten: Hier sind die Symptome ähnlich wie bei den Kaninchen, neben B. bronchiseptica ist P. multocida ein typischer Krankheitserreger (siehe Atemwegserkrankungen beim Meerschweinchen).[5] Auch Aborte und Totgeburten können eine Folge der Infektion sein. In Versuchstierhaltungen greift eine Infektion mit B. bronchiseptica schnell um sich und führt zu einer hohen Anzahl erkrankter Tiere, von denen viele sterben.[36]
Therapie
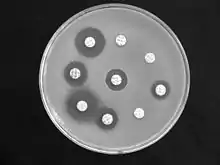
Durch mikrobiologische Verfahren, beispielsweise ein Antibiogramm oder die Bestimmung der Minimalen Hemm-Konzentration lässt sich in vitro feststellen, gegen welche Antibiotika Bordetella bronchiseptica resistent ist und auf welche sie sensitiv reagiert, diese können dann gegebenenfalls bei einer Therapie verwendet werden. Untersuchungen von 1977 an 50 Bakterienstämmen zeigten, dass sie alle empfindlich für Polymyxin B, Chloramphenicol und Tetracycline sind. Die meisten Stämme reagieren weiterhin sensitiv auf die Aminoglykosid-Antibiotika Gentamicin und Kanamycin, die Mehrheit (zwischen 70 und 66 %) auf Nalidixinsäure (aus der Gruppe der Chinolon-Antibiotika), Cefalotin (aus der Gruppe der Cephalosporine), Ampicillin (ein halbsynthetisches Aminopenicillin) und eine Kombination von Sulfonamiden mit Trimethoprim. Alle Stämme sind hingegen resistent gegen Streptomycin und Penicillin G.[2]
1991 wurden die Ergebnisse mehrerer Forschergruppen zu diesem Thema ausgewertet, danach liegt auch eine Sensitivität von B. bronchiseptica für die Aminoglycosid-Antibiotika Amikacin und Tobramycin, sowie die halbsynthetischen Penicilline Azlocillin, Mezlocillin, Piperacillin und Ticarcillin vor. Ebenfalls wurde eine Sensitivität für Cephalosporine wie Cefoperazon und Ceftazidim festgestellt. Als wenig wirksam wurde Penicillin G, aber auch Ampicillin beurteilt, als gar nicht wirksam Clindamycin und Erythromycin.[5]
Der Einsatz von Antibiotika erfolgt in der Veterinärmedizin häufig, ohne dass der Krankheitserreger identifiziert wurde. Bei Katzen wird bei einer Bordetellose eine Behandlung mit Tetracyclinen, insbesondere Doxycyclin empfohlen.[35] Bei Schweinen wird der Einsatz von Aminoglykosiden, Fluorchinolonen, Makroliden (z. B. Tylosin), Tetracyclinen oder der Kombination Trimethoprim und Sulfamethoxazol (auch als Cotrimoxazol bekannt) empfohlen. Allerdings ist ein Antibiogramm hilfreich, um die Wirksamkeit des Antibiotikums auf das Bakterium vorab zu ermitteln.[36] Im Allgemeinen werden zur Behandlung von Infekten des oberen Respirationstraktes bei Haustieren Tetracycline, Ampicillin und Cotrimoxazol eingesetzt. Dies ist bei einer Infektion mit B. bronchiseptica kritisch zu hinterfragen, da eine Resistenz gegen Trimethoprim und Ampicillin bei zahlreichen Bakterienstämmen auftritt.[15]
Vorbeugung
Als vorbeugende Maßnahme kann eine Impfung erfolgen, bei Katzen wurde beispielsweise bereits 1993 ein Impfstoff getestet, der auf den Antigenen der Fimbrien von B. bronchiseptica basiert.[39] Bei Katzen wird eine Impfung empfohlen, falls mehrere Tiere auf engem Raum gehalten werden, z. B. in einem Tierheim oder einer Katzenpension.[35] Diese Empfehlung findet sich ebenfalls in der Leitlinie zur Impfung von Kleintieren, die von der Ständigen Impfkommission Vet. (Vet. als Abkürzung für Veterinärmedizin) herausgegeben wird. Ein weiterer, dort genannter Grund für eine Impfung ist der Kontakt mit anderen Tierarten, die ebenfalls von B. bronchiseptica infiziert werden können, wie dies bei Hunden zutrifft.[37] Seit 2002 ist in Deutschland ein Impfstoff für Katzen zugelassen.[41] Das monovalente Präparat mit der Bezeichnung Nobivac Bb ist ein Lebendimpfstoff, der den Bakterienstamm B. bronchiseptica B-C2 enthält und intranasal, also durch die Nase verabreicht wird.[42] Untersuchungen in den USA haben gezeigt, dass eine intranasale Applikation eines Lebendimpfstoffes, der modifizierte FeHV-1 und FCV (Viren, die am Katzenschnupfen-Komplex beteiligt sind) enthält, den Tieren auch eine Immunität gegenüber B. bronchiseptica verleiht, obwohl sie nicht im Impfstoff enthalten ist. Die Katzen zeigen verminderte Krankheitssymptome oder die Krankheit bricht nicht aus. Erklärt wird dies mit einer nicht-spezifischen Immunität, die durch die intranasale Applikation angeregt wird.[43]
Für Hunde wird eine Impfung ebenfalls nur unter bestimmten Umständen empfohlen. Diese liegen vor, wenn sie viel Kontakt zu Artgenossen haben, beispielsweise in Welpengruppen, und ebenso beim Aufenthalt in Tierpensionen oder Tierheimen. Auch bei Kontakt mit Katzen oder anderen Tierarten, die von B. bronchiseptica infiziert werden können, wird die Impfung empfohlen.[37] Für Hunde steht in Deutschland ein monovalenter Lebendimpfstoff zur Verfügung, außerdem gibt es ein Kombinationspräparat, das gleichzeitig gegen das Canine Parainfluenzavirus (CPiV) schützt, das ebenfalls am Zwingerhusten-Komplex beteiligt ist.[44][37] Beide Impfstoffe werden intranasal verabreicht. Bei dem monovalenten Präparat Bronchi-Shield handelt es sich um einen attenuierten Lebendimpfstoff, der den Bakterienstamm B. bronchiseptica 92B enthält,[45] er ist seit 2011 zugelassen. Bereits seit 2000 ist das Kombinationspräparat Nobivac BbPi zugelassen.[44] Auch hier handelt es sich um einen Lebendimpfstoff, enthalten ist der Bakterienstamm B. bronchiseptica B-C2 und das Canine Parainfluenzavirus Typ 2, Stamm CGF.[46]
Für Kaninchen wird eine Impfung in Kaninchenzuchten empfohlen, um eine Verminderung des Infektionsdrucks im Bestand zu erreichen. Hierfür ist in Deutschland ein Kombinationspräparat erhältlich, das als Totimpfstoff inaktivierte Zellen von B. bronchiseptica und Pasteurella multocida enthält. Er wird subkutan verabreicht, also in die Unterhaut injiziert.[37] Das Präparat mit der Bezeichnung CUNIVAK PAST ist seit 1997 als Impfstoff gegen Kaninchenschnupfen zugelassen.[47]
Auch für Schweine stehen in Deutschland mehrere Impfstoffe gegen Rhinitis atrophicans zur Verfügung. Das Präparat Porcilis AR-T DF ist seit 2000 zugelassen[48] und enthält ein nicht mehr giftig wirkendes Derivat des P. multocida Toxins als rekombinantes Protein und inaktivierte Zellen von B. bronchiseptica. Angewendet wird es bei Säuen, um ihre Ferkel vor der „Schnüffelkrankheit“ zu schützen. Es wird intramuskulär injiziert, d. h. in einen Muskel gespritzt.[49] Ebenfalls ein Kombinationspräparat ist das seit 2010 zugelassene[48] Rhiniseng, auch hier ist ein nicht mehr giftig wirkendes, rekombinantes Protein von P. multocida und inaktivierte Zellen von B. bronchiseptica enthalten.[50] Auch bei dem seit 1994 zugelassenen[48] Präparat Respiporc ART+EP handelt es sich um einen Kombinationsimpfstoff, neben dem Derivat des P. multocida Toxins und inaktivierten Zellen von B. bronchiseptica sind auch noch inaktivierte Zellen von P. multocida enthalten.[51]
Quellen
Literatur
- Horst Finger, Carl Heinz Wirsing von König: Bordetella (Chapter 31). In: Samuel Baron (Hrsg.): Medical Microbiology. 4. Auflage. University of Texas Medical Branch at Galveston, Galveston (TX), USA 1996, ISBN 0-9631172-1-1 (NCBI Bookshelf).
- B. F. Woolfrey, J. A. Moody: Human infections associated with Bordetella bronchiseptica. In: Clinical Microbiology Reviews. Band 4, Nr. 3, Juli 1991, S. 243–255, doi:10.1128/CMR.4.3.243 (zurzeit nicht erreichbar). PMID 1889042. PMC 358197 (freier Volltext). (Review).
- Karin Duchow, Katrin Hartmann u. a.: Leitlinie zur Impfung von Kleintieren. Hrsg.: Ständige Impfkommission Vet. im Bundesverband Praktizierender Tierärzte e. V. 2. Auflage. 2013, ISBN 978-3-933711-14-4 (PDF, 504 kB [abgerufen am 10. März 2014]).
Einzelnachweise
- Herbert Hof, Rüdiger Dörries: Duale Reihe: Medizinische Mikrobiologie. 3. Auflage. Thieme Verlag, Stuttgart 2005, ISBN 978-3-13-125313-2, S. 408–411.
- D. A. Bemis, H. A. Greisen, M. J. Appel: Bacteriological variation among Bordetella bronchiseptica isolates from dogs and other species. In: Journal of clinical microbiology. Band 5, Nummer 4, April 1977, S. 471–480. PMID 858784. PMC 274626 (freier Volltext).
- Mardjan Arvand: Bordetellen. In: Helmut Hahn, Stefan H. E. Kaufmann, Thomas F. Schulz, Sebastian Suerbaum (Hrsg.): Medizinische Mikrobiologie und Infektiologie. 6. Auflage. Springer Verlag, Heidelberg 2009, ISBN 978-3-540-46359-7, S. 302–307.
- Horst Finger, Carl Heinz Wirsing von König: Bordetella (Chapter 31). In: Samuel Baron (Hrsg.): Medical Microbiology. 4. Auflage. University of Texas Medical Branch at Galveston, Galveston (TX), USA 1996, ISBN 0-9631172-1-1.
- B. F. Woolfrey, J. A. Moody: Human infections associated with Bordetella bronchiseptica. In: Clinical Microbiology Reviews. Band 4, Nr. 3, Juli 1991, S. 243–255, doi:10.1128/CMR.4.3.243 (zurzeit nicht erreichbar). PMID 1889042. PMC 358197 (freier Volltext). (Review).
- R. Johnson, P. H. A. Sneath: Taxonomy of Bordetella and Related Organisms of the Families Achromobacteraceae, Brucellaceae, and Neisseriaceae. In: International Journal of Systematic Bacteriology. Band 23, Nr. 4, Oktober 1973, S. 381–404. doi:10.1099/00207713-23-4-381.
- D. A. Bemis, J. R. Kennedy: An improved system for studying the effect of Bordetella bronchiseptica on the ciliary activity of canine tracheal epithelial cells. In: The Journal of infectious diseases. Band 144, Nr. 4, Oktober 1981, S. 349–357. PMID 7288215.
- F. von Wintzingerode, A. Schattke u. a.: Bordetella petrii sp. nov., isolated from an anaerobic bioreactor, and emended description of the genus Bordetella. In: International journal of systematic and evolutionary microbiology. Band 51, Nr. 4, Juli 2001, S. 1257–1265, ISSN 1466-5026. doi:10.1099/00207713-51-4-1257. PMID 11491321.
- Bordetella bronchiseptica RB50. In: Webseite Genomes Online Database (GOLD). Abgerufen am 28. Februar 2014.
- K. Kersters, K.-H. Hinz u. a.: Bordetella avium sp. nov., Isolated from the Respiratory Tracts of Turkeys and Other Birds. In: International Journal of Systematic Bacteriology. Band 34, Nr. 1, Januar 1984, S. 56–70. doi:10.1099/00207713-34-1-56.
- L. E. Friedman, B. N. de Rossi u. a.: Phenotype evaluation of Bordetella bronchiseptica cultures by urease activity and Congo red affinity. In: Letters in applied microbiology. Band 33, Nr. 4, Oktober 2001, S. 285–290, ISSN 0266-8254. PMID 11559402.
- J. Parkhill, M. Sebaihia u. a.: Comparative analysis of the genome sequences of Bordetella pertussis, Bordetella parapertussis and Bordetella bronchiseptica. In: Nature genetics. Band 35, Nr. 1, September 2003, S. 32–40, ISSN 1061-4036. doi:10.1038/ng1227. PMID 12910271.
- Bordetella bronchiseptica. In: Webseite Genome des National Center for Biotechnology Information (NCBI). Abgerufen am 1. März 2014.
- J. Park, Y. Zhang u. a.: Comparative genomics of the classical Bordetella subspecies: the evolution and exchange of virulence-associated diversity amongst closely related pathogens. In: BMC genomics. Band 13, Oktober 2012, S. 545, ISSN 1471-2164. doi:10.1186/1471-2164-13-545. PMID 23051057. PMC 3533505 (freier Volltext).
- A. J. Speakman, S. H. Binns u. a.: Characterization of antibiotic resistance plasmids from Bordetella bronchiseptica. In: The Journal of antimicrobial chemotherapy. Band 40, Nr. 6, Dezember 1997, S. 811–816, ISSN 0305-7453. PMID 9462432.
- D. J. McMillan, M. Mau, M. J. Walker: Characterisation of the urease gene cluster in Bordetella bronchiseptica. In: Gene. Band 208, Nr. 2, Februar 1998, S. 243–251, ISSN 0378-1119. PMID 9524276.
- D. J. McMillan, E. Medina u. a.: Expression of urease does not affect the ability of Bordetella bronchiseptica to colonise and persist in the murine respiratory tract. In: FEMS microbiology letters. Band 178, Nr. 1, September 1999, S. 7–11, ISSN 0378-1097. PMID 10483716.
- D. M. Monack, S. Falkow: Cloning of Bordetella bronchiseptica urease genes and analysis of colonization by a urease-negative mutant strain in a guinea-pig model. In: Molecular microbiology. Band 10, Nr. 3, November 1993, S. 545–553. PMID 7968532.
- A. Tizolova, D. Brun u. a.: Development of real-time PCR assay for differential detection of Bordetella bronchiseptica and Bordetella parapertussis. In: Diagnostic microbiology and infectious disease. [elektronische Veröffentlichung vor dem Druck] Januar 2014, ISSN 1879-0070. doi:10.1016/j.diagmicrobio.2013.12.020. PMID 24525142.
- Newell S. Ferry: Etiology of Canine Distemper. In: Journal of Infectious Diseases. Band 8, Nr. 4, 1911, S. 399–420, hier S. 399–402, Internet Archive, abgerufen am 14. März 2014.
- Newell S. Ferry (1911): Etiology of Canine Distemper. S. 399–420, hier S. 402–405.
- Newell S. Ferry (1911): Etiology of Canine Distemper. S. 399–420, hier S. 405–415.
- Newell S. Ferry (1911): Etiology of Canine Distemper. S. 399–420, hier S. 418–419.
- Antje Grünberg: Die Staupe des Hundes - ein Beitrag zur Geschichte der Haustierkrankheiten, Dissertation zur Erlangung des Grades eines Doktors der Veterinärmedizin an der Freien Universität Berlin. In: Klinik für Klauentiere des Fachbereiches Veterinärmedizin der FU Berlin (Hrsg.): Journal Nr. 2119. 1997, S. 49–50 (Dissertationsserver FU Berlin, PDF, 284 kB [abgerufen am 15. März 2014]).
- Newell S. Ferry: Bacillus bronchisepticus (bronchicanis): the cause of distemper in dogs and a similar disease in other animals. In: British Veterinary Journal. Band 68, 1912, S. 376–391.
- Jean Euzéby, Aidan C. Parte: Genus Bordetella. In: List of Prokaryotic names with Standing in Nomenclature Systematik der Bakterien (LPSN). Abgerufen am 28. Februar 2014.
- Jean Euzéby, Aidan C. Parte: Phylum „Proteobacteria“. In: List of Prokaryotic names with Standing in Nomenclature Systematik der Bakterien (LPSN). Abgerufen am 28. Februar 2014.
- M. Moreno-López: El genero Bordetella [Die Gattung Bordetella]. In: Microbiologia Española. Band 5, 1952, S. 177–181.
- Taxonomy Browser Bordetella bronchiseptica. In: Webseite des National Center for Biotechnology Information (NCBI). Abgerufen am 28. Februar 2014.
- Strain Passport Bordetella bronchiseptica. In: Website StrainInfo (gesammelte Informationen über Bakterienstämme in über 60 Biologischen Forschungseinrichtungen (biological resource centers, BRCs)). Abgerufen am 28. Februar 2014.
- M. S. Dworkin, P. S. Sullivan u. a.: Bordetella bronchiseptica infection in human immunodeficiency virus-infected patients. In: Clinical Infectious Diseases. Band 28, Nr. 5, Mai 1999, S. 1095–1099, ISSN 1058-4838. doi:10.1086/514761. PMID 10452641.
- J. J. Gisel, L. M. Brumble, M. M. Johnson: Bordetella bronchiseptica pneumonia in a kidney-pancreas transplant patient after exposure to recently vaccinated dogs. In: Transplant infectious disease : an official journal of the Transplantation Society. Band 12, Nr. 1, Februar 2010, S. 73–76, ISSN 1399-3062. doi:10.1111/j.1399-3062.2009.00451.x. PMID 19874567.
- C. Brady, P. Ackerman u. a.: Bordetella bronchiseptica in a pediatric Cystic Fibrosis center. In: Journal of cystic fibrosis : official journal of the European Cystic Fibrosis Society. Band 13, Nr. 1, Januar 2014, S. 43–48, ISSN 1873-5010. doi:10.1016/j.jcf.2013.08.002. PMID 24011471.
- TRBA (Technische Regeln für Biologische Arbeitsstoffe) 466: Einstufung von Prokaryonten (Bacteria und Archaea) in Risikogruppen. In: Website der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. April 2012, S. 42, abgerufen am 7. Januar 2014.
- H. Egberink, D. Addie u. a.: Bordetella bronchiseptica infection in cats. ABCD guidelines on prevention and management. In: Journal of feline medicine and surgery. Band 11, Nr. 7, Juli 2009, S. 610–614, ISSN 1098-612X. doi:10.1016/j.jfms.2009.05.010. PMID 19481041. (Review).
- Hans-Joachim Selbitz, Uwe Truyen, Peter Valentin-Weigand: Tiermedizinische Mikrobiologie, Infektions- und Seuchenlehre. 8. Auflage. Enke Verlag, Stuttgart 2010, ISBN 978-3-8304-1080-5, S. 169–171.
- Karin Duchow, Katrin Hartmann u. a.: Leitlinie zur Impfung von Kleintieren. Hrsg.: Ständige Impfkommission Vet. im Bundesverband Praktizierender Tierärzte e. V. 2. Auflage. 2013, ISBN 978-3-933711-14-4 (Download beim Tierärzteverband).
- H. Elliott: Bordetella bronchiseptica in a closed cat colony. In: The Veterinary record. Band 129, Nr. 21, November 1991, S. 474–475. PMID 1763473.
- A. A. Jacobs, W. S. Chalmers u. a.: Feline bordetellosis: challenge and vaccine studies. In: The Veterinary record. Band 133, Nr. 11, September 1993, S. 260–263, ISSN 0042-4900. PMID 8236648.
- L. A. Collings, J. M. Rutter: Virulence of Bordetella bronchiseptica in the porcine respiratory tract. In: Journal of medical microbiology. Band 19, Nr. 2, April 1985, S. 247–255. PMID 2858594.
- Katzenimpfstoffe. In: Webseite Paul-Ehrlich-Institut. 13. Februar 2014, abgerufen am 10. März 2014.
- Nobivac Bb – live Bordetella bronchiseptica bacteria strain B-C2. In: Webseite Europäische Arzneimittel-Agentur. 3. Oktober 2012, abgerufen am 10. März 2014.
- A. Bradley, J. Kinyon u. a.: Efficacy of intranasal administration of a modified live feline herpesvirus 1 and feline calicivirus vaccine against disease caused by Bordetella bronchiseptica after experimental challenge. In: Journal of veterinary internal medicine / American College of Veterinary Internal Medicine. Band 26, Nr. 5, Sep./Okt. 2012, S. 1121–1125, ISSN 1939-1676. doi:10.1111/j.1939-1676.2012.00982.x. PMID 22860699.
- Hundeimpfstoffe. In: Webseite Paul-Ehrlich-Institut. 13. Februar 2014, abgerufen am 10. März 2014.
- Bronchi-Shield. In: Webseite PharmNet.Bund. Abgerufen am 11. März 2014.
- Nobivac BbPi. In: Webseite PharmNet.Bund. Abgerufen am 11. März 2014.
- Kaninchenimpfstoffe. In: Webseite Paul-Ehrlich-Institut. 13. Februar 2014, abgerufen am 11. März 2014.
- Schweineimpfstoffe. In: Webseite Paul-Ehrlich-Institut. 8. Januar 2014, abgerufen am 30. März 2014.
- Porcilis AR-T DF – protein dO (non-toxic deletion derivative of Pasteurella multocida dermonecrotic toxin) / inactivated Bordetella bronchiseptica cells. In: Webseite Europäische Arzneimittel-Agentur. 20. Dezember 2011, abgerufen am 11. März 2014.
- Rhiniseng – inactivated Bordetella bronchiseptica, strain 833CER / recombinant type-D Pasteurella-multocida toxin (PMTr). In: Webseite Europäische Arzneimittel-Agentur. 28. September 2010, abgerufen am 30. März 2014.
- Respiporc ART+EP. In: Webseite PharmNet.Bund. 1. Januar 2008, abgerufen am 30. März 2014.
Weblinks
- Feline Bordetellose – Die Bordetella bronchiseptica Infektion der Katze. In: Vetstream clinical reference. Abgerufen am 2. März 2014.