Tozinameran
BNT162b2 (empfohlener internationaler Freiname (INN): Tozinameran;[1] in den USA bekannt als Pfizer-BioNTech COVID-19 Vaccine;[2] Handelsname in den EWR-Staaten,[3] der Schweiz und den USA:[2] Comirnaty) ist ein modRNA-basierter SARS-CoV-2-Impfstoff. Er wurde im Jahr 2020 vom deutschen Biotechnologie-Unternehmen BioNTech,[4] basierend auf deren Vorentwicklungen aus der Krebsforschung, in Kooperation mit dem US-amerikanischen Pharmaunternehmen Pfizer und dem chinesischen Pharmakonzern Fosun entwickelt.[5][6][7][8] Der Markenname Comirnaty wurde von einer Namensagentur im Auftrag der Firmen Biontech und Pfizer entwickelt.[9]
| Nukleinsäure | |
|---|---|
| Tozinameran: schematische Darstellung (einzelne Elemente nicht genau maßstabsgetreu dargestellt im Vergleich zu den jeweiligen Sequenzlängen)
Cap = 5′-Kappe; 5′-UTR = 5′-untranslatierte Region; Sig = (S)-Glycoprotein-Signalsequenz; S Protein_mut = codierende Sequenz für das Spike-Glykoprotein in voller Länge, mit zwei Mutationen (K986P, V987P); 3′-UTR = 3′-untranslatierte Region; Poly(A) = Poly(A)-Schwanz | |
| Allgemeines | |
| Freiname | Tozinameran |
| Andere Namen |
|
| Identifikatoren | |
| CAS-Nummer |
2417899-77-3 |
| Wirkstoffdaten | |
| DrugBank | |
| ATC-Code |
J07BX |
| Wirkstoffgruppe | |
| Wirkmechanismus |
Aktive Immunisierung |
Der Impfstoff gehört zu den RNA-Impfstoffen und wird pharmazeutisch mit Lipid-Nanopartikeln[10] (siehe dazu auch Liposomen) formuliert und weist nach aktueller Studienlage (Dezember 2020) ein hohes Maß an Wirksamkeit und Sicherheit auf.[11]
Tozinameran ist sowohl der erste von einer stringenten Regulierungsbehörde im Sinne der Weltgesundheitsorganisation (WHO) für den Notfalleinsatz freigegebene COVID-19-Impfstoff[12][13] als auch der erste für die Vermarktung zugelassene.[14]
Er ist in zahlreichen Ländern zumindest eingeschränkt zugelassen: In der EU gilt eine bedingte Zulassung für Personen ab 5 Jahren.
Seit 31. Dezember 2020 ist er der erste von der WHO gelistete COVID-19-Impfstoff.[15][16] Darüber hinaus ist Tozinameran der weltweit erste RNA-Impfstoff, der für Menschen zugelassen wurde. Comirnaty wurde im Oktober 2021 mit dem Galenus-von-Pergamon-Preis in der Kategorie „Primary Care“ ausgezeichnet.[17]
Eigenschaften
Der Wirkstoff ist eine Messenger-RNA (mRNA, Boten-RNA) und codiert für eine codonoptimierte, stabilisierte Prä-Fusion-Konformationsvariante des Spike-Glykoproteins[18] auf der Oberfläche des neuartigen Coronavirus SARS-CoV-2. Als Referenz-Genom wurde dazu wie bei mRNA-1273 das Isolat Wuhan-Hu-1 (Pango-Entwicklungslinie B)[19] von SARS-CoV-2 verwendet.[20] Durch den Austausch der Codons zweier Aminosäuren im Vergleich zu dem im Virus selbst vorkommenden Protein (K986P, V987P) wird BNT162b2 in der Konformation stabilisiert, die es vor der Fusion mit der Zellmembran hat. Dies soll die Immunogenität der Impfstoffe verbessern.[21] Flankiert wird die codierende Sequenz von 5′- und 3′-UTR-untranslatierten Regionen. Am 5′-Ende trägt die mRNA eine Kappe, am 3′-Ende einen Poly(A)-Schwanz. Die 5’-UTR stammt vom α-Globin-Gen, die 3’UTR vom Amino-Terminal-Enhancer-of-Split-Gen (AES) und von der mitochondrial kodierten 12S-Ribosomen-RNA.
Durch die Inkorporation von N1-Methylpseudouridin anstelle des natürlicherweise enthaltenen Nukleosids Uridin werden die Erkennung des Moleküls durch Toll-Like-Rezeptoren (TLRs) und ein Immunangriff unterdrückt. Ferner soll sie zur Stabilität des Moleküls beitragen.[22][23]
Inhaltsstoffe und pharmazeutische Formulierung
Die Inhaltsstoffe des Impfstoffs sind in der durch die EMA genehmigten Packungsbeilage aufgeführt.[24]
Der Impfstoff ist eine wässrige kolloidale Injektionslösung, deren pharmazeutischer Wirkstoff, die BNT162b2-RNA, eine hochgereinigte einzelsträngige, 5'-verkappte Nukleosid-modifizierte Messenger RNA (mod-mRNA) in einer Konzentration von 30 µg pro Impfdosis enthält;[25] diese modifizierte RNA kodiert ausschließlich das Spike-Protein des Coronavirus SARS-CoV-2.[24] Daneben enthält die Injektionslösung des Impfstoffs noch Lipide, die das Einbringen des Wirkstoffs in die Wirtszellen (Transfektion) ermöglichen. Als Hilfsstoffe sind im Zulassungsdokument sowie im SmPC-Dokument des Impfstoffs aufgeführt:[25]
- ALC-0315 = [(4-Hydroxybutyl)azandiyl]bis (Hexan-6,1-diyl)bis(2-hexyldecanoat)
- ALC-0159 = 2-[(Polyethylenglykol)-2000]-N,N-ditetradecylacetamid
- 2-Distearoyl-sn-glycero-3 phosphocholin
- Cholesterol
- Kaliumchlorid
- Kaliumdihydrogenphosphat
- Natriumchlorid
- Dinatriumhydrogenphosphat-Dihydrat
- Saccharose
- Wasser für Injektionen
Ein Adjuvans ist im Impfstoff nicht enthalten. Die Lösung enthält keine Konservierungsstoffe.[26][27] Der Hauptbestandteil der enthaltenen Lipide ist das ionische Lipid ALC-0315 (430 µg pro Dosis),[28] das die mRNA so umhüllt, dass sich Teilchen mit einem Durchmesser von ca. 100 Nanometer bilden. Dies wird dadurch bewirkt, dass unter physiologischen Bedingungen die mRNA eine negative elektrische Ladung aufweist, während ALC-0315 positiv geladen ist. Die übrigen Lipide, darunter insbesondere das nicht-ionische Lipid ALC-0159 (50 µg pro Dosis),[28] dienen zu Stabilisierung dieser Nanoteilchen und wirken gegen deren Verklumpung.[26]
Der Impfstoff wird in Ampullen als tiefgekühltes Konzentrat ausgeliefert, das vor der Anwendung aufgetaut und vor Ort mit physiologischer Kochsalzlösung verdünnt wird (Rekonstitution),[27] wofür es eine Verfahrensanleitung gibt.[29] Im November 2021[30] erteilte die EU-Kommission die Zulassung für eine gebrauchsfertige Präsentation des Impfstoffs, der vor der Verwendung nicht mehr verdünnt werden muss und ab Anfang 2022 vertrieben werden soll.[31]
Die Lipid-Nanopartikel werden benötigt, weil nackte mRNA physikalisch und thermisch instabil ist.[32] Um ohne vorherigen Abbau an den Wirkort zu gelangen und die Wirkung entfalten zu können, wird Tozinameran – wie andere mRNA-Wirkstoffe auch – in Lipid-Nanopartikel („Lipidkügelchen“) eingebettet („verpackt“). Für die Formulierung der Suspensionspartikel werden die vier Lipide ALC-0315, ALC-0159, DSPC und Cholesterin zur Einbettung des Wirkstoffs verwendet.[24][33] Es entsteht ein wässriges Konzentrat, das vor der Verabreichung als intramuskuläre Injektion mit physiologischer Kochsalzlösung verdünnt werden muss. Weitere Bestandteile sind physiologische (d. h. natürlich im Organismus vorkommende) Salze wie Kaliumchlorid, Natriumchlorid und Phosphate zur Einstellung eines geeigneten pH-Wertes sowie Saccharose zum Schutz der Partikel beim Gefrierprozess.
Wirkung
Der Verabreichung des Impfstoffs löst im Impfling sowohl die Bildung neutralisierender Antikörper als auch den Aufbau zellulärer Immunantworten gegen das Spike-Antigen (S-Protein) aus, was beides zum Schutz gegen COVID-19 beiträgt.
In einer nicht randomisierten offenen Phase-1/2-Studie wurden Antikörper- und T-Zell-Antworten bei gesunden Erwachsenen im Alter zwischen 19 und 55 Jahren nach einer BNT162b2-Prime/Boost-Impfung mit einer Dosis von 1 bis 30 µg festgestellt. BNT162b2 löste starke Antikörperreaktionen aus, wobei die S-bindenden IgG-Konzentrationen über denen in einem COVID-19-Panel für humane Rekonvaleszenzproben (englisch human convalescent sample, HCS) lagen.
Sieben Tage nach dem Boost entsprachen im SARS-CoV-2-Serum 50 % neutralisierende mittlere Titer 0,3-fach (1 µg) bis 3,3-fach (30 µg) derjenigen des HCS-Panels. Die durch BNT162b2 ausgelösten Seren neutralisierten Pseudoviren mit verschiedenen SARS-CoV-2-S-Varianten. Gleichzeitig hatten sich bei den meisten Teilnehmern S-spezifische CD8-positive- und T-Helfer-Typ-1 (TH1-Lymphozyten) CD4-positive T-Zellen vermehrt, wobei eine hohe Fraktion Interferon-γ (IFNγ) produzierte. Unter Verwendung von Peptid-MHC-Multimeren (englisch major histocompatibility complex) wurden die Epitope identifiziert, die von mehreren BNT162b2-induzierten CD8-positiven T-Zellen erkannt wurden, wenn sie auf häufigen MHC-Allelen präsentiert wurden.
Es wurde gezeigt, dass CD8-positive T-Zellen vom früh differenzierten Effektor-Memory-Phänotyp sind, wobei einzelne Spezifitäten 0,01 % bis 3 % der zirkulierenden CD8-positiven T-Zellen erreichen. Demnach ruft eine Impfung mit BNT162b2 in gut verträglichen Dosen eine kombinierte adaptive humorale und zelluläre Immunantwort hervor.
Haltbarkeit des Impfstoffs
Haltbarkeit des Konzentrats
.jpg.webp)
Das Impfstoffkonzentrat ist physikalisch und thermisch labil.[34] Bei Lagerung in Ultratiefkühlschränken bei einer Temperatur von −80 °C bis −60 °C besteht eine Stabilität von bis zu neun Monaten.[35]
Der Hersteller gab Mitte Februar 2021 bekannt, dass die Stabilität des Impfstoffs auch bei Temperaturen zwischen −25 °C und −15 °C über zwei Wochen erhalten bleibt. Die höheren Temperaturen werden von gängigen pharmazeutischen Gefrier- und Kühlschränken aufrechterhalten und bieten somit mehr Flexibilität bei der Verteilung.[36] Am 25. Februar 2021 änderte die FDA ihre diesbezüglichen Vorschriften für die Lagerung und den Transport des gefrorenen Impfstoffpräparats.[37] Die EMA folgte am 26. März[38][39] und die Swissmedic für die Schweiz am 30. März 2021.[40] Laut Angaben von Biontech laufen weitere Maßnahmen zur Optimierung der Impfstoffformulierung.[39]
Nach dem Auftauen kann das unverdünnte Konzentrat im Kühlschrank bis zu einem Monat bei 2 bis 8 °C aufbewahrt werden sowie bis zu zwei Stunden bis 30 °C. Sowohl das unverdünnte Konzentrat als auch die verdünnte gebrauchsfertige Injektionslösung sollen nicht geschüttelt werden.[24] Bis Mitte Mai 2021 wurde die Haltbarkeitsdauer ungeöffneter Durchstechflaschen im Kühlschrank noch mit fünf Tagen angegeben.[41]
Haltbarkeit nach Verdünnung
Die Stabilität des Impfstoffs nach der Verdünnung ist bei 2 bis 30 °C für sechs Stunden gewährleistet. In dieser Zeit ist der Impfstoff zu verimpfen, danach sind Reste unbrauchbar.[24] Aufgrund neuer, Mitte Januar 2021 bekannt gewordener Stabilitätsdaten sei nunmehr auch ein vorsichtiger Transport bei 2 bis 30 °C möglich. Dafür sollten spezielle Kühlboxen verwendet werden, in denen Spritzen bzw. Fläschchen aufrecht stehen können.[42]
Haltbarkeit der gebrauchsfertigen Lösung
Für die gebrauchsfertige Lösung, die ab Anfang 2022 auf den Markt kommen soll, wurde eine Verwendbarkeit von bis zu 10 Wochen bei 2 bis 8 °C zugelassen.[31]
Aufbereitung vor Verimpfung

Laut Produktinformation enthält ein Injektionsfläschchen sechs Dosen des Impfstoffes mit jeweils 30 µg Tozinameran; die Zubereitung ist frei von Adjuvantien oder Konservierungsstoffen.[24] Der Fläschcheninhalt von 0,45 ml Impfstoffkonzentrat muss nach dem Auftauen durch Verdünnung mit 1,8 ml Kochsalzlösung in die gebrauchsfertige Konzentration überführt werden. Aus den sich daraus ergebenden 2,25 ml Flüssigkeit werden Dosen von 0,3 ml gebildet,[43] so dass mit Spritzen und Nadeln mit geringem Totvolumen sechs[44] oder sogar sieben[45] Dosen entnommen werden können. Ende Dezember 2020 war noch von fünf Dosen je Injektionsfläschchen ausgegangen worden. Die Injektionsfläschchen seien laut damaligen Herstellerangaben „so befüllt, dass medizinisches Personal garantiert fünf Dosen entnehmen kann, unabhängig von den verwendeten Nadeln“.[46]
Pharmazeuten weisen auf die Wichtigkeit der richtigen Aufbereitung des Impfstoffs hin, da mRNA-Impfstoffe sehr empfindlich seien. Mögliche Fehlerquellen, die zu einer abgeschwächten Wirkung bis hin zur Wirkungslosigkeit des Impfstoffs führen können, sind dabei:[47] die Nichteinhaltung der Kühlkette (Schädigung der mRNA), unsachgemäßer Transport der Impfdosen nach dem Verdünnen (z. B. auf einem Rollwagen), zu starkes Schütteln der Impfdosen bei der Zubereitung, Verwendung von zu kleinen Kanülen, zu schnelle Injektion (Scherkräfte/Druck schädigen die mRNA), die Verwendung von zu großen Spritzen (Dosierungsprobleme) sowie größere Luftansammlung in der Spritze (mehrmaliges Aufziehen/Austreiben schädigt mRNA).
Studien
Biontech testete nach eigenen Angaben zunächst 20 Impfstoffkandidaten und wählte darunter den vielversprechendsten aus.[48]
Zulassungsstudien
Im April 2020 erhielt der Impfstoff die benötigten Genehmigungen des Paul-Ehrlich-Instituts sowie der Ethik-Kommission der Landesärztekammer Baden-Württemberg für die klinische Prüfung bzw. die First-in-human-Studie in Deutschland.[49][50][51][52] Das Dossier für die klinische Studie wurde in Deutschland binnen drei Tagen, statt sonst üblicher drei Monate, bearbeitet.[48]
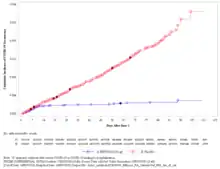
Von April bis November 2020 wurden weltweit insgesamt knapp 43.500 Probanden im Alter ab 16 Jahre im Abstand von 21 Tagen zweimal mit 30 µg BNT162b2 oder Placebo geimpft. Auch Patienten mit Adipositas oder anderen Grunderkrankungen wurden abgedeckt, 40 % der Probanden waren über 55 Jahre alt.[53][54]
Die Abschlussanalyse wurde nach 170 bestätigten Covid-19-Fällen durchgeführt. Demnach traten ab dem 7. Tag nach der zweiten Injektion in der Impfstoffgruppe 8 Fälle von symptomatischem Covid-19 sowie 162 in der Placebogruppe auf. Das entspricht einer Wirksamkeit (relative Risikoreduktion) von insgesamt 95 % (Konfidenzintervall: 90,3 bis 97,6 %). Auch für Personen über 65 Jahre liege die Wirksamkeit bei über 94 %. Von insgesamt 10 schweren COVID-19-Verläufen nach der ersten Dosis entfielen 9 auf die Placebogruppe. Die Wirksamkeit nach Gabe der ersten Dosis und vor Gabe der zweiten Dosis lag bei 52 %, in der ersten Woche nach Gabe der 2. Dosis bei 90 %.[53][54] Die beobachtete Häufigkeit von symptomatischem COVID-19 lag in der mit BNT162b2 geimpften Gruppe ab dem zwölften Tag nach der ersten Impfung unterhalb der Häufigkeit in der Placebogruppe.[54]
| Zeitlicher Bezug | Wirksamkeit (95-%-Konfidenzintervall) |
|---|---|
| Zwischen 1. und 2. Dosis (gesamter Zeitraum) | 52,4 % (29,5–68,4 %) |
| Mindestens 10 Tage nach der 1., vor 2. Dosis | 86,7 % (68,6–95,4 %) |
| 2. Dosis bis 7 Tage nach der 2. Dosis | 90,5 % (61,0–98,9 %) |
| Mindestens 7 Tage nach der 2. Dosis | |
| gesamt (alle Altersgruppen) | 95,0 % (90,0–97,9 %) |
| 16 bis 55 Jahre | 95,6 % (89,4–98,6 %) |
| ≥55 Jahre | 93,7 % (80,6–98,8 %) |
| ≥65 Jahre | 94,7 % (66,7–99,9 %) |
Am 1. April gaben Biontech und Pfizer Ergebnisse einer weiteren Datenanalyse der Zulassungsstudie bekannt. Von den 927 symptomatischen Covid-19-Fällen, die bis 13. März und bis zu sechs Monate nach der zweiten Dosis erfasst wurden, traten 850 in der Placebo- und 77 in der mit Tozinameran geimpften Gruppe auf. Die Wirksamkeit, bezogen auf Vermeidung von symptomatischen Covid-19 jedweden Schweregrads, lag damit bei 91,3 %. Alle 32 schweren Covid-19-Fälle (nach CDC-Richtlinien) traten in der Placebogruppe auf. Von 21 nach FDA-Richtlinien beobachteten schweren Covid-19-Fällen traten 20 in der Placebo-Gruppe auf.[56]
Der Impfstoff gilt als gut verträglich und die unerwünschten Wirkungen beschränkten sich überwiegend auf Impfreaktionen wie Schmerzen an der Einstichstelle oder kurzzeitige Abgeschlagenheit.[57] Schwere Nebenwirkungen traten in der Impfstoff-Gruppe nicht häufiger auf als in der Placebo-Gruppe.[58][54] Die Anforderungen der U.S. Food and Drug Administration (FDA) für die Zulassung wurden damit erfüllt.[59]
Kritik an der Datenintegrität der Phase 3-Studie
Anfang November 2021 veröffentlichte das Fachjournal The BMJ, dass bei dem Unternehmen Ventavia Research Group mehrere Unregelmäßigkeiten dabei auftraten. Das von Pfizer beauftragte Ventavia hatte drei der 153 Studienstandorte der Phase 3-Zulassungsstudie betreut, etwa 1000 von insgesamt 44.000 Teilnehmern.[60] Die Regionaldirektorin des Unternehmens hatte im September 2020 zunächst ihre Vorgesetzten, Ende des Monats die US-amerikanische Arzneimittelbehörde Food and Drug Administration (FDA) über erhebliche Missstände informiert, die jedoch keine Überprüfung vor Ort durchführte. So seien unter anderem Qualitätsprobleme aufgetreten, die Verblindung wurde zum Teil aufgehoben, auch fehlten Mitarbeiter, um Probanden mit Covid-19-Symptomen zuverlässig auf eine Infektion zu testen. Die Whistleblowerin wurde umgehend entlassen, ihre Aussagen später von ehemaligen Kollegen bestätigt.[61] Auf BMJ Opinion benannte BMJ-Mitherausgeber Peter Doshi bereits Anfang Januar 2021 detailliert eine Vielzahl an offenen Fragen zu den wissenschaftlichen Standards der Zulassungsstudie, und forderte unter anderem die Offenlegung der Rohdaten.[62]
Anders als in Deutschland und Frankreich, wo viele große Magazine und überregionale Zeitungen wie z. B. Der Spiegel,[63] Focus, Die Welt, Le Figaro,[64] Liberation, L’Express und viele andere Medien darüber detailliert berichteten, wurde über den Artikel von The BMJ in den amerikanischen Medien fast nichts berichtet. Eines der wenigen allgemeinen Portale, die berichteten, war z. B. das Internetportal des regionalen Fernsehsenders CBS 17.[65] Dort sah man das Problem als gering an, weil das betroffene Subunternehmen nur einen geringen Teil der Probanden betreute.[66] Dem schloss sich die EMA an, da das Gesamtergebnis von den möglichen Fehlern nicht beeinflusst wird: „Obwohl die Anschuldigungen schwerwiegend sind, ziehen sie die Sicherheit, Effektivität und Qualität des Impfstoffs selbst nicht in Zweifel.“[60]
Anwendungsstudien
Laut einer veröffentlichten Studie nahm in Israel (Impfstart Dezember 2020) der Anteil der moderat bis schweren Covid-19-Verläufe in der Altersgruppe der über-60-Jährigen ab der 2. Januarwoche 2021 ab. Dies könne nur mit den Impfungen erklärt werden. Die Wirksamkeit von 95 Prozent ab dem 28. Tag nach der ersten Dosis habe bestätigt und eine Wirksamkeit von 50 Prozent 10 Tage nach der ersten Dosis gezeigt werden können.[67][68]
Mitte Februar 2021 wurden die Ergebnisse einer vergleichenden Studie an rund 9100 impfberechtigten Mitarbeitern des größten israelischen Krankenhauses, die ab 19. Dezember 2020 geimpft wurden, veröffentlicht. Bis zum 24. Januar 2021 hatten 79 % der Mitarbeiter die erste Dosis und 66 % die zweite Dosis erhalten. Von 170 Mitarbeitern, die bis dahin infiziert wurden, waren 89 nicht geimpft, 78 hatten die erste und 3 die zweite Dosis erhalten. Mit adjustierten Daten lag die berechnete Wirksamkeit bis 14 Tage nach der 1. Dosis bei 30 %, in den Tagen 15 bis 28 bei 75 %.[69]
Am 20. Februar 2021 gab das israelische Gesundheitsministerium Daten zur beobachteten Wirksamkeit bekannt, wobei geimpfte Personen (mindestens 14 Tage nach der 2. Dosis) und nicht geimpfte Personen miteinander verglichen wurden. Demnach liege die Wirksamkeit in Bezug auf die Vermeidung eines schweren Verlaufs bei 99,2 Prozent, die eines tödlichen Verlaufs bei 98,9 Prozent.[70] Laut noch unveröffentlichten Daten einer Beobachtungsstudie des israelischen Gesundheitsministeriums und Pfizer soll die Wirksamkeit bezogen auf die Vermeidung einer (symptomatischen oder asymptomatischen) Covid-19-Infektion bei 89 Prozent liegen.[71]
In einer Studie an Mitarbeitern des Gesundheitswesens in England zeigte eine Wirksamkeit gegen symptomatische und asymptomatische Infektionen von 70 % nach der ersten Dosis und 85 % eine Woche nach der zweiten Dosis.[72] Eine prospektive Kohortenstudie aus Schottland von Anfang Dezember bis Ende Februar 2021 zeigte eine Risikoreduktion für eine Krankenhausbehandlung durch COVID-19 nach der ersten Impfdosis von 91 %.[73]
Volle Wirksamkeit
Die volle Wirksamkeit wird den klinischen Studien gemäß 7 Tage nach der zweiten Impfung erreicht.[74] Einzelne Länder nehmen die volle Wirksamkeit im Rahmen ihrer Einreiseverordnungen erst später an, so z. B. Deutschland erst nach 14 Tagen.[75]
Wirksamkeit gegen Varianten
Laut Herstellerangaben neutralisierten die durch Impfung mit Tozinameran generierten Antikörper im Rahmen einer In-vitro-Studie die Schlüsselmutation N501Y der SARS-CoV-2-Variante Alpha und auch die SARS-CoV-2-Variante Beta. In einer weiteren In-vitro-Studie neutralisierten die Antikörper auch das Spektrum der Spike-Mutationen der britischen SARS-CoV-2-Variante.[76]
In einer Studie wurde die Neutralisationsstärke von Rekonvaleszenz- gegenüber Pfizer-BTN162b2-Seren nach der Impfung gegen Pseudoviren überprüft, die Spike-Proteine aufweisen, die von Wildtyp-SARS-CoV-2 oder seinen UK-B.1.1.7- und SA-B.1.351-Varianten abgeleitet sind. Im Vergleich zu Rekonvaleszenzseren induziert die Impfung hohe Titer neutralisierender Antikörper, die eine wirksame Neutralisationskraft gegen Pseudoviren aufweisen, die Wildtyp-SARS-CoV-2 tragen. Während Wildtyp- und UK-N501Y-Pseudoviren ähnlich neutralisiert wurden, widersetzen sich diejenigen, die SA-N501Y / K417N / E484K-Spike-Mutationen aufweisen, der Neutralisation mäßig. Die Studie validiert die klinische Wirksamkeit des Pfizer-Impfstoffs, wirft jedoch Bedenken hinsichtlich seiner Wirksamkeit gegen bestimmte zirkulierende SARS-CoV-2-Varianten auf.[77]
Anhand von Daten aus der Praxis errechneten Forscher in England die Wirksamkeit nach zwei Dosen gegenüber der Variante B.1.617.2 (Delta) auf 87,9 %.[78] Laut Hersteller wurde in einer ersten Laborstudie festgestellt, dass die Wirksamkeit bei zwei Dosen gegenüber der Variante B.1.1.529 (Omikron) signifikant abnimmt, ein Schutz vor schweren Verläufen sei jedoch weiterhin gewährleistet.[79] Nach einer dritten Dosis (Booster) sei die ursprüngliche Wirksamkeit gegenüber dem Wildtyp des Virus wiederhergestellt.[79] Pfizer und BioNTech arbeiten an einem angepasstem Wirkstoff für die Omikron-Variante und erwarten die Verfügbarkeit für März 2022.[79]
Nachlassende Impfstoffwirksamkeit
Im Juli 2021 veröffentlichte die israelische Regierung Daten, die zeigen, dass die Wirksamkeit des Impfstoffs Tozinameran (BioNTech/Pfizer) nachlässt.[80][81] In Deutschland schoben einige Experten dies auf mögliche Statistikfehler,[82] während andere besorgt waren.[83]
Eine im August 2021 als Preprint veröffentlichte Studie der Mayo Clinic bestätigte die israelischen Ergebnisse über den Rückgang der Effektivität des Impfstoffs Tozinameran (BioNTech/Pfizer), aber auch der des Impfstoffs mRNA-1273 (Moderna).[84][85] Über den gesamten Beobachtungszeitraum von Januar bis Juli 2021 hinweg betrachtet lag beim Biontech-Impfstoff die Wirksamkeit gegenüber Infektion bei 76 Prozent und gegenüber Krankenhauseinweisung (Hospitalisierung) bei 85 Prozent, während beim Moderna-Impfstoff die Wirksamkeit bei 86 Prozent bzw. 91,6 Prozent lag. Betrachtet man dagegen den Juli 2021 allein, so ging die Wirksamkeit beider Impfstoffe zurück, besonders stark jedoch die von Tozinameran: Die Wirksamkeit des Biontech-Impfstoffs gegen eine Infektion lag nur noch bei 42 Prozent und gegen eine Hospitalisierung bei 75 Prozent, während die Wirksamkeit des Moderna-Impfstoffs auf 76 Prozent gegen eine Infektion bzw. 81 Prozent gegen eine Hospitalisierung zurückging. Die verglichenen Kohorten waren dabei u. a. bezüglich Alter, Geschlecht und Datum der Zweitimpfung angepasst.[86]
In Großbritannien stellte man im August 2021 fest, dass die Wirkung der Impfung mit Tozinameran mit der Zeit schneller nachlässt als mit dem Impfstoff von AstraZeneca: sei die Effektivität gegen Infektionen anfangs noch um 15 Prozent(punkte) höher als bei der Zweitimpfung mit AZD1222, so sei nach vier bis fünf Monaten die Schutzwirkung bereits ziemlich gleich.[87]
Nach einer im Oktober 2021 in der Fachzeitschrift New England Journal of Medicine veröffentlichten Studie aus über die Wirkung des Impfstoffs bei der Bevölkerung in Katar nimmt die Wirksamkeit der Impfung mit BNT162b2 gegenüber (asymptomatischer und symptomatischer) Infektion in den ersten fünf Monaten nach der Zweitimpfung rapide ab, während die Wirksamkeit gegenüber schwerem, kritischem bzw. tödlichem Verlauf über (mindestens) sechs Monate hinweg auf hohem Niveau bleibt;[88] allerdings ist die Vergleichbarkeit mit anderen Ländern eingeschränkt, weil nur 9 Prozent der Bevölkerung dort 50 Jahre oder älter ist.[89]
Nach der Ende Oktober 2021 als Preprint veröffentlichten schwedischen Kohortenstudie für den Zeitraum vom 12. Januar bis 4. Oktober 2021 nimmt die Impfeffektivität der untersuchten Impfstoffe (von BioNTech/Pfizer, Moderna und AstraZeneca) innerhalb weniger Monate stark ab, wobei die Abnahme gegenüber schweren Verläufen allerdings langsamer ist als gegen symptomatische Infektionen.[90] Der Impfstoff Tozinameran von BioNTech/Pfizer zeigt nach dieser Studie folgende mittlere Impfeffektivitäten (engl. „vaccine effectiveness“ VE = 1 - Odds ratio) gegenüber der symptomatischen Infektion:
- 92 Prozent (92 bis 93 Prozent)[91] VE nach 15 bis 30 Tagen nach der Zweitimpfung, d. h. das Infektionsrisiko der Geimpften war in diesem Zeitraum nur das 0,08-fache vom Infektionsrisiko der Ungeimpften
- 47 Prozent (39 bis 55 Prozent) VE nach 121 bis 180 Tagen, d. h. das Risiko einer Infektion war für die Geimpften etwa halb so groß wie für die Ungeimpften.
- Nach mehr als 210 Tagen war eine Impfeffektivität statistisch nicht mehr sicher feststellbar: Bei einem Schätzwert von 23 Prozent reicht das Konfidenzintervall (zum 95%-Niveau) von −2 bis 41 Prozent.
Impfintervall
Vom Hersteller wird als Abstand zwischen der Erst- und Zweitimpfung (Impfintervall) ein Abstand von drei Wochen empfohlen, was für Impfungen relativ kurz ist. Aufgrund des Mangels an Impfstoffen hat man sich in vielen Ländern jedoch dazu entschieden, das Impfintervall zu verlängern, damit mehr Menschen zumindest die Erstimpfung haben. Es stellte sich die Frage, ob damit die Impfwirksamkeit sinkt. Bei einer im Mai 2021 veröffentlichten Kohortenstudie bei Personen über 80 Jahren zeigte sich, dass die maximalen Antikörperspiegel bei einem Intervall von 11 bis 12 Wochen um den Faktor 3,5 höher waren.[92][93] Ein ähnlicher Effekt wurde auch bei einer anderen Studie (PITCH-Studie)[94] bei Mitarbeitern aus dem Gesundheitswesen festgestellt, hier war auch die T-Zell-Immunität beim längeren Intervall verbessert.[95][96]
Rückgang der Antikörper nach der Zweitimpfung
Im Rahmen der im Mai 2021 veröffentlichten Kohortenstudie bei Personen über 80 Jahren wurde festgestellt, dass der Antikörperspiegel 10 bis 11 Wochen nach der 2. Impfung bereits wieder um den Faktor 2,6 zurückgegangen ist, wenn das Impfintervall drei Wochen beträgt. Wie schnell der Rückgang bei längerem Impfintervall ist, wurde nicht untersucht bzw. war bei Veröffentlichung noch nicht bekannt, denn das Hauptziel der Studie war der Vergleich der (maximalen) Antikörperspiegel bei kurzem und langem Intervall.[92][93]
Nach den im Juli 2021 im Rahmen einer Quartalsmitteilung von Pfizer veröffentlichten Daten aus einer Kleinstudie des Herstellers sank der Titer für die neutralisierenden Antikörper gegen den Wildtyp in der Probandengruppe von 11 Personen im Alter von 18 bis 55 Jahren nach 8 Monaten im Vergleich zum Titer 7 Tage nach der Zweitimpfung um den Faktor 6 und in einer älteren Probandengruppe war der Rückgang noch stärker.[97]
Nach einer Anfang Oktober 2021 im New England Journal of Medicine veröffentlichten Studie aus Israel nimmt die Menge der Antikörper innerhalb von 6 Monaten stark ab, besonders ausgeprägt ist die Abnahme dabei bei Männern, bei Personen ab 65 und bei Menschen mit Immunsuppression.[98]
Antikörperstudie des PEI
Das PEI veröffentlichte eine hauseigene Studie zum Vergleich der Antikörperbildung nach Anwendung verschiedener mRNA-Impfstoffe und nach COVID-19-Infektion.[99]
Anwendung in der Schwangerschaft
Mitte Februar 2021 wurde der Beginn einer Phase-2/3-Studie zur Sicherheit, Wirksamkeit und Verträglichkeit des Impfstoffs an schwangeren Frauen ab 18 Jahren bekanntgegeben.[100] In die Studie sollen etwa 4000 Frauen in der 24. bis 34. Schwangerschaftswoche aufgenommen werden, die zu gleichen Anteilen den Impfstoff oder ein Placebo erhalten sollen.[101]
Siehe auch Empfehlungen der Ständigen Impfkommission (STIKO),[102] der US-Behörde CDC[103] und der UK Health Security Agency.[104][105][106] Es gibt Hinweise darauf, dass die Impfung bei der Mutter die Bildung von Antikörpern gegen das Spike-Protein (anti-S IgG) induziert, die transplazentar weitergegeben werden und hierdurch das Kind schützen können (Nestschutz). Laut einer kleinen Studie schützt eine Impfung besser als eine durchgemachte Infektion mit SARS-CoV-2 das Neugeborene.[107]
Studien an Jugendlichen und Kindern
Für die erforderlichen Studien an Kindern veröffentlichte die EMA im Zusammenhang mit der Zulassungserteilung im Dezember 2020 auch die pädiatrischen Untersuchungspläne (englisch paediatric investigation plans, PIP).[108] Dabei arbeitet die EMA eng mit der FDA zusammen, die dafür im Juni 2020 einen Kooperationsvertrag abgeschlossen haben. Die Pläne sehen ein beschleunigtes Verfahren vor, indem die Bearbeitungszeiten der Daten verkürzt werden.[109]
Pfizer und BioNTech erwarten (Stand Februar 2021) den Start zusätzlicher Studien bei Kindern zwischen 5 und 11 Jahren in den nächsten Monaten und bei Kindern unter 5 Jahren zu einem späteren Zeitpunkt in diesem Jahr.[100] Die Sicherheit und Wirksamkeit bei Personen zwischen 12 und 15 Jahren werden bereits in einer Phase-2/3-Studie untersucht.[110] Laut erster, Ende März 2021 kommunizierter Ergebnisse traten in der Studie, in die 2260 Jugendliche im Alter von 12 bis 15 Jahren den Vereinigten Staaten eingeschlossen wurden, alle 18 beobachteten Covid-19-Fälle in der Placebo-Gruppe auf. BNT162b2 sei ferner gut verträglich; die Nebenwirkungen seien vergleichbar mit denen bei 16- bis 25-Jährigen.[111] Auf dieser Grundlage beantragten Pfizer und Biontech am 9. April 2021 in den Vereinigten Staaten, die Zulassung auf Jugendliche zwischen 12 und 15 Jahren zu erweitern.[112] Ende April 2021 stellten sie bei der EU-Behörde EMA den Antrag, Tozinameran auch für Jugendliche zwischen 12 und 15 Jahren zuzulassen.[113]
Ende März 2021 begann eine Studie mit Kindern zwischen dem 6. Lebensmonat und dem 11. Lebensjahr.[111]
Am 20. Oktober 2021 veröffentlichte The New England Journal of Medicine eine Studie, die Daten von 94.354 zweifach geimpften Jugendlichen im Alter von zwölf bis 18 Jahren verglichen hatten mit denen von ungeimpften Jugendlichen. Die Geimpften hatten ein 90 % geringeres Risiko einer COVID-Erkrankung und ein 93 % geringeres Risiko einer Erkrankung mit Symptomen. Die Daten wurden im Zeitraum 8. Juni bis 14. September 2021 erhoben.[114]
Wiederholungsimpfung (Auffrischungsimpfung, Booster)
BioNTech und Pfizer gaben am 25. Februar 2021 bekannt, dass sie mit der Bewertung der Sicherheit und Immunogenität einer dritten Dosis des Impfstoffs Tozinameran (Comirnaty, BNT162b2) begonnen haben, um die Wirkung eines Boosters auf die Immunität gegen COVID-19 – verursacht durch die zirkulierenden und potenziellen neu auftretenden SARS-CoV-2-Varianten – zu untersuchen. Die Studie stützt sich auf Teilnehmer aus der Phase-1-Studie in den USA, denen die Möglichkeit geboten wird, 6 bis 12 Monate nach Erhalt ihrer ersten Zwei-Dosis-Therapie einen 30-µg-Booster des aktuellen Impfstoffs zu erhalten. Die Studie ist Teil der klinischen Entwicklungsstrategie der Unternehmen, um die Wirksamkeit der dritten Dosis gegen sich entwickelnde Varianten zu ermitteln.[115] Am 21. Oktober 2021 gaben BioNTech und Pfizer Ergebnisse einer randomisierten Phase-3-Studie an über 10.000 Menschen bekannt. Die Median-Zeit zwischen zweiter Impfung und dritter Impfung (bzw. Placebo bei der Kontrollgruppe) betrug 11 Monate; das Median-Alter der Teilnehmer 53 Jahre.[116]
In Israel wurde im August 2021 eine Gruppe von 1,1 Millionen voll geimpften Menschen über 60 statistisch ausgewertet, die vor mindestens 5 Monaten ihre zweite Tozinameran-Impfung erhalten hatten. Ein Teil dieser Menschen (booster group) hatte mindestens 12 Tage zuvor eine dritte Tozinameran-Impfung erhalten. Einige der 1,1 Millionen Menschen hatten sich trotz zweiter Impfung kürzlich mit COVID-19 infiziert. Für die dreifach geimpften Ü60er war das Infektionsrisiko 11,3 mal niedriger; das Risiko eines schweren Infektionsverlaufs war 19,5 mal niedriger.[117]
Herstellerstudie zur Auffrischungsimpfung
Im Oktober 2021 veröffentlichte Pfizer in einer Pressemitteilung die Ergebnisse der Phase 3 Studie zur Auffrischungsimpfung, die eine starke Wirksamkeit zeigte: Gegenüber der zweifachen Impfung mit Tozinameran habe die dreifache Impfung eine relative Wirksamkeit von 95,6 Prozent. Darin wurde auch erklärt, dass geplant sei, detaillierte Daten in einem Fachmagazin mit Peer-Review einzureichen,[118] allerdings gab es bislang (Stand 20. November 2021) noch keine Veröffentlichung.
Zulassung
| Staat / Staatenverbund | Zulassungsdatum | Quellen |
|---|---|---|
| 2. Dez. 2020 | [119] | |
| 4. Dez. 2020 | [120][121] | |
| 9. Dez. 2020 | [120][121][122] | |
| 10. Dez. 2020 | [121][123] | |
| 23. Aug. 2021 | [124] | |
| Dez. 2020 | [125] | |
| 11. Dez. 2020 | [126][127][128] | |
| 13. Dez. 2020 | [129] | |
| 14. Dez. 2020 | [130] | |
| 14. Dez. 2020 | [131] | |
| Dez. 2020 | [126][127][128] | |
| 17. Dez. 2020 | [126][127][132][128] | |
| 17. Dez. 2020 | [132] | |
| 19. Dez. 2020 | [133][134] | |
| Dez. 2020 | [135][136] | |
| Dez. 2020 | [137] | |
| Dez. 2020 | [137] | |
| Dez. 2020 | [137] | |
| 21. Dez. 2020 | [138][139] | |
| 22. Dez. 2020 | [140] | |
| Jan. 2021 | [141] | |
| 14. Jan. 2021 | [142] | |
| 25. Jan. 2021 | [143] | |
| 25. Jan. 2021 | [144] | |
| Jan. 2021 | [145] | |
| 3. Feb. 2021 | [146] | |
| 14. Feb. 2021 | [147] | |
| 5. März 2021 | [148] | |
| 15. März 2021 | [149] | |
| 17. März 2021 | [150] | |
| 31. Mai 2021 | [151] |
Zulassung außerhalb der EU
Erstmals erhielt Tozinameran am 2. Dezember 2020 eine Notfallzulassung für das Vereinigte Königreich von der britischen Gesundheitsbehörde MHRA.[152] Es besteht keine Vermarktungserlaubnis (Marketing Authorisation) für den Impfstoff. Die Genehmigung wurde vorübergehend erteilt für die Anwendung zur aktiven Immunisierung zwecks Vorbeugung der durch SARS-CoV-2 verursachten COVID-19-Krankheit bei Personen ab 16 Jahren und ist mit einer Reihe von Auflagen verbunden. Das in Großbritannien für die Belieferung mit dem Impfstoff verantwortliche Unternehmen ist Pfizer.[153] Am 8. Dezember 2020 erhielt die 90-jährige Britin Margaret Keenan an der Universitätsklinik Coventry als weltweit erste Person den Wirkstoff nach seiner Zulassung.[154]
Am 9. Dezember erteilte die kanadische Behörde Health Canada Tozinameran (Handelsname: Pfizer-Biontech COVID-19 Vaccine) eine mit Auflagen verbundene, befristete Marktzulassung. Zulassungsinhaber ist BionTech und für Import und Distribution Pfizer zuständig.[155]
Zwei Tage später, am 11. Dezember 2020, erteilte die US-Behörde Food and Drug Administration (FDA)dem Biontech-Impfstoff eine Notfallzulassung (Emergency use authorization, EUA) für die USA. Der Antrag war am 20. November 2020 gestellt worden. In einer am 10. Dezember 2020 einberufenen Sitzung hatte das Vaccines and Related Biological Products Advisory Committee (VRBPAC), der Beratende Ausschuss für Impfstoffe und verwandte Biologika der FDA, über das Nutzen-Risiko-Verhältnis beraten, also ob:
- aufgrund der Gesamtheit der verfügbaren wissenschaftlichen Erkenntnisse davon ausgegangen werden kann, dass der Impfstoff COVID-19 bei Personen ab 16 Jahren wirksam verhindern kann;
- die bekannten und potenziellen Vorteile des Impfstoffs die bekannten und potenziellen Risiken für die Anwendung bei Personen ab 16 Jahren überwiegen.
Hierfür war im Vorfeld ein Briefing Document erarbeitet worden, das alle bisherig verfügbaren Daten enthält. Ein weiterer Diskussionspunkt war die Frage, welche zusätzlichen Studien der Impfstoffhersteller nach Erteilung der Notfallzulassung durchführen sollte, um weitere Daten zur Sicherheit und Wirksamkeit dieses Impfstoffs zu sammeln.[33] Offen sei beispielsweise die Wirksamkeit bei Kindern und Jugendlichen bis zum 15. Lebensjahr, die Vermeidung einer asymptomatischen Infektion sowie Langzeit-Nebenwirkungen.[33] Das Gremium stimmte mit 17 zu 4 Stimmen bei einer Stimmenthaltung für die Notfallzulassung von BNT162b2.[156] Am 29. Oktober 2021 erteilte die FDA dem Impfstoff auch eine Notfallzulassung für Kinder im Alter von fünf bis elf Jahren.[157] Die Impfdosis entspricht mit 10 µg einem Drittel der Dosis für alle anderen Altersgruppen.[157]
Die weltweit erste Zulassung in einem „ordentlichen Verfahren“ erfolgte am 19. Dezember 2020 in der Schweiz.[133] Ende Januar 2021 erfolgte eine Notfallgebrauchszulassung in Hongkong.[158]
Zulassung in der EU
Nachdem die Europäische Arzneimittel-Agentur (EMA) die Prüfung von Tozinameran Anfang Oktober 2020 mittels Rolling-Review-Verfahren begonnen hatte,[159][160] stellten Biontech/Pfizer am 1. Dezember 2020 einen Zulassungsantrag in der EU.[161] Die EMA kann in Einzelfällen eine bedingte Zulassung empfehlen, noch bevor die Daten der klinischen Prüfung vollständig vorliegen. In dem Fall verpflichtet sich das Pharmaunternehmen, von der Behörde festgelegte Bedingungen innerhalb eines bestimmten Zeitraumes zu erfüllen, beispielsweise vollständige Phase-III-Daten nachzuliefern. Die vor der Antragstellung eingeleitete „fortlaufende Überprüfung“ (rolling review) ist ein besonderes Verfahren, das der EMA in einem Notfall im Bereich der öffentlichen Gesundheit zur Verfügung steht, um Daten für ein vielversprechendes Arzneimittel zu bewerten, sobald sie auf einer fortlaufenden Basis verfügbar werden.[161]
Der Ausschuss für Humanarzneimittel (CHMP) der EMA schloss am 21. Dezember 2020 seine wissenschaftliche Beurteilung mit einer Empfehlung des Impfstoffs ab. Bis dahin mussten noch Unterlagen erarbeitet werden wie:[162]
- vollständige Verschreibungsinformationen und Packungsbeilagen mit detaillierten Anweisungen zur sicheren Verwendung;
- Entwurf eines Plans für das Risikomanagement und die Sicherheitsüberwachung;
- Beschreibung der Herstellungskontrollen einschließlich Chargenkontrollen für Impfstoffe und deren Lagerungsbedingungen;
- Erstellung einer Strategie für die Untersuchung der Anwendung bei Kindern;
- Erlass rechtsverbindlicher Verpflichtungen nach der Genehmigung und ein klarer rechtlicher Rahmen für die Bewertung neu auftretender Wirksamkeits- und Sicherheitsdaten.
Die EU-Kommission erteilte binnen weniger Stunden noch am gleichen Tag die Marktzulassung – anstelle der normalerweise üblichen 67 Tage. Die Kommission begründete das Vorgehen einer vollständigen Zulassung mit Auflagen (bedingte Zulassung) anstelle einzelner nationaler Notfallzulassungen wie folgt:
- „Um ein hohes Schutzniveau für die Bürgerinnen und Bürger während einer Massenimpfkampagne zu gewährleisten, haben alle EU-Staaten gemeinsam entschieden, den Weg zu einer europaweit gültigen bedingten Marktzulassung des Impfstoffes zu gehen.[163] Demgegenüber würde eine Notfallzulassung die vorübergehende Anwendung eines nicht zugelassenen Impfstoffs in einem Land autorisieren, jedoch nicht seine tatsächliche Zulassung umfassen. Zwischen beiden Verfahren gibt es Unterschiede unter anderem hinsichtlich der zu prüfenden Daten, der Sicherheitsüberwachung während der Anwendung und der Haftung der Pharmaunternehmen.“
Die bedingte Marktzulassung gilt für einen Zeitraum von einem Jahr. Sie wurde am fristgerecht am 3. November 2021 erneuert.[164]
Auch weiteren Arzneimittelbehörden weltweit wurden bzw. werden die Ergebnisse der klinischen Studien zur Verfügung gestellt.
Die Ständige Impfkommission in Deutschland empfahl zwischen 1. und 2. Dosis zunächst einen Abstand von drei Wochen.[165] Am 1. April 2021 wurde dieser Impfabstand auf sechs Wochen angehoben.[166] Hierdurch könne sowohl „eine sehr gute individuelle Schutzwirkung als auch ein größerer Effekt der Impfung auf Bevölkerungsebene“ erzielt werden.[167]
Am 22. Dezember erteilte das Paul-Ehrlich-Institut (PEI), als erstes europäisches amtliches Arzneimittel-Kontrolllabor, eine EU-Chargenfreigabe für drei Chargen mit insgesamt 4,1 Millionen Dosen. Am gleichen Tag folgte die staatliche Chargenfreigabe für Deutschland, ebenfalls durch das PEI.[168] Die erste reguläre Impfung in Deutschland erhielt am 26. Dezember 2020 die 101-jährige Edith Kwoizalla in einem Altenheim in Halberstadt.[169]
Ende Februar 2021 wurden Studien bekannt, nach denen durch diese Impfung das Risiko einer Übertragung deutlich gesenkt werde.[170]
Nebenwirkungen
Der Impfstoff gilt als gut verträglich und sicher. In der Phase-2/3-Zulassungsstudie (siehe oben) waren die häufigsten Nebenwirkungen bei den Probanden der Altersgruppe 18 bis 55 Jahre nach der zweiten Impfung:[33]
| Symptom | Häufigkeit | Kontrollgruppe |
|---|---|---|
| Schmerzen an der Injektionsstelle | 77,8 % | 11,7 % |
| Müdigkeit | 59,4 % | 22,8 % |
| Kopfschmerzen | 51,7 % | 24,1 % |
| Muskelschmerzen | 37,3 % | 8,2 % |
| Schüttelfrost | 35,1 % | 3,8 % |
| Gelenkschmerzen | 21,9 % | 5,2 % |
| Fieber | 15,8 % | 0,5 % |
Schwerwiegende unerwünschte Ereignisse traten in der Impfgruppe mit einer geringen Häufigkeit auf und lagen auf Placebo-Niveau (0,6 % vs. 0,5 %).[58][54]
Häufigkeit und Schwere der oben genannten systemischen Nebenwirkungen, mit Ausnahme von Erbrechen und Durchfall, waren nach der zweiten Dosis höher als nach der ersten. Ferner waren Häufigkeit und Schweregrad systemischer Nebenwirkungen in den jüngeren Altersgruppen höher als in den älteren.[33] Allergische Reaktionen unmittelbar nach der Impfung waren in beiden Gruppen, aber etwas häufiger in der Verumgruppe beobachtet worden (137 [0,63 %] gegenüber 111 [0,51 %] in der Kontrollgruppe).[33]
Am 8. Dezember 2020 begannen in Großbritannien Impfungen mit Tozinameran. Die MHRA wies und weist – wie bei Impfstoffen üblich – vorsorglich darauf hin, dass Menschen mit einer signifikanten Vorgeschichte allergischer Reaktionen sich nicht impfen lassen sollten.[171]
Vereinzelt wurden weitere unerwünschte gesundheitliche Vorkommnisse beobachtet. Sie waren in der Verumgruppe ähnlich häufig wie allgemein in der Bevölkerung (Hintergrundrate). Deshalb wird vermutet, dass sie nur zeitgleich auftraten (Koinzidenz) und nicht durch die Impfung verursacht wurden.
Eine Veränderung des Erbguts ist biochemisch nicht möglich, da die mRNA von Tozinameran nicht in Zellkerne des Menschen, in denen sich die DNA befindet, eindringen kann. Impfreaktionen treten üblicherweise kurz nach der Impfung auf (und nicht etwa erst nach Jahren); längerfristige Nebenwirkungen gelten deshalb als extrem unwahrscheinlich. Auch extrem seltene Nebenwirkungen sollten daher spätestens wenige Monate nach Beginn der weltweiten Impfkampagnen erkannt worden sein.[172][173] Staatliche Kontrollbehörden vieler Länder sammeln Meldungen über gesundheitliche Vorkommnisse nach Impfungen und untersuchen, ob es einen Zusammenhang zwischen der Impfung und Vorkommnissen gegeben haben könnte.
Um das Sicherheitsprofil von COVID-19-Impfstoffen auch nach der Zulassung zeitnah und auf noch breiterer Datenbasis zu erfassen, hat das Paul-Ehrlich-Institut (PEI) die Smartphone-App SafeVac 2.0 entwickelt. Damit können Geimpfte digital Auskunft darüber geben, wie sie die Impfung vertragen haben. Im Sinne des Arzneimittelgesetzes handelt es sich um eine Anwendungsbeobachtung, das Design entspricht einer prospektiven einarmigen nicht interventionellen Kohortenstudie.[174] Nach 5,379 Millionen Impfungen bis zum 26. Februar 2021 mit Tozinameran in Deutschland, darunter 3,385 Millionen Erstimpfungen, berichtete das PEI über 8368 Verdachtsfälle unerwünschter Reaktionen. Dies entspricht 1,6 Einzelfallmeldungen je 1000 Impfungen. Zu den häufigsten Reaktionen zählten Schmerzen an der Einstichstelle, Ermüdung und Kopfschmerzen. 1705 (0,3 je tausend) wurden als schwerwiegende Reaktionen klassifiziert, bei denen die betroffenen Personen entweder im Krankenhaus behandelt oder die Reaktionen als medizinisch bedeutsam beurteilt wurde. Die bisher gemeldeten Reaktionen seien „vor allem vorübergehende Lokalreaktionen und Allgemeinreaktionen, die auch in den klinischen Prüfungen vor der Zulassung berichtet wurden“. 263 Personen waren im Abstand zwischen einer Stunde und 34 Tagen nach der Impfung gestorben. Darunter waren geimpfte Patienten, die alle über einen noch nicht kompletten Impfschutz verfügten, und mit bzw. an COVID-19 verstarben. Weitere Verstorbene litten an multiplen Vorerkrankungen und waren an einer Verschlechterung ihrer Grunderkrankung gestorben. Bei allen anderen Patienten bestanden mehrere schwerwiegende Vorerkrankungen wie beispielsweise Karzinome, Niereninsuffizienz, Herzerkrankungen und arteriosklerotische Veränderungen, „die vermutlich todesursächlich waren“. Die beobachtete Anzahl an plötzlichen Todesfällen übersteige nach Impfung die erwartete Anzahl derartiger Todesfälle ohne Impfung bei älteren Menschen nicht. In einzelnen Fällen stünden noch weitere Informationen aus.[175]
Die Ständige Impfkommission beim Robert Koch-Institut (STIKO) wies am 8. Januar 2021 auf „einzelne schwerwiegende, allergische Unverträglichkeitsreaktionen“ hin. „Nach der derzeitigen Datenlage [ist] ein generell erhöhtes Risiko für schwerwiegende unerwünschte Wirkungen für Personen mit vorbekannten allergischen Erkrankungen bei Impfung mit mRNA-Impfstoffen nicht anzunehmen, sofern keine Allergie gegen einen Inhaltsstoff der jeweiligen Impfstoffe (z. B. PEG) vorliegt“.[176] Die Deutschen Allergiegesellschaften (AeDA, DGAKI, GPA) haben zu schweren allergischen Reaktionen ebenfalls Stellung genommen. Aufgrund des Verdachts, dass PEG der Auslöser sei, empfehlen sie, allergische Reaktionen auf Inhaltsstoffe, insbesondere PEG und kreuzreaktive PEG-Analoga (beispielsweise Polysorbate), systematisch abzufragen, um Risikopatienten zu identifizieren; in Verdachtsfällen solle eine allergologische Abklärung erfolgen.[177] In rund einem von 100.000 Fällen wurden in Deutschland und den Vereinigten Staaten anaphylaktische Reaktionen beobachtet.[178] In einer Einzelfallstudie, veröffentlicht im April 2021, wurde PEG als Auslöser einer allergischen Reaktion identifiziert.[179]
Die EMA arbeitet beim Monitoring der Sicherheit von COVID-19-Impfstoffen nach der Zulassung in den EU-Mitgliedstaaten (post approval safety monitoring) mit der Universität Utrecht zusammen.[180][181]
Auch wird im Zusammenhang mit der mRNA-Impfung Durchfall und Erbrechen als mögliche Nebenwirkung in Erwägung gezogen.[182]
Am 26. April 2021 wurde bekannt, dass Israel, das weltweit eine der höchsten Impfquoten aufweist, Herzmuskelentzündungen in Verbindung mit dem BioNTech/Pfizer-Impfstoff untersucht. Dutzende von Fällen waren überwiegend bei jungen Männern hauptsächlich nach der zweiten Dosis aufgetreten.[183] Die amerikanische Gesundheitsbehörde CDC sah daraufhin keinen Zusammenhang zwischen der Impfung und Herzmuskelentzündungen,[184] gab aber Ende Mai 2021 an, solche Fälle ebenfalls zu prüfen.[185] In einer sehr großen israelischen Studie wurde das Erkrankungsrisiko auf etwa 2,7 Fälle pro 100.000 Geimpfte berechnet; dieses ist nach einer SARS-CoV-2-Infektion allerdings höher (11,0 Fälle pro 100.000 erkrankte Personen).[186]
Im August 2021 wurden vom Paul-Ehrlich-Institut Informationen bekannt gegeben über die bis Ende Juli beobachteten Nebenwirkungen bei Kindern und Jugendlichen von 12 bis 17 Jahren. Bei 1,3 Millionen in dieser Altersgruppe bis dahin verabreichten Impfdosen kam es in 24 Fällen zu einer Herzmuskelentzündung, davon 22 männliche und 2 weibliche Jugendliche. Bei 7 weiblichen Jugendlichen kam es zu einer anaphylaktischen Reaktion und in 6 weiteren Fällen wurde über Krampfanfälle berichtet.[187]
Kommerzielles
Lizenzfragen
Die Firma CureVac hat im Februar 2021 für den Impfstoff Comirnaty von Biontech Schutzrechte bzw. deren Verlängerung beantragt.[188] In einem Zwischenbescheid vom 8. April 2021 erklärte das Deutsche Patent- und Markenamt jedoch: „Die Prüfung des Antrages auf Erteilung eines ergänzenden Schutzzertifikats … hat zur vorläufigen Beurteilung geführt, dass die Bedingungen für die Erteilung … nicht erfüllt sind, da das beantragte Erzeugnis „Comirnaty – COVID-19-mRNA Impfstoff (Nukleosidmodifiziert)“ nicht durch das in Kraft befindliche Grundpatent EP 1 857 122 B1 … geschützt wird.“[189]
Bestellungen
Die Europäische Union bestellte mit Vertrag vom 11. November 2020[190] insgesamt 200 Millionen Dosen, die im Falle einer Zulassung ab Ende 2020 bereitgestellt werden sollten. Damit verbunden war eine Option über weitere 100 Millionen Dosen.[191] Die Option wurde Ende Dezember 2020 gezogen.[190] Deutschland erklärte sich dabei bereit, 64 Millionen Dosen abzunehmen.[192] Insgesamt sei Deutschland laut Bundeskanzlerin Angela Merkel bereit gewesen, auch 100 oder 200 Millionen Dosen abzunehmen, falls andere Mitgliedsstaaten diese nicht wollten.[193] Am 17. Februar 2021 wurde eine Bestellung über weitere 200 Millionen Dosen, verbunden mit einer Option über weitere 100 Millionen Dosen, bekanntgegeben. Damit sind insgesamt 500 Millionen Dosen bestellt, die bis Ende 2021 ausgeliefert werden sollen, weitere 100 Millionen optional.[194] Diese Option wurde Mitte April 2021 gezogen, insgesamt sind nunmehr 600 Millionen Dosen zu liefern.[195] Am 8. Mai 2021 gab die EU-Kommission bekannt, 900 Millionen weitere Dosen bestellt zu haben, die bis 2023 geliefert werden sollen. Darüber hinaus besteht eine Option auf weitere 900 Millionen Dosen. Vorgesehen sind Impfungen für Kinder, Auffrischungen für Erwachsene sowie etwaige Anpassungen an Virusvarianten. Der Kaufpreis soll bei unter 20 Euro je Dosis liegen.[196] Im Anschluss an eine Förderzusage des deutschen Bundesforschungsministeriums war bereits im Herbst 2020 eine nationale Option über 30 Millionen Impfdosen vereinbart worden.[197]
Die Vereinigten Staaten hatten zunächst 100 Millionen Dosen für 1,95 Mrd. US-Dollar bestellt (= 19,50 US-Dollar je Dosis.[198]), verbunden mit der Möglichkeit, weitere 500 Millionen Dosen zu erwerben.[199] Am 23. Dezember 2020 wurde eine zweite Vereinbarung über weitere 100 Millionen Dosen bekannt.[200] Mitte Februar 2021 wurden weitere 100 Millionen Dosen bestellt.[198]
Israel bestellte im November 2020 8 Millionen Dosen. Das Land habe dabei mit 28 US-Dollar je Dosis einen deutlich höheren Preis als die Vereinigten Staaten (19,50 US-Dollar) und die EU (15,50 Euro) bezahlt.[201][202]
Am 28. April 2021 berichtete die New York Times von Verhandlungen zwischen EU-Kommissionspräsidentin Ursula von der Leyen und dem Pfizer-CEO Albert Bourla.[203]
Am 20. Mai 2021 machte die EU-Kommission den Kauf von 900 Millionen Dosen publik, lieferbar im Zeitraum Ende 2021 bis 2023. Der Vertrag enthält die Option, in diesem Zeitraum weitere 900 Millionen Dosen zu bestellen.[204]
Die EU-Kommission hat (Stand 9. Dezember 2021) den Kaufpreis nicht bekanntgegeben; Frau Von der Leyen antwortet dezidiert nicht auf Fragen, ob und was sie mit Pfizer-CEO Bourla verhandelt hat.[205] Laut einer Investigativrecherche der Financial Times hält Pfizer streng geheim, wie es Preise für seine Impfstoffe festlegt und welche Länder bei der Lieferung bevorzugt werden.[206]
Produktion
Der Impfstoff wird von Pfizer in drei Werken in den Vereinigten Staaten (vorrangig[198] in Kalamazoo, daneben in Andover und St. Louis) sowie im belgischen Puurs produziert.[207] Die Dosen für Europa werden an den beiden Biontech-Standorten in Deutschland (Mainz und Idar-Oberstein) sowie in Puurs produziert.[208][207][209][210] Der Wirkstoff wird in Puurs gereinigt, stabilisiert und abgefüllt.[210]
Weitere an der Produktion beteiligte Unternehmen sind Dermapharm,[211] Siegfried,[212] Polymun,[213] Rentschler,[214] und Baxter. Insgesamt unterstützen 30 Partnerfirmen die Produktion.[215]
Mit Begleitung des Bundesgesundheitsministeriums[216] erwarb Biontech für den Ausbau der Herstellungskapazität im September 2020 das Novartis-Werk am Behring-Standort in Marburg, in dem seit März 2021 die Produktion aufgenommen wurde.[217][208] Am 28. Januar 2021 erteilte das Regierungspräsidium Darmstadt die arzneimittelrechtliche Herstellungserlaubnis.[218] Der erste Herstellungsschritt, die Produktion der mRNA, wurde Anfang Februar 2021 aufgenommen. Anschließend sollen Reinigung und Konzentration der mRNA erfolgen sowie Lipide gebildet werden.[219] Damit erfolgen in Marburg drei der vier notwendigen Herstellungsschritte des Impfstoffs.[218] Bevor erste Chargen des Wirkstoffs zur Abfüllung und Fertigstellung an einen anderen Standort verbracht werden können, musste eine Zulassung durch die EMA abgeschlossen werden.[219] Diese erfolgte Ende März 2021. Damit konnten erste Chargen an andere Standorte zur Abfüllung verbracht werden.[220] Mit der Auslieferung erster in Marburg hergestellter Impfstoffe rechnete Biontech zunächst für Anfang April 2021, später für die 2. Aprilhälfte.[219][39] In dem Werk sollen im 1. Halbjahr 2021 bis zu 250 Millionen Dosen hergestellt werden, jährlich waren zunächst bis zu 750 Millionen Dosen geplant, inzwischen eine Milliarde.[207][219][220] Der Standort soll vor allen Dingen den europäischen Markt bedienen.[192] Die Kapazität des Werks ist bereits in die Planung der EU-Lieferungen für 2021 einbezogen.[221]
Nach eigenen Angaben hat Biontech bereits während der klinischen Prüfung die Produktionskapazitäten zur Herstellung von mehr als einer Milliarde Dosen aufgestockt und bis Ende 2020 fünf europäische Hersteller beauftragt, die Produktion zu unterstützen.[48] So ist Dermapharm mit der Formulierung, Abfüllung und Verpackung beauftragt.[222] Seit Oktober 2020 erfolgt dies in Brehna (bei Leipzig)[223] und seit Mai 2021 in Reinbek (bei Hamburg).[224]
Das französische Pharmaunternehmen Sanofi gab am 26. Januar 2021 eine Vereinbarung mit Biontech und Pfizer bekannt, bis Ende des Jahres 2021 mehr als 125 Millionen Dosen des Impfstoffs herzustellen. Die in einem Werk in Frankfurt produzierten Impfdosen seien alle für die Europäische Union bestimmt.[225][226] In dem Werk soll fertiger Impfstoff abgefüllt werden.[221]
Biontech und Pfizer gehen laut eigenen Angaben von Ende März 2021 davon aus, die Produktionskapazität bis Ende 2021 auf bis zu 2,5 Milliarden Dosen erhöhen zu können.[39] Laut Angaben von Biontech seien zur Produktion des Impfstoffs 50.000 Schritte erforderlich.[220]
Auslieferung
Bis 23. März 2021 waren weltweit insgesamt mehr als 200 Millionen Dosen in mehr als 65 Länder und Regionen ausgeliefert worden. Bis Ende 2021 sollen mehr als 1,4 Milliarden bestellte Dosen ausgeliefert werden.[39]
2020 sollten weltweit bis zu 50 Millionen Impfstoff-Dosen bereitgestellt werden.[59] Am 14. Dezember 2020 wurden zunächst 2,9 Millionen Dosen USA-weit verteilt. Drei Wochen später sollte die gleiche Zahl für die Zweitimpfung ausgeliefert werden.[227] 12,5 Millionen Dosen sollten dabei an EU-Staaten ausgeliefert werden, davon 1,3 Millionen nach Deutschland.[228] Die deutschen Bundesländer haben nach Angaben des Bundes am 26., 28. und 30. Dezember 2020 insgesamt 1,34 Millionen Dosen direkt vom Hersteller erhalten.[192]
Für 2021 wurde im November 2020 noch mit bis zu 1,3 Milliarden Dosen gerechnet.[229] Mitte Januar 2021 wurde dieser Wert auf 2,0 Milliarden Dosen angehoben, wobei die zwischenzeitlich genehmigte Entnahme von sechs Dosen je Injektionsfläschchen hierin mit einbezogen wurde.[207] Nach dieser Erhöhung kündigten die Hersteller an, zukünftig entsprechend weniger Injektionsfläschchen auszuliefern.[230] Bis 10. Januar 2021 wurden 32,9 Millionen Dosen ausgeliefert.[207]
Die zunächst insgesamt 300 Millionen Dosen für die EU sollen im Laufe des Jahres 2021 geliefert werden.[190] Anfang Januar 2021 gab die EU die Beschaffung von weiteren 300 Millionen Dosen bekannt. Im zweiten Quartal 2021 sollen nach Angaben der EU-Kommission davon 57 Millionen Dosen geliefert werden.[231] Am 1. Februar 2021 kündigte Biontech an, „im zweiten Quartal bis zu 75 Millionen Dosen mehr an die Europäische Union ausliefern“ zu wollen. Laut Medienberichten entspreche dies bis zu 14 Millionen zusätzlichen Impfdosen für Deutschland.[232] Die Europäische Kommission kündigte Mitte März 2021 an, binnen zwei Wochen zusätzliche vier Millionen Dosen für besonders betroffene Regionen bereitzustellen.[233] Kurz darauf wurde die Bereitstellung zusätzlicher zehn Millionen Dosen im 2. Quartal 2021, auf mehr als 200 Millionen Dosen, bekanntgemacht.[234]
Einer Empfehlung ihres Impfkomitees folgend, kündigte die britische Regierung am 30. Dezember 2020 an, zunächst möglichst viele Angehörige der Risikogruppe mit einer ersten Dosis zu impfen. Die zweite Dosis solle bis zu zwölf Wochen später folgen.[235][236]
Die Auslieferung aller 200 Millionen Dosen für die Vereinigten Staaten soll bis 31. Juli 2021 abgeschlossen werden.[200]
Am 15. Januar 2021 gaben Biontech und Pfizer für die Folgewoche (ab 18. Januar) Umstellungen der Produktionsprozesse zur Kapazitätserhöhung im Werk Puurs bekannt. Dadurch solle es „zu einer vorübergehenden Verringerung der Anzahl der ausgelieferten Dosen kommen“. Ab dem 25. Januar wollten die Unternehmen zum ursprünglichen Zeitplan für die Lieferungen zurückkehren und die volle geplante Menge liefern. Ab der Woche vom 15. Februar sollen die Auslieferungen über das bislang geplante Niveau erhöht werden. Im ersten Quartal soll die zugesagte Menge an Impfstoffdosen geliefert werden, im zweiten Quartal „deutlich mehr“.[237] Für Deutschland sicherte Biontech die für den 18. und 19. Januar geplanten Liefermengen an die Bundesländer zu. Reduzierte Liefermengen würden laut Bundesgesundheitsministerium insbesondere in den beiden Folgewochen erwartet.[238] In der Woche ab dem 25. Januar 2021 wurden 489.060 Dosen (bei sechs Dosen je Injektionsfläschchen[239]) geliefert.[240] Zuvor angekündigt waren 667.875 (5 je Injektionsfläschchen) bzw. 801.450 Dosen (6 je Injektionsfläschchen).[239] Laut einer Herstellerinformation vom 1. Februar wurden die Umstellungen im Werk Puurs abgeschlossen.[241]
Nach Österreich sollen laut Angaben von Ende Januar 2021 im 1. Quartal insgesamt 1,1 Millionen Dosen geliefert werden. Zuvor waren 900.000 Dosen geplant gewesen. Im Gesamtjahr 2021 sollen 11,1 Millionen Dosen geliefert werden.[242]
Die Auslieferung nach Israel begann am 9. Dezember 2020 mit der Auslieferung der ersten rund 4000 Dosen. Der deutlich höhere Preis und die Bereitstellung von Impfdaten an den Hersteller wird als Grund dafür gesehen, dass Israel schnell vergleichsweise viel Impfstoff geliefert wurde. Die Bereitstellung des Impfstoffs erfolgt größtenteils aus den europäischen Werken.[210]
Deutschland
Um den Jahreswechsel 2020/2021 rechnete das Bundesgesundheitsministerium mit fast 700.000 Dosen pro Woche im Januar 2021, nach konservativer Einschätzung zwischen 11 und 13 Millionen bis zum Ende des ersten Quartals.[243][244][216] Für das 1. Quartal 2021 waren insgesamt 9 Millionen Dosen vorgesehen, weitere 25 Millionen im 2. Quartal, 40 Millionen im 3. Quartal sowie weitere 25 Millionen im 4. Quartal 2021.[245] Zwischen 26. Dezember 2020 und 1. Februar 2021 sollten 3,98 Millionen Dosen geliefert werden.[246]
Nachdem kritisiert wurde, dass in der Woche vom 4. bis zum 10. Januar 2021 keine Lieferung vorgesehen war, wurde die ursprünglich für den 11. Januar geplante Lieferung auf den 8. Januar vorgezogen.[247][248] Seit der 3. Kalenderwoche sind 6 statt 5 Dosen je Vial unterstellt, die geplanten Liefermengen dadurch erhöht.[249]
Bis 2. Februar wurden insgesamt 4,1 Mio. Dosen ausgeliefert.[240] Nach Planungen von Anfang Februar sollten Anfang März 924.300 Dosen geliefert werden, in den vier übrigen Märzwochen jeweils rund eine Million, im ersten Quartal insgesamt 11,6 Millionen Dosen.[250] Anfang März waren im März erwarteten Mengen nochmals gestiegen (1.012.500 Dosen am 1./2. März, 1.076.400 Dosen zu den Folgeterminen), bis 1. April nunmehr insgesamt 11,989 Millionen Dosen.[251] Die Mengen standen laut Hersteller unter dem Vorbehalt der Freigabe sowie teils erst kurz vor Produktionsbeginn geplanter Rohstofflieferungen.[250] In der am 29. März beginnenden Kalenderwoche 13 wurden insgesamt 351.000 zusätzliche Dosen für sechs Bundesländer erwartet.[252] Bis zum 6. April 2021 wurden insgesamt 12,7 Millionen Dosen an die Länder geliefert.[253]
Für April 2021 werden nach Angaben von Mitte März „gute neun Millionen Dosen“ erwartet.[254] Vorgesehen waren rund 2,5 Millionen Dosen pro Woche.[255][256][257][258] Bis Ende April wurden 19,1 Millionen Dosen an die Bundesländer ausgeliefert.[259] In den ersten beiden Mai-Wochen folgten jeweils 1,8 Millionen Dosen. Diese Menge soll auch in den beiden Folgewochen geliefert werden.[260] Die seit Anfang April in die Impfkampagne einbezogenen Hausärzte werden nicht separat, über den Großhandel statt der Länder, beliefert.
Nach Angaben vom 4. März wurden für das 1. Quartal 2021 10,7 Millionen Dosen erwartet, im 2. Quartal 40,2 Millionen, im 3. Quartal 34,7 Millionen sowie im 4. Quartal 13,5 Millionen.[261] Nach Angaben vom 22. März werden im 2. Quartal weiterhin 40,2 Millionen Dosen erwartet, bis Ende 2021 insgesamt 100,7 Millionen.[262]
Mit Beginn der Impfungen bei Hausärzten, Anfang April 2021, wird ultratiefgekühlter Impfstoff direkt von Biontech an den Großhandel geliefert, wo er zwischengelagert, aufgetaut und bei 2 bis 8 Grad gekühlt an Apotheken ausgeliefert wird. Für die geplante erste Auslieferung an Apotheken gingen die ersten Bestellungen beim Großhandel am 30. März 2021 ein und übertrafen die verfügbare Menge um circa 60 Prozent. Die ersten Dosen sollten am 6. April 2021 an die Apotheken ausgeliefert werden. Großhändler erhalten Gebinde zu 975 Fläschchen, die von ihnen vereinzelt und an die Apotheken zunächst mit 2 und 15 Fläschchen geliefert werden.[263] In der ersten Aprilhälfte soll in Hausarztpraxen ausschließlich Tozinameran verimpft werden, da nur von diesem Impfstoff ausreichend zur Verfügung steht, um alle Arztpraxen damit zu beliefern. In der zweiten Monatshälfte soll neben Tozinameran auch mit weiteren Impfstoffen geimpft werden.[264]
Bis Ende April wurden 19,1 Millionen Dosen an die Länder geliefert.[259] Im Mai folgten weitere 7,2 Millionen.[265] Separat davon wurden bis Ende Mai Arztpraxen mit 10,8 Millionen Dosen beliefert.[266]
War Mitte Mai noch geplant, im Juni an Hausärzte und Betriebsärzte pro Woche insgesamt rund 3,4 bis 3,7 Millionen Dosen zu liefern, wurde diese Menge für die ersten beiden Juni-Wochen auf 2,2 bzw. 3,3 Millionen Dosen reduziert.[267][265]
Insgesamt sollen nach 5,1 Millionen Dosen in der ersten Juni-Woche in den beiden Folgewochen nur noch 4,6 bzw. 4,0 Millionen Dosen geliefert werden, in den beiden letzten Juni-Wochen hingegen jeweils 6,0 Millionen.[268] Im Juni, Juli und August 2021 werden insgesamt 50 Millionen Dosen erwartet.[269] Nach einer am 22. Juni 2021 vorgelegten Prognose werden im 2. Quartal 50,3 Millionen Dosen erwartet, die Prognose für das 3. Quartal lag bei 40,2 Millionen Dosen, für das 4. Quartal bei 27,1 Millionen.[270]
Verimpfung
.jpg.webp)
In Deutschland wurden bis einschließlich 16. Januar 2022 insgesamt 116 Millionen Dosen Tozinameran verimpft.[271] Der Bund geht davon aus, dass in der Regel sechs Dosen je Injektionsfläschchen entnommen werden, gelegentlich auch sieben.[272]
Die Verteilung des Impfstoffes unterliegt der Priorisierung der COVID-19-Impfmaßnahmen.
Handelsname
Der Handelsname Comirnaty – laut Biontech eine Kombination aus den Begriffen „COVID-19“, „mRNA“, „Community“ und „Immunity“ – wurde anlässlich der erstmaligen Zulassung eines mRNA-Impfstoffes gewählt.[208][273]
Nachfolge-Impfstoff
Bei Biontech hat man im Juni 2021 noch keinen Bedarf an einer Anpassung des Impfstoffs gesehen;[274] aufgrund der neuen Erkenntnisse über die geringere Wirkung gegenüber der Delta-Variante hat man aber bereits im Juli eine Anpassung des Impfstoffs an diese Variante entwickelt und im August 2021 mit der klinischen Erprobung dieses Impfstoffs zu begonnen.[275]
Klinische Studien zu einem an die Omikron-Variante angepassten Impfstoff haben Ende Januar 2022 begonnen[276], parallel sei laut Aussage des Herstellers mit der Produktion begonnen worden.
Literatur
- Joe Miller, Uğur Şahin, Özlem Türeci: Projekt Lightspeed: Der Weg zum BioNTech-Impfstoff – und zu einer Medizin von morgen. 1. Auflage. Rowohlt Verlag, Hamburg 2021, ISBN 978-3-498-00277-0, S. 352.[277]
Weblinks
- Comirnaty COVID-19 mRNA vaccine (nucleoside-modified). In: EMA-Website/Medicines. European Medicines Agency (EMA), abgerufen am 29. Oktober 2021 (Enthält einen Überblick darüber wie Comirnaty wirkt, es angewendet wird und warum es zugelassen wurde sowie die Produktinformation in allen EU/EWR-Sprachen; ferner häufig gestellte Fragen (FAQ), Zulassungsdetails, die Begutachtungshistorie und aktuelle Sicherheitsinformationen (auf Englisch).).
- Theo Dingermann: Produkteigenschaften – Mehr Details zum Biontech-Impfstoff. In: Pharmazeutische Zeitung (PZ). 8. Dezember 2020, abgerufen am 21. November 2021 (Ab 8. Dezember wird der COVID-19-Impfstoff von Biontech/Pfizer in Großbritannien verimpft. Damit ist für Fachkreise auch die Summary of Product Characteristics (SmPC) verfügbar. →Quelle: ebenda).
- EU Clinical Trials Register: A phase 1/2/3, placebo-controlled, randomized, observer-blind, dose-finding study to evaluate the safety, tolerability, immunogenicity, and efficacy of sars-cov-2 rna vaccine candidates against covid-19 in healthy individuals (englisch)
- Mark J. Mulligan, Kirsten E. Lyke, Nicholas Kitchin et al.: Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. (PDF-Datei, englisch) Nature 586, S. 589–593 vom 22. Oktober 2020 doi:10.1038/s41586-020-2639-4
- Vaccines and Related Biological Products Advisory Committee Meeting: FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine (englisch) vom 10. Dezember 2020
- Antonio Regalado: What are the ingredients of Pfizer’s covid-19 vaccine? im MIT Technology Review des Massachusetts Institute of Technology vom 9. Dezember 2020
- Medicines and Healthcare products Regulatory Agency: Regulatory approval of Pfizer / Biontech vaccine for COVID-19. Information for healthcare professionals and the public about the Pfizer/Biontech vaccine (englisch)
- Theresa Schredelseker: Wer oder was ist eigentlich Comirnaty? Oder Tozinameran? (Wissenschaftsblock). In: Private Website der Autorin. 5. Januar 2021, abgerufen am 21. November 2021.
- Der Impfstoff Comirnaty (Biontech / Pfizer) zur Corona-Impfung für Kinder und Jugendliche. (Aktualisiert am 30. Oktober 2021). In: Website: »Covid-19 (Coronavirus-Krankheit)«. Hrsg.: Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), 30. Oktober 2021, abgerufen am 23. November 2021 (Der Impfstoff Comirnaty (Biontech/Pfizer) ist seit Ende Mai 2021 auch für Kinder und Jugendliche zwischen 12 und 15 Jahren zugelassen. Seit dem 16. August 2021 empfiehlt die STIKO di Impfung allen Kindern und Jugendlichen zwischen 12 und 17 Jahren; vorher galt die Impfempfehlung nur für bestimmte Risikogruppen. Für Jugendliche ab 16 Jahren und Erwachsene ist der Impfstoff Comirnaty seit Dezember 2020 zugelassen. Derzeit prüft die EMA, ob der Impfstoff Comirnaty bereits für Kinder ab 5 Jahren geeignet ist.).
- Statistiken
- Deutschland: Verimpfte Dosen nach Hersteller auf www.statista.com
- Deutschland: Bestellte Dosen nach Hersteller auf www.statista.com
- Deutschland: Zugesagte Dosen nach Hersteller auf www.statista.com
Einzelnachweise
- Recommended INN: List 85, S. 259, abgerufen am 7. Mai 2021.
- FDA NEWS RELEASE: FDA Approves First COVID-19 Vaccine Approval. (Signifies Key Achievement for Public Health). In: Press Announcements. U.S. Food and Drug Administration (FDA), 23. August 2021, abgerufen am 24. August 2021.
- Celine Müller: EMA empfiehlt die Zulassung des ersten Corona-Impfstoffs in der EU. 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- Impressum der Firma.
- Christian Papadopoulos: So entstand der Corona-Impfstoff von Biontech. Abgerufen am 17. April 2021.
- T. Dingermann: Wer steht wo bei der Entwicklung?, pharmazeutische-zeitung.de, 6. Juli 2020.
- Sie sind BioNTech und haben den Impfstoff entwickelt: Uğur Şahin (55) und Özlem Türeci (53), euronews.com, 11. November 2020.
- Auch Fosun half beim Impfstoff mit – Das China-Syndrom: Warum Biontechs Partner aus Fernost so oft unerwähnt bleibt. In: focus.de. 30. Dezember 2020, abgerufen am 8. Januar 2021.
- PR Newswire: Entwicklung des Markennamens COMIRNATY. Abgerufen am 28. Juni 2021.
- Produktion der Partikel
- Eric J. Rubin, Dan L. Longo: SARS-CoV-2 Vaccination — An Ounce (Actually, Much Less) of Prevention. In: New England Journal of Medicine. 10. Dezember 2020, ISSN 0028-4793, doi:10.1056/NEJMe2034717, PMID 33301245, PMC 7745179 (freier Volltext).
- UK medicines regulator gives approval for first UK COVID-19 vaccine. Medicines and Healthcare products Regulatory Agency (MHRA), 2. Dezember 2020, abgerufen am 2. Dezember 2020.
- Sarah Boseley, Josh Halliday: UK approves Pfizer/BioNTech Covid vaccine for rollout next week. In: The Guardian. 2. Dezember 2020, abgerufen am 14. Dezember 2020 (englisch).
- Swissmedic autorise un premier vaccin contre le coronavirus. In: letemps.ch. 19. Dezember 2020, abgerufen am 19. Dezember 2020.
- WHO issues its first emergency use validation for a COVID-19 vaccine and emphasizes need for equitable global access. In: who.int. Weltgesundheitsorganisation, 31. Dezember 2020, abgerufen am 1. Januar 2021 (englisch).
- COVID-19 mRNA Vaccine (nucleoside modified) COMIRNATY®. (PDF) In: who.int. Weltgesundheitsorganisation, 31. Dezember 2020, abgerufen am 1. Januar 2021 (englisch).
- Galenus-Gewinner – Primary Care, Ärztezeitung vom 21. Oktober 2021, abgerufen am 22. Oktober 2021
- GenBank (Hrsg.): Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete genome. 2020 (nih.gov).
- A dynamic nomenclature proposal for SARS-CoV-2 lineages to assist genomic epidemiology. In: ncbi.nlm.nih.gov. 15. Juli 2020, abgerufen am 25. Juli 2021: „Different nucleotides are present at those sites in viruses assigned to lineage B, of which Wuhan-Hu-1 (GenBank accession MN908947) sampled on 2019-12-26 is an early representative.“
- Variant constraint by mRNA vaccines. In: ncbi.nlm.nih.gov. 9. April 2021, abgerufen am 25. Juli 2021: „The two mRNA vaccines that have received emergency use authorizations — BNT162b2 (Pfizer/BioNTech) and mRNA-1273 (Moderna) — encode a stabilized ectodomain version of the spike (S) protein from the Wuhan-Hu-1 variant of SARS-CoV-2 (isolated in 2019).“
- Edward E. Walsh, Robert W. Frenck, Ann R. Falsey, Nicholas Kitchin, Judith Absalon: Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. In: New England Journal of Medicine. Band 383, Nr. 25, 17. Dezember 2020, ISSN 0028-4793, S. 2439–2450, doi:10.1056/NEJMoa2027906, PMID 33053279, PMC 7583697 (freier Volltext).
- I. Freund et al.: RNA Modifications Modulate Activation of Innate Toll-Like Receptors. In: Genes. Band 10, 1. Januar 2019, doi:10.3390/genes10020092.
- Thomas Ostendorf, Thomas Zillinger, Katarzyna Andryka, Thais Marina Schlee-Guimaraes, Saskia Schmitz: Immune Sensing of Synthetic, Bacterial, and Protozoan RNA by Toll-like Receptor 8 Requires Coordinated Processing by RNase T2 and RNase 2. In: Immunity. Band 52, Nr. 4, April 2020, S. 591–605.e6, doi:10.1016/j.immuni.2020.03.009.
- Fachinformation und Packungsbeilage. In: EMA. Abgerufen am 28. Oktober 2021.
- Theo Dingermann: Produkteigenschaften – Mehr Details zum Biontech-Impfstoff. In: Pharmazeutische Zeitung (PZ). 8. Dezember 2020, abgerufen am 21. November 2021 (Ab 8. Dezember wird der COVID-19-Impfstoff von Biontech/Pfizer in Großbritannien verimpft. Damit ist für Fachkreise auch die Summary of Product Characteristics (SmPC) verfügbar. →Quelle: ebenda).
- What are the ingredients of Pfizer’s covid-19 vaccine? In: technologyreview.com. 9. Dezember 2020, abgerufen am 25. Juli 2021.
- Alle Inhaltsstoffe: Was im Biontech-Impfstoff drin ist. In: heute.at. 14. Dezember 2020, abgerufen am 25. Juli 2021.
- Linde Schoenmaker et al.: mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. In: International Journal of Pharmaceutics. Band 601, 15. Mai 2021, S. 120586, doi:10.1016/j.ijpharm.2021.120586.
- Verfahrensanweisung zur Rekonstitution (BioNTech Impfstoff). (PDF) In: aknr.de. 16. Dezember 2020, abgerufen am 25. Juli 2021.
- COMIRNATY. (PDF) European Medicines Agency, abgerufen am 13. November 2021.
- New manufacturing sites and new formulation approved for COVID-19 vaccine from BioNTech/Pfizer. European Medicines Agency, 18. Oktober 2021, abgerufen am 20. Oktober 2021 (englisch).
- Design und Funktionsweise von mRNA-basierten Impfstoffen zum Schutz vor Infektionskrankheiten, Trillium Immunologie, Heft 3/2019.
- FDA Briefing Document Pfizer-BioNTech COVID-19 Vaccine, Vaccines and Related Biological Products Advisory Committee Meeting December 10, 2020, FDA. Abgerufen am 9. Dezember 2020.
- Doch keine Rekonstitution in Apotheke, DAZ, 3. Dezember 2020.
- Wichtige Mitteilung – Comirnaty Konzentrat zur Herstellung einer Injektionsdispersion Verlängerung der Haltbarkeit bei Ultratiefkühlung. Swissmedic, 21. September 2021, abgerufen am 28. September 2021.
- Pfizer und BioNTech reichen Stabilitätsdaten zur Lagerung des COVID-19-Impfstoffs bei Standard-Gefriertemperaturen bei der U.S.-amerikanischen FDA ein. In: investors.biontech.de. Biontech, Pfizer, 19. Februar 2021, abgerufen am 21. Februar 2021.
- Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine, FDA, 25. Februar 2021. Abgerufen am 26. Februar 2021.
- EMA genehmigt neue Lagerungsbedingungen für Pfizer-BioNTech-Impfstoff zur einfacheren Verteilung und Aufbewahrung innerhalb der Europäischen Union. In: investors.biontech.de. Biontech, 26. März 2021, abgerufen am 3. April 2021.
- BioNTech veröffentlicht Ergebnisse des Geschäftsjahres 2020 und Informationen zur Geschäftsentwicklung. In: investors.biontech.de. Biontech, 30. März 2021, abgerufen am 3. April 2021.
- Swissmedic genehmigt neue Lagerbedingungen für den Covid-19 Impfstoff von Pfizer/BioNtech. In: swissmedic.ch. 30. März 2021, abgerufen am 10. April 2021.
- Anhang I: Zusammenfassung der Merkmale des Arneimittels. (PDF) (Nicht mehr online verfügbar.) In: ema.europa.eu. European Medicines Agency (EMA), 20. April 2021, S. 11, archiviert vom Original am 12. Mai 2021; abgerufen am 5. Juni 2021 (Enthält genaue Angaben zur Zusammensetzung und eine Packungsbeilage).
- Biontech-Impfstoff künftig einfacher einsetzbar. In: donaukurier.de. 16. Januar 2020, abgerufen am 16. Januar 2020.
- Europäische Arneizmittel-Agentur (Hrsg.): Product Information. 8. Januar 2021.
- Diana Moll: EMA: Comirnaty können sechs Dosen entnommen werden. In: deutsche-apotheker-zeitung.de. 8. Januar 2021, abgerufen am 21. Januar 2021.
- NRW: Aus Comirnaty kann auch siebte Dosis genutzt werden. DAZ.online (Deutsche Apotheiker-Zeitung), 11. Februar 2021.
- Jan Dörner: Wohin mit dem kostbaren Rest in Impfstoff-Ampullen? In: Stuttgarter Nachrichten. Band 75, 29. Dezember 2020 (online).
- Erste Corona-Impfungen: 13 Stolpersteine, DocCheck, 8. Januar 2021. Abgerufen am 11. Januar 2021.
- Steffen Klusmann, Thomas Schulz: »Wir wurden gefragt, warum denn aus Mainz etwas Großes kommen soll«. In: Der Spiegel. Nr. 1, 2021, S. 8–16 (online).
- Coronavirus: Deutschland startet erste klinische Prüfung von Impfstoff. In: spiegel.de. 22. April 2020, abgerufen am 22. April 2020.
- Impfstoffe gegen Coronavirus – Der aktuelle Forschungsstand – vfa. Verband Forschender Arzneimittelhersteller, 17. März 2020.
- Bert Fröndhoff: Deutsche Biotechfirma macht Fortschritte bei der Entwicklung eines Corona-Impfstoffs. In: handelsblatt.com. 16. März 2020, abgerufen am 16. März 2020.
- Erste Studie zu Corona-Impfstoff in Deutschland läuft an. In: hessenschau de. 22. April 2020, abgerufen am 3. Dezember 2020.
- Pfizer und BioNTech schließen Phase-3-Studie erfolgreich ab: Impfstoffkandidat gegen COVID-19 erreicht alle primären Endpunkte. 18. November 2020, abgerufen am 29. Dezember 2020.
- Fernando P. Polack et al.: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. In: The New England Journal of Medicine. Dezember 2020, doi:10.1056/NEJMoa2034577.
- EMA Assessment Report. (PDF) In: ema.europa.eu. 21. Dezember 2020, S. 82, 97, abgerufen am 31. Januar 2021.
- Pfizer und BioNTech veröffentlichen weitere Daten aus Phase-3-Studie: Bis zu 6 Monate nach zweiter Impfung hohe Wirksamkeit und keine schweren Sicherheitsbedenken des COVID-19-Impfstoffs bestätigt. In: investors.biontech.de. Biontech, 1. April 2021, abgerufen am 3. April 2021.
- Pfizer and BioNTech Share Positive Early Data on Lead mRNA Vaccine Candidate BNT162b2 Against COVID-19. In: www.pfizer.com. 20. August 2020, abgerufen am 19. November 2020.
- Wolfgang Geissel: Phase-III-Studie zu Corona-Impfstoffe BNT162b2 jetzt publiziert. In: aerztezeitung.de. Abgerufen am 24. Dezember 2020.
- Pfizer and BioNTech Conclude Phase 3 Study of COVID-19 Vaccine Candidate, Meeting All Primary Efficacy Endpoints. 18. November 2020, abgerufen am 18. November 2020 (englisch).
- Volkart Wildermuth: Kritik am Subunternehmen Ventavia - Vorwürfe gegen Impfstoffstudie von Biontech/Pfizer. In: Deutschlandfunk. 4. November 2021, abgerufen am 7. November 2021.
- Paul D. Thacker: Covid-19: Researcher blows the whistle on data integrity issues in Pfizer’s vaccine trial. In: British Medical Association (Hrsg.): The BMJ. Band 375, Nr. 2635, 2. November 2021, ISSN 0959-8138, doi:10.1136/bmj.n2635 (englisch, bmj.com [PDF; 571 kB; abgerufen am 4. November 2021]).
- Peter Doshi: Pfizer and Moderna’s “95% effective” vaccines—we need more details and the raw data. In: BMJ Opinion. The BMJ, 4. Januar 2021, abgerufen am 4. November 2021 (englisch).
- Pfizer-Subunternehmen: Bericht über Unregelmäßigkeiten bei Impfstoff-Zulassungsstudie. In: spiegel.de. 3. November 2021, abgerufen am 5. November 2021.
- Covid-19 : un laboratoire accusé d'avoir mal mené des essais sur le vaccin Pfizer. In: lefigaro.fr. 3. November 2021, abgerufen am 5. November 2021.
- Der Regionalsender interviewte auch den Autor der Berichts, Paul D. Thacker (en).
- Fact check: Report questioning Pfizer trial shouldn’t undermine confidence in vaccines. In: cbs17.com. 3. November 2021, abgerufen am 5. November 2021: „A report in a medical journal is raising questions about the results from one research company that helped with Pfizer’s trials for its COVID-19 vaccine. But should it make you any less confident in the vaccines themselves? Short answer: No.“
(Die Seite hat einen Regionalfilter, mit Hilfe von Google-Webcache bzw. eines Proxys kann man die Webseite aber erreichen.) - Asaf Ronel: Pfizer COVID Vaccines Delivering Promised Rate of Protection, Israeli Data Shows. In: haaretz.com. 6. Februar 2021, abgerufen am 9. Februar 2021 (englisch).
- Hilla De-Leon, Ronit Calderon-Margalit et al.: First indication of the effect of COVID-19 vaccinations on the course of the COVID-19 outbreak in Israel. (PDF) In: researchgate.net. Februar 2021, abgerufen am 9. Februar 2021 (englisch, Preprint).
- Sharon Amit, Gili Regev-Yochay, Arnon Afek, Yitshak Kreiss, Eyal Leshem: Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients. In: thelancet.com. 18. Februar 2021, abgerufen am 21. Februar 2021 (englisch).
- Israeli Health Ministry: Pfizer vaccine close to 99 percent effective. In: jns.org. 21. Februar 2021, abgerufen am 21. Februar 2021 (englisch, Die Daten sind bislang (Stand: 21. Februar) offenbar noch nicht öffentlich verfügbar.).
- Samuel Lovett: Pfizer vaccine ‘highly effective’ in reducing coronavirus transmission, study suggests. In: independent.co.uk. 21. Februar 2021, abgerufen am 21. Februar 2021 (englisch, Die Daten sind bislang (Stand: 21. Februar) offenbar noch nicht öffentlich verfügbar.).
- Victoria Hall et al.: COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study. The Lancet, 23. April 2021, doi:10.1016/S0140-6736(21)00790-X
- Chris Robertson, Aziz Sheikh et al.: Interim findings from first-dose mass COVID-19 vaccination roll-out and COVID-19 hospital admissions in Scotland: a national prospective cohort study. The Lancet, 23. April 2021, doi:10.1016/S0140-6736(21)00677-2
- Wie wirksam sind die mRNA-COVID-19-Impfstoffe? In: RKI->Startseite->Infektionsschutz->Impfen->Wirksamkeit. RKI, 5. August 2021, abgerufen am 12. August 2021.
- Coronavirus-Einreiseverordnung – CoronaEinreiseV. (PDF) In: Bundesanzeiger. Bundesministerium für Gesundheit, 12. Mai 2021, S. 3, abgerufen am 12. August 2021 (§ 2 10.a): „ein Nachweis hinsichtlich des Vorliegens einer vollständigen Schutzimpfung gegen das Coronavirus SARS-CoV-2 …, wenn die zugrunde liegende Schutzimpfung mit einem … Impfstoffen erfolgt ist und … seit der letzten erforderlichen Einzelimpfung mindestens 14 Tage vergangen sind.“
- Pfizer-BioNTech-COVID-19-Impfstoff induziert im Zellmodell Antikörper, die Pseudoviren mit dem Spike-Protein der U.K.-SARS-CoV-2-Variante neutralisieren. In: investors.biontech.de. Biontech, 20. Januar 2021, abgerufen am 20. Januar 2021.
- Alona Kuzmina, Yara Khalaila, et al., SARS CoV-2 spike variants exhibit differential infectivity and neutralization resistance to convalescent or post-vaccination sera. In: Cell Host & Microbe. 2021, doi:10.1016/j.chom.2021.03.008.
- Jamie Lopez Bernal, Nick Andrews, Charlotte Gower, Eileen Gallagher, Ruth Simmons: Effectiveness of COVID-19 vaccines against the B.1.617.2 variant. 24. Mai 2021, S. 2021.05.22.21257658, doi:10.1101/2021.05.22.21257658 (medrxiv.org [abgerufen am 31. Dezember 2021]).
- Pfizer and BioNTech Provide Update on Omicron Variant. Pfizer Inc., 8. Dezember 2021, abgerufen am 31. Dezember 2021 (englisch).
- Israel meldet deutlich niedrigere Wirksamkeit von Corona-Impfung, faz.net vom 6. Juli 2021, abgerufen am 24. Juli 2021.
- Daten aus Israel deuten auf geringere Wirksamkeit von Biontech-Impfstoff hin. In: sueddeutsche.de. 23. Juli 2021, abgerufen am 24. Juli 2021.
- Israels Zweifel an Biontech: Charité-Experte Sander warnt vor voreiligen Schlüssen. In: www.rbb24.de. 7. Juli 2021, abgerufen am 21. Juli 2021.
- Schwere Fälle trotz Impfung: Lauterbach warnt wegen Delta vor Lockerung. In: n-tv.de. 7. Juli 2021, abgerufen am 23. Juli 2021.
- Pfizer vaccine less effective against delta variant transmission compared to Moderna, says study. In: chron.com. 11. August 2021, abgerufen am 12. August 2021.
- Impfdurchbrüche: Schützt Moderna besser als Biontech? In: praxisvita.de. 12. August 2021, abgerufen am 13. August 2021.
- Comparison of two highly-effective mRNA vaccines for COVID19 during periods of Alpha and Delta variant prevalence. (PDF) In: medrxiv.org. 9. August 2021, abgerufen am 12. August 2021: „We defined cohorts of vaccinated and unvaccinated individuals from Minnesota (n = 25,589 each) matched on age, sex, race, history of prior SARS-CoV-2 PCR testing, and date of full vaccination.“
- Jabbed adults infected with Delta ‘can match virus levels of unvaccinated’. In: theguardian.com. 19. August 2021, abgerufen am 19. August 2021: „...two doses of the Pfizer/BioNTech vaccine does have about 15 % greater initial effectiveness against new infections, but the protection declines faster compared with two doses of Oxford/AstraZeneca. About four to five months after being fully vaccinated by either vaccine, the protection offered is relatively the same“
- Waning of BNT162b2 Vaccine Protection against SARS-CoV-2 Infection in Qatar. In: nejm.org. 6. Oktober 2021, abgerufen am 12. Oktober 2021: „BNT162b2-induced protection against SARS-COV-2 infection appeared to wane rapidly following its peak after the second dose, but protection against hospitalization and death persisted at a robust level for 6 months after the second dose.“
- Pfizer's Covid immunity protection wanes after 2 months, can drop to 20% after 4 months, studies. In: businessinsider.co.za. 8. Oktober 2021, abgerufen am 12. Oktober 2021.
- Effectiveness of Covid-19 Vaccination Against Risk of Symptomatic Infection, Hospitalization, and Death Up to 9 Months: A Swedish Total-Population Cohort Study. In: papers.ssrn.com. 25. Oktober 2021, abgerufen am 11. November 2021.
- Konfidenzintervall zum 95%-Niveau
- SARS-CoV-2: Längeres Dosierungsintervall verstärkt Antikörperreaktion auf Biontech-Impfstoff. In: aerzteblatt.de. 18. Mai 2021, abgerufen am 24. Juli 2021.
- Extended interval BNT162b2 vaccination enhances peak antibody generation in older people. (PDF) In: medrxiv.org. 17. Mai 2021, abgerufen am 24. Juli 2021.
- Website der PITCH-Studie
- Sustained T cell immunity, protection and boosting using extended dosing intervals of BNT162b2 mRNA vaccine. (PDF) In: pitch-study.org. 23. Juli 2021, abgerufen am 24. Juli 2021.
- ‘The sweet spot’: Pfizer more effective with eight-week gap between doses. In: smh.com.au. 23. Juli 2021, abgerufen am 24. Juli 2021: „Following two vaccine doses, neutralising antibody levels were twice as high after the longer dosing interval compared with the shorter dosing interval.“
- Probandengruppe 18 bis 55 Jahre: geometrisches Mittel des Titers 7 Tage nach der Zweitimpfung: 497 und 8 Monate nach der Zweitimpfung: 83, siehe Seite 26 der Präsentation Second Quarter 2021 Earnings Teleconference. (PDF) In: s21.q4cdn.com. 28. August 2021, abgerufen am 18. August 2021.
- Waning Immune Humoral Response to BNT162b2 Covid-19 Vaccine over 6 Months. In: nejm.org. 6. Oktober 2021, abgerufen am 12. Oktober 2021: „Six months after receipt of the second dose of the BNT162b2 vaccine, humoral response was substantially decreased, especially among men, among persons 65 years of age or older, and among persons with immunosuppression.“
- | Antikörperstudie des PEI
- Pfizer und BioNTech starten globale klinische Studie zur Untersuchung des COVID-19-Impfstoffs in schwangeren Frauen. In: investors.biontech.de. Pfizer, Biontech, 18. Februar 2021, abgerufen am 21. Februar 2021.
- Study to Evaluate the Safety, Tolerability, and Immunogenicity of SARS CoV-2 RNA Vaccine Candidate (BNT162b2) Against COVID-19 in Healthy Pregnant Women 18 Years of Age and Older. In: clinicaltrails.gov. 15. Februar 2021, abgerufen am 21. Februar 2021 (englisch).
- rki.de: Impfung bei Schwangeren, Stillenden und bei Kinderwunsch (Stand: 21. Dezember 2021)
- cdc.gov
- www.gov.uk: New UKHSA study provides more safety data on COVID-19 vaccines in pregnancy (25. November 2021)
- siehe auch Informationen für Schwangere in der Schweiz
- Das Nationale Impfgremium (Österreich) hat am 17. Dezember 2021 die COVID-Booster-Impfung auch für Zwölf- bis 17-Jährige und Schwangere freigegeben.
- Lydia L. Shook, Caroline G. Atyeo, Lael M. Yonker, Alessio Fasano, Kathryn J. Gray: Durability of Anti-Spike Antibodies in Infants After Maternal COVID-19 Vaccination or Natural Infection. In: JAMA. 7. Februar 2022, ISSN 0098-7484, doi:10.1001/jama.2022.1206, PMID 35129576, PMC 8822441 (freier Volltext) – (jamanetwork.com [abgerufen am 19. Februar 2022]).
- EMEA-002861-PIP02-20. Abgerufen am 20. Dezember 2020.
- Paediatric Investigation Plan, EMA. Abgerufen am 19. Dezember 2020.
- Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Individuals, Clinical Trials. Abgerufen am 22. Februar 2021.
- BioNTech und Pfizer geben positive Ergebnisse aus Zulassungsstudie für COVID-19-Impfstoff in Jugendlichen bekannt. In: investors.biontech.de. Biontech, Pfizer, 31. März 2021, abgerufen am 31. März 2021.
- Pfizer und BioNTech stellen Antrag auf Erweiterung der Notfallzulassung ihres COVID-19-Impfstoffs für die Anwendung bei Jugendlichen. In: investors.biontech.de. Biontech, Pfizer, 9. April 2021, abgerufen am 10. April 2021.
- Pfizer and BioNTech Submit Request to Expand Conditional Marketing Authorization of COMIRNATY® in the EU to Adolescents, Presseerklärung des Herstellers, abgerufen am 30. April 2021.
- www.nejm.org: Effectiveness of BNT162b2 Vaccine against Delta Variant in Adolescents
- Pfizer and BioNTech Initiate a Study as Part of Broad Development Plan to Evaluate COVID-19 Booster and New Vaccine Variants, BioNTech, 25. Februar 2021. Abgerufen am 26. Februar 2021.
- https://investors.biontech.de 21. Oktober 2021
- www.nejm.org: Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel
- Pfizer and BioNTech Announce Phase 3 Trial Data Showing High Efficacy of a Booster Dose of Their COVID-19 Vaccine. 21. Oktober 2021, abgerufen am 20. November 2021: „Pfizer and BioNTech plan to submit detailed results from the trial for peer-reviewed publication.“
- UK medicines regulator gives approval for first UK COVID-19 vaccine. In: gov.uk. 2. Dezember 2020, abgerufen am 12. Januar 2021 (englisch).
- Corona-Impfung: Auch Kanada lässt Impfstoff von BioNtech und Pfizer zu. In: zeit.de. 9. Dezember 2020, abgerufen am 10. Dezember 2020.
- Impfstoff – Auch Saudi-Arabien lässt Impfstoff von Biontech und Pfizer zu. Abgerufen am 10. Dezember 2020.
- Erste Corona-Impfungen in den USA und Kanada – Nachrichten – Deutschland Today. Abgerufen am 15. Dezember 2020.
- Saudi-Arabien beginnt mit Impfungen mit Biontech-Impfstoff. In: aerzteblatt.de. 15. Dezember 2020, abgerufen am 15. Dezember 2020.
- FDA Approves First COVID-19 Vaccine, FDA, abgerufen am 23. August 2021.
- Corona-Impfung in Israel – Kleines Land, große Impfkampagne. Abgerufen am 25. Dezember 2020.
- La Cofepris otorga autorización para uso de emergencia a vacuna para prevenir la enfermedad por coronavirus (COVID-19), gob.mx, 11. Dezember 2020, abgerufen am 12. Dezember 2020.
- Corona-Impfungen: Welche Länder sind wie weit? In: tagesschau.de. Abgerufen am 15. Dezember 2020.
- Erste Corona-Impfungen in Lateinamerika. 25. Dezember 2020, abgerufen am 25. Dezember 2020.
- Benedikt Kapferer: Nach Notfallzulassung: Erste Impfungen in den USA durchgeführt. 14. Dezember 2020, abgerufen am 25. Dezember 2020.
- JFDA approves Pfizer vaccine for emergency use, gob.mx, 11. Dezember 2020, abgerufen am 12. Dezember 2020.
- Pfizer-BioNTech COVID-19 vaccine approved by Singapore, first shipment expected by end-December, cna.asia, 14. Dezember 2020, abgerufen am 18. Dezember 2020.
- Biontech-Impfstoff auch in Ecuador und Chile zugelassen. Abgerufen am 25. Dezember 2020.
- Swissmedic erteilt Zulassung für den ersten Covid-19-Impfstoff in der Schweiz, swissmedic.ch, 19. Dezember 2020, abgerufen am 19. Dezember 2020.
- Covid-Impfung in der Schweiz – Diese Kantone impfen bereits diese Woche. 20. Dezember 2020, abgerufen am 21. Dezember 2020.
- Marion Schlegel: BioNTech: Corona-Impfstoff weltweit gefragt – das ist der Zeitplan für Deutschland. Abgerufen am 25. Dezember 2020.
- Coronavirus: EU-Kommission lässt Coronavirus-Impfstoff von Biontech zu. In: manager-magazin.de. Abgerufen am 25. Dezember 2020.
- Pfizer und BioNTech erhalten EU-Zulassung für COVID-19-Impfstoff. Abgerufen am 25. Dezember 2020.
- Biontech und Pfizer: Erster Impfstoff in EU zugelassen. In: orf.at. 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- Europaweiter Impfstart: Dutzende Freiwillige in Österreich geimpft. In: orf.at. 27. Dezember 2020, abgerufen am 27. Dezember 2020.
- Corona: Die Ereignisse vom 21. bis 27. Dezember. 24. Dezember 2020, abgerufen am 25. Dezember 2020.
- Wer impft womit: Weltweites Rennen um Impfstoffe. In: orf.at. 16. Januar 2021, abgerufen am 16. Januar 2021.
- PH authorizes Pfizer’s COVID-19 vaccine for emergency use. In: cnnphilippines.com. 14. Januar 2021, abgerufen am 6. März 2021 (englisch).
- TGA provisionally approves Pfizer COVID-19 vaccine. In: tga.gov.au. 25. Januar 2021, abgerufen am 2. März 2021 (englisch).
- Use of vaccine approved. In: news.gov.hk. 25. Januar 2021, abgerufen am 10. März 2021 (englisch).
- Moderna Gets Added to Southeast Asia’s Vaccine Arsenal. In: bloomberg.com. 8. Februar 2021, abgerufen am 27. April 2021 (englisch).
- Robust assessment ahead of Medsafe approval of vaccine. In: health.govt.nz. 3. Februar 2021, abgerufen am 6. März 2021 (englisch).
- Japan approves Pfizer’s COVID-19 vaccine, 1st for domestic use. In: nikkei.com. 14. Februar 2021, abgerufen am 6. März 2021 (englisch).
- S. Korea approves Pfizer’s COVID-19 vaccine amid immunization push. In: yna.co.kr. 5. März 2021, abgerufen am 6. März 2021 (englisch).
- MFDA approves Pfizer, Sinopharm Covid-19 vaccines for emergency use. In: raajje.mv. 15. März 2021, abgerufen am 16. März 2021 (englisch).
- South Africa approves another COVID-19 vaccine. In: enca.com. 17. März 2021, abgerufen am 26. April 2021 (englisch).
- Covid vaccine: Pakistan approves Pfizer jab for emergency use. In: khaleejtimes.com. 1. Juni 2021, abgerufen am 15. Januar 2022 (englisch).
- Großbritannien lässt Biontech-Impfstoff zu. Noch vor EU und USA. In: n-tv.de. 2. Dezember 2020, abgerufen am 2. Dezember 2020.
- MHRA: Vaccine BNT162b2 – Conditions of Authorisation under Regulation 174. 2 December 2020 (PDF), abgerufen am 2. Dezember 2020.
- Ivana Kottasová and Emma Reynolds: First Britons receive Covid-19 vaccine, a landmark moment in the pandemic. CNN.com, 8. Dezember 2020. Abgerufen am 8. Dezember 2020 (englisch).
- Pfizer-BioNTech COVID-19 Vaccine (tozinameran). 9. Dezember 2020, abgerufen am 10. Dezember 2020.
- Kevin Kunzmann: FDA Authorizes Pfizer, BioNTech COVID-19 Vaccine for the US. In: contagionlive.com. Dezember 2020, abgerufen am 1. Januar 2021 (englisch).
- FDA Authorizes Pfizer-BioNTech COVID-19 Vaccine for Emergency Use in Children 5 through 11 Years of Age. In: FDA Office of the Commissioner. 29. Oktober 2021, abgerufen am 30. Oktober 2021 (englisch).
- BioNTech and Fosun Pharma Receive Authorization for Emergency Use in Hong Kong for COVID-19 Vaccine. In: investors.biontech.de. Biontech, Shanghai Fosun Pharma, 25. Januar 2021, abgerufen am 29. Januar 2021 (englisch).
- Zweiter Corona-Impfstoff wird überprüft, Pharmazeutische Zeitung, 6. Oktober 2020.
- BioNTech und Pfizer beginnen rollierenden Einreichungsprozess bei der europäischen Arzneimittelbehörde EMA für Impfstoffkandidaten BNT162b2 gegen SARS-CoV-2. In: investors.biontech.de. Biontech, 6. Oktober 2020, abgerufen am 2. Januar 2021.
- Biontech hat EU-Zulassung beantragt. In: tagesschau.de. Abgerufen am 1. Dezember 2020.
- Update on assessment of the BioNTech and Pfizer BNT162b2 vaccine marketing authorisation application, EMA, 15. Dezember 2020. Abgerufen am 15. Dezember 2020.
- Coronakrise – Impfstoffstrategie, EU-Impfstoffstrategie vom Juni 2020, Europäische Kommission. Abgerufen am 15. Dezember 2020.
- COVID-19 vaccines: authorised. In: EMA. Abgerufen am 4. Februar 2022.
- Beschluss der STIKO zur 2. Aktualisierung der COVID-19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung. In: Epidemiologisches Bulletin. Nr. 5, 4. Februar 2021, ISSN 2569-5266, S. 3–6 (rki.de [PDF]).
- Beschlussentwurf der STIKO zur 4. Aktualisierung der COVID-19-Impfempfehlung (1. April 2021). In: rki.de. Robert Koch-Institut, 1. April 2021, abgerufen am 3. April 2021.
- Beschlussentwurf der STIKO zur 4. Aktualisierung der COVID-19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung. (PDF) In: rki.de. Robert Koch-Institut, 1. April 2021, abgerufen am 3. April 2021.
- Das Paul-Ehrlich-Institut erteilt erste Chargenfreigaben des COVID-19-Impfstoffs Comirnaty von BioNTech/Pfizer für den deutschen und europäischen Markt. In: pei.de. Paul-Ehrlich-Institut, 22. Dezember 2020, abgerufen am 23. Dezember 2020.
- Deutschlandweit erste Corona-Impfung in Seniorenheim in Halberstadt. In: mdr.de, 26. Dezember 2020. Abgerufen am 27. Dezember 2020.
- Impfstoffe zeigen gute Wirkung: Ansteckungsrisiko sinkt nach Biontech-Impfung deutlich. In: tagesspiegel.de. 23. Februar 2021, abgerufen am 25. März 2021.
- npr.org 9. Dezember 2020: U.K. Regulators Tell People With Severe Allergies Not To Get Vaccine, zuletzt abgerufen am 25. Juni 2021.
- Corona-Impfstoff – Impfrisiken im Faktencheck. In: deutschlandfunk.de. Abgerufen am 24. Dezember 2020.
- Wie sicher ist der Corona-Impfstoff? In: quarks.de. 22. Dezember 2020, abgerufen am 24. Dezember 2020.
- SafeVac 2.0 – Smartphone-App zur Erhebung der Verträglichkeit von COVID-19-Impfstoffen. In: pei.de. Paul-Ehrlich-Institut, 22. Dezember 2020, abgerufen am 22. Dezember 2020.
- Corinna Volz-Zang: Verdachtsfälle von Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID-19. (PDF) In: pei.de. Paul-Ehrlich-Institut, 4. März 2021, abgerufen am 5. März 2021.
- Beschluss der STIKO zur 1. Aktualisierung der COVID-19-Impfempfehlung und die dazugehörige wissenschaftliche Begründung. In: Epidemiologisches Bulletin. Nr. 2, 8. Januar 2021, ZDB-ID 2028508-5, S. 66 (3 im PDF) (PDF).
- Schwere allergische Reaktionen nach COVID-19-Impfung mit dem Impfstoff von Pfizer/BioNTech in Großbritannien, springermedizin.de, 17. Dezember 2020.
- Verdachtsfälle von Nebenwirkungen und Impfkomplikationen nach Impfung zum Schutz vor COVID-19. (PDF) In: pei.de. Paul-Ehrlich-Institut, 4. Februar 2021, abgerufen am 5. Februar 2021.
- Christina Hohmann-Jeddi: Fallbericht: PEG als ein Anaphylaxie-Auslöser nach Covid-Impfung bestätigt. In: pharmazeutische-zeitung.de. 9. April 2021, abgerufen am 12. April 2021.
- COVID-19: latest updates, EMA; 27. Mai 2020, 21. Juli 2020 und 14. Dezember 2020.
- D. Hüttemann: EMA verspricht strenge Überwachung von Arznei- und Impfstoffen. In: pharmazeutische-zeitung.de. 27. Mai 2020.
- Christina Hohmann-Jeddi: Neue Nebenwirkungen bei mRNA-Impfstoffen. In: pharmazeutische-zeitung.de. 5. März 2021, abgerufen am 10. April 2021.
- Israel: Herzmuskelentzündungen bei BioNTech-Geimpften. In: tagesschau.de. 26. April 2021, abgerufen am 26. April 2021.
- Israel untersucht Fälle von Herzmuskelentzündungen nach Impfungen. In: SWR.de, 29. April 2021, abgerufen am 29. April 2021.
- USA prüfen Fälle von Herzmuskelentzündung. In: n-tv.de. 24. Mai 2021, abgerufen am 24. Mai 2021.
- Noam Barda et al.: Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. In: New England Journal of Medicine. Band 385, Nr. 12, 16. September 2021, S. 1078–1090, doi:10.1056/NEJMoa2110475, PMID 34432976, PMC 8427535 (freier Volltext).
- Herzkrankheit nach Biontech-Impfung: Auch Jugendliche in Deutschland betroffen in businessinsider.de, 24. August 2021, abgerufen am 26. August 2021
- Registerauskunft Patent. Deutsches Patent- und Markenamt, abgerufen am 28. Juni 2021.
- Der Zwischenbescheid steht immer nur temporär zu Verfügung. Um ihn erhalten muss man auf der Seite Registerauskunft Schutzzertifikat auf das Feld „Akteneinsicht“ klicken und dann die PDF-Datei zum Zwischenbescheid (Dateidatum 9.4.21) herunterladen. So abgerufen am 30. Juli 2021.
- Pfizer und BioNTech beliefern Europäische Union mit zusätzlichen 100 Millionen Dosen COMIRNATY®. In: investors.biontech.de. Biontech, 29. Dezember 2020, abgerufen am 7. Januar 2021.
- Pfizer und BioNTech schließen Liefervereinbarung mit der EU über 200 Millionen Dosen ihres mRNA-basierten Impfstoffkandidaten BNT162b2 gegen COVID-19. In: investors.biontech.de. Biontech, 11. November 2020, abgerufen am 2. Januar 2021.
- Pressekonferenz: Jens Spahn zu Corona-Lage und Stand der Impfkampagne. In: youtube.com. Bundesministerium für Gesundheit, 6. Januar 2021, abgerufen am 6. Januar 2021 (Zeitindex 39:05 bis 45:00, 49:50 bis 52:06).
- Steht das Schlimmste noch bevor, Frau Merkel? In: zdf.de. Zweites Deutsches Fernsehen, 12. Februar 2021, abgerufen am 12. Februar 2021.
- Pfizer und BioNTech beliefern die Europäische Union mit 200 Millionen weiteren COMIRNATY®-Impfstoffdosen. In: investors.biontech.de. Biontech, Pfizer, 17. Februar 2021, abgerufen am 21. Februar 2021.
- Pfizer und BioNTech beliefern EU mit 100 Millionen weiteren Dosen COMIRNATY®. In: investors.biontech.de. Biontech/Pfizer, 19. April 2021, abgerufen am 2. Mai 2021.
- EU-Großeinkauf bei BioNTech/Pfizer. In: tagesschau.de. 8. Mai 2021, abgerufen am 9. Mai 2021.
- Corona: Impfstoff von Johnson und Johnson könnte noch im ersten Quartal zugelassen werden. In: aerzteblatt.de. 13. Januar 2021, abgerufen am 15. Januar 2021.
- Pfizer und BioNTech beliefern USA mit weiteren 100 Millionen COVID-19-Impfstoffdosen. In: investors.biontech.de. Biontech, 12. Februar 2021, abgerufen am 13. Februar 2021.
- Pfizer und BioNTech geben Liefervereinbarung mit der US-Regierung für bis zu 600 Millionen Dosen eines mRNA-basierten Impfstoffkandidaten gegen SARS-CoV-2 bekannt. In: investors.biontech.de. Biontech, 22. Juni 2020, abgerufen am 2. Januar 2021.
- Pfizer und BioNTech beliefern USA mit zusätzlichen 100 Millionen COVID-19-Impfstoff-Dosen. In: investors.biontech.de. Pfizer, BioNTech, 23. Dezember 2020, abgerufen am 24. Dezember 2020.
- Stuart Winer, Toi Staff: Israel will reportedly pay much more than US, EU for Pfizer coronavirus vaccine. In: timesofisrael.com. 16. November 2020, abgerufen am 10. Januar 2021 (englisch).
- Francesco Guarascio: EU agreed 15.50 euros per dose for Pfizer vaccine -document. 21. Dezember 2020 (reuters.com [abgerufen am 16. Januar 2021]).
- www.nytimes.comHow Europe sealed a Pfizer Vaccine deal with Texts and Calls
- https://ec.europa.eu: Pressemitteilung (englisch)
- Alexander Fanta / netzpolitik.org 9. Dezember 2021: Von der Leyen verweigert Auskunft über angebliche SMS zu Milliardendeal mit Pfizer
- https://www.ft.com/content/0cea5e3f-d4c4-4ee2-961a-3aa150f388ec
- Ugur Sahin: Next Generation Immunotherapy. (PDF) In: investors.biontech.de. Biontech, 11. Januar 2021, S. 7 f., abgerufen am 11. Januar 2021 (englisch).
- Pfizer und BioNTech erhalten erste EU-Zulassung für einen COVID-19-Impfstoff. In: investors.biontech.de. 21. Dezember 2020, abgerufen am 21. Dezember 2020.
- M. Geiger: Corona-Impfstoffe in Produktion-Eine logistische Herausforderung, zdf.de, 2. November 2020.
- Ralph Sina und Dominik Lauck: Corona-Pandemie: Warum Israel genug Impfstoff hat. In: tagesschau.de. 23. Januar 2021, abgerufen am 20. Februar 2021.
- Dermapharm produziert für Biontech/Pfizer, apotheke adhoc, 10. September 2020.
- Siegfried AG partizipiert am Corona-Impfstoffgeschäft, punkt4.info, 15. September 2020.
- Was der Wunder-Impfstoff kann, oe.at, 10. November 2020.
- Rentschler Biopharma SE reinigt Impfstoffkandidaten, www.aerzteblatt.de, 8. Oktober 2020.
- Peter Voegeli: Forscherpaar der Stunde – Biontech-Gründer Ugur Sahin skizziert die «neue Normalität». In: Echo der Zeit vom 3. Mai 2021. Schweizer Radio und Fernsehen, 4. Mai 2021, abgerufen am 6. Mai 2021.
- Zusammen gegen Corona live – Ihre Fragen zur Corona-Schutzimpfung. In: youtube.com. Bundesministerium für Gesundheit, 9. Januar 2021, abgerufen am 9. Januar 2021 (Zeitindex 1:01:00 bis 1:03).
- Stolz auf Produktionsstart von Biontech, Frankfurter Allgemeine Zeitung, 1. April 2021.
- Biontech darf mit Corona-Impfstoffproduktion in Marburg beginnen. In: rnd.de. 28. Januar 2021, abgerufen am 30. Januar 2021.
- Update zur Impfstoffproduktion in BioNTechs Produktionsstätte in Marburg. In: investors.biontech.de. Biontech, 10. Februar 2021, abgerufen am 13. Februar 2021.
- BioNTech gibt Update zu Status der Impfstoffproduktion in der Marburger Produktionsstätte. In: biontech.de. Biontech, 26. März 2021, abgerufen am 3. April 2021.
- Norbert Wallet: „Unser Ziel ist es, schneller an die EU liefern zu können“. In: Stuttgarter Nachrichten. Band 76, 28. Januar 2021, S. 4.
- Auch Dermapharm produziert COVID-19-Impfstoff für BioNTech. (PDF) In: dermapharm.de. Dermapharm, 11. Januar 2021, abgerufen am 9. Februar 2021.
- Corona-Impfstoff aus dem Mibe-Werk in Brehna. In: mdr.de. Abgerufen am 24. Juli 2021.
- Corona: Biontech-Impfstoff kommt jetzt auch aus Reinbek. In: ndr.de. 30. April 2021, abgerufen am 24. Juli 2021.
- Corona-Liveblog: ++ Kaum Test-Hilfe der Bundeswehr angefragt ++. In: tagesschau.de. Abgerufen am 27. Januar 2021.
- Corona-Impfstoff: Sanofi will BioNTech/Pfizer bei Impfstoffproduktion unterstützen. In: zeit.de. 26. Januar 2021, abgerufen am 27. Januar 2021.
- Remarks at George Washington University COVID-19 Vaccination Site, U.S. Department of Health & Human Services, 14. Dezember 2020. Abgerufen am 15. Dezember 2020.
- Mainzer Firma Biontech startet EU-weite Auslieferung von Corona-Impfstoff. In: swr.de. 22. Dezember 2020, abgerufen am 22. Dezember 2020.
- Pfizer und Biontech geben erfolgreiche erste Zwischenanalyse ihres COVID-19-Impfstoffkandidaten in laufender Phase-3-Studie bekannt, Presseinformation vom 9. November 2020, abgerufen am 11. November 2020.
- Pfizer liefert weniger Ampullen. In: tagesschau.de. Norddeutscher Rundfunk, 21. Januar 2021, abgerufen am 23. Januar 2021.
- Markus Grabitz: Die EU bestellt bei Biontech nach. In: Stuttgarter Nachrichten. Band 76, Nr. 6, 9. Januar 2021, S. 4.
- Hersteller wollen mehr Impfdosen liefern. In: tagesschau.de. 1. Februar 2021, abgerufen am 1. Februar 2021.
- Für Hotspots in Grenzregionen: EU-Kommission sichert vier Millionen zusätzliche Impfdosen von BioNTech/Pfizer in den nächsten zwei Wochen. In: ec.europa.eu. Europäische Kommission, 10. März 2021, abgerufen am 20. März 2021.
- EU-Kommission und BioNTech/Pfizer vereinbaren beschleunigte Lieferung von weiteren 10 Millionen Impfdosen, EMA prüft AstraZeneca. In: ec.europa.eu. Europäische Kommission, 16. März 2021, abgerufen am 20. März 2021.
- JCVI issues advice on the AstraZeneca COVID-19 vaccine. In: gov.uk. Public Health England, 30. Dezember 2020, abgerufen am 1. Januar 2021 (englisch).
- Oxford University/AstraZeneca vaccine authorised by UK medicines regulator. In: gov.uk. Department of Health and Social Care, 30. Dezember 2020, abgerufen am 30. Dezember 2020 (englisch).
- Statement zur Erweiterung der Europäischen Produktionskapazitäten und den daraus resultierenden Veränderungen des Auslieferungszeitplans. In: investors.biontech.de. Biontech, 15. Januar 2021, abgerufen am 18. Januar 2021.
- Statement von Gesundheitsminister Spahn zu Corona-Mutationen. In: youtube.com. 18. Januar 2021, abgerufen am 18. Januar 2021: „Die Mengen für heute und morgen (…) die Zusage, dass die Dosenzahl die zugesagt ist, die haben wir von Biontech schriftlich bekommen. (…) Mögliche Reduzierungen betreffen insbesondere die nächsten ein bis zwei Wochen.“
- 70 Prozent Impfrate bis zum Sommer. In: tagesschau.de. 19. Januar 2021, abgerufen am 20. Januar 2021.
- Hannes Böckler: Lieferungen BioNTech: Anzahl Dosen bis einschl. 8. KW. (PDF) aktualisierter Stand 29. Januar 2021. In: bundesgeundheitsministerium.de. Bundesministerium für Gesundheit, 30. Januar 2021, abgerufen am 6. Februar 2021.
- Statement on Manufacturing. (PDF) In: investors.biontech.de. Biontech, 1. Februar 2021, abgerufen am 6. Februar 2021 (englisch).
- Diskussion um Liefer-Engpässe bei Impfung: Pfizer liefert mehr, nicht weniger. In: tt.com. 25. Januar 2021, abgerufen am 31. Januar 2021.
- Pressekonferenz: Jens Spahn zum Impfstart. In: youtube.com. Bundesministerium für Gesundheit, 26. Dezember 2020, abgerufen am 27. Dezember 2020 (ab Zeitindex 3:44).
- Spahn: Bemühungen um zweite Produktionsstätte für Biontech. (Nicht mehr online verfügbar.) In: deutschlandfunk.de. Deutschlandfunk, 20. Dezember 2020, archiviert vom Original am 22. Dezember 2020; abgerufen am 23. Dezember 2020.
- Wie lange lässt sich die zweite Impfdosis hinauszögern? In: spiegel.de. 23. Januar 2021, abgerufen am 24. Januar 2021.
- (1/3) Die Bundesländer werden wie geplant bis zum 1. Februar 3,98 Mio. Dosen BioNTech-Impfstoff geliefert bekommen. Erste Lieferungen von insgesamt 1,3 Mio. Dosen erfolgten am 26.12., 28.12. und 30.12., die weiteren 2,68 Mio. Dosen folgen am 8.1., 18.1., 25.1. und 1. Februar 2021. In: twitter.com. Bundesgesundheitsministerium, 1. Januar 2021, abgerufen am 2. Januar 2021.
- Josh Groeneveld: Interner Regierungsbericht: Deutschland bekommt bis Mitte Januar keinen neuen Biontech-Impfstoff mehr. In: businessinsider.de. 1. Januar 2021, abgerufen am 1. Januar 2020.
- Huml: Bis Mittwochmittag rund 17.000 Corona-Impfungen in Bayern erfolgt – Bayerns Gesundheitsministerin kritisiert aber fehlende Impfstofflieferung in der ersten Januar-Woche. In: stmgp.bayern.de. Bayerisches Staatsministerium für Gesundheit und Pflege, 30. Dezember 2020, abgerufen am 2. Januar 2021.
- Ab der 3. Kalenderwoche 2021 6 Impfdosen pro Vial. Quelle: Lars Petersen: Neue Lieferliste, alter Engpass: So viel Impfstoff gibt es bis Mitte Februar in Eurem Bundesland. In: businessinsider.de. 25. Januar 2021, abgerufen am 29. Januar 2021.
- Hannes Böckler: Geplante Lieferungen BioNTech: Anzahl Dosen bis einschließlich 13. KW. (PDF) In: bundesgesundheitsministerium.de. 8. Februar 2021, abgerufen am 23. Februar 2021.
- Hannes Böckler: Geplante LieferungenBioNTech: Anzahl Dosen bis einschließlich 13. KW. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 1. März 2021, abgerufen am 1. März 2021.
- Hannes Böckler: Zusatzlieferung BioNTech/Pfizer in Kalenderwoche 13. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 23. März 2021, abgerufen am 24. März 2021.
- Hannes Böckler: Lieferungen an die Länder bis Ende des 1. Quartals. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 15. April 2021, abgerufen am 17. April 2021.
- Corona-Pandemie: Spahn und Wieler über die aktuelle Lage. 12. März 2021, abgerufen am 13. März 2021 (ab Zeitindex 1:06:03): „Wir erwarten, Stand jetzt, nach den Liefermengen die der Hersteller uns angekündigt hat, im April gute neun Millionen Dosen von Biontech.“
- Hannes Böckler: Lieferprognosen bis Ende April 2021. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 23. März 2021, archiviert vom Original am 31. März 2021; abgerufen am 23. März 2021.
- Hannes Böckler: Lieferungen an die Länder im April. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 7. April 2021, ehemals im Original; abgerufen am 10. April 2021. (Seite nicht mehr abrufbar, Suche in Webarchiven)
- Hannes Böckler: Lieferprognosen bis Ende April 2021. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 6. April 2021, abgerufen am 10. April 2021.
- Hannes Böckler: Lieferungen an die Länder im April. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 14. April 2021, ehemals im Original; abgerufen am 17. April 2021. (Seite nicht mehr abrufbar, Suche in Webarchiven)
- Hannes Böckler: Lieferungen an die Länder bis Ende April 2021. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 6. Mai 2021, abgerufen am 15. Mai 2021.
- Hannes Böckler: Lieferungen an die Länder im Mai / Impfzentren. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 12. Mai 2021, abgerufen am 15. Mai 2021.
- Impfstofflieferungen für die EU. In: spiegel.de. 7. März 2021, abgerufen am 13. März 2021.
- Hannes Böckler: Lieferprognosen der verschiedenen Hersteller für das Jahr 2021. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 22. März 2021, abgerufen am 24. März 2021.
- Gesundheitsminister Spahn zum Impfstart in Praxen von Hausärzt:innen. 2. April 2021, abgerufen am 4. April 2021 (Zeitindex 14:06 ff. / 25:00 ff.).
- Gesundheitsminister Spahn zum Impfstart in Praxen von Hausärzt:innen. 2. April 2021, abgerufen am 4. April 2021 (Zeitindex 17:03 ff. / 40:37 ff.).
- Hannes Böckler: Lieferungen an die Länder im Mai / Impfzentren. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 31. Mai 2021, archiviert vom Original am 3. Juni 2021; abgerufen am 3. Juni 2021.
- Hannes Böckler: Lieferungen Arztpraxen. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 26. Mai 2021, abgerufen am 5. Juni 2021.
- Hannes Böckler: Lieferprognose Arztpraxen und Betriebsärzte (ab Juni) für das 2. Quartal. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 12. Mai 2021, archiviert vom Original am 23. Mai 2021; abgerufen am 15. Mai 2021.
- Hannes Böckler: Lieferprognosen für das 2. Quartal. (PDF) (Nicht mehr online verfügbar.) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 2. Juni 2021, archiviert vom Original am 3. Juni 2021; abgerufen am 5. Juni 2021.
- Briefing SPAHN und RKI-Chef WIELER zur CORONA-LAGE in DEUTSCHLAND (…). In: youtube.com. 1. Juni 2021, abgerufen am 6. Juni 2021 (ab Zeitindex 10:11): „Wir werden jetzt im Juni, im Juli und im August weitere 50 Millionen Dosen allein vom Hersteller Biontech bekommen und verimpfen können.“
- Hannes Böckler: Lieferprognosen der verschiedenen Herstellerfür das Jahr 2021. (PDF) In: bundesgesundheitsministerium.de. Bundesministerium für Gesundheit, 22. Juni 2021, abgerufen am 23. Juni 2021.
- COVID-19 vaccine doses administered by manufacturer, European Union. In: Our World in Data. 17. Januar 2022, abgerufen am 16. Januar 2022 (englisch).
- Pressekonferenz zur Corona-Lage. In: youtube.com. 12. Februar 2021, abgerufen am 12. Februar 2021 (Zeitindex 56:30 ff.): „Von fünf auf sechs Dosen: Also, ich kann Ihnen tatsächlich nicht sagen, ob das mittlerweile zu hundert Prozent umfänglich gelingt. Nach dem, was wir aus den Ländern, aus den Impfzentren hören, (…) gelingt das sehr, sehr häufig mittlerweile (…) regelhaft (…) die sechste Dose auch zu ziehen und verimpfen zu können, gelegentlich eine siebte.“
- Celine Müller: „Durch Mutationen bislang kein negativer Effekt auf die Wirkung des Impfstoffs nachgewiesen“. In: deutsche-apotheker-zeitung.de. 22. Dezember 2020, abgerufen am 25. Dezember 2020.
- Biontech: Derzeit keine Impfstoff-Anpassung an Varianten nötig. In: nau.ch. 22. Juni 2021, abgerufen am 25. Juli 2021.
- Pfizer-BioNTech to begin trials of Covid-19 booster vaccine in August. In: clinicaltrialsarena.com. 9. Juli 2021, abgerufen am 25. Juli 2021: „The booster vaccine is an updated version of the authorised BNT162b2 Covid-19 vaccine and is made to specifically target the entire spike protein of the Delta variant.“
- Sonja Álvarez: Vierte Impfung : Warum sich der Omikron-Impfstoff verzögert. Abgerufen am 22. Januar 2022.
- Buch über Biontech-Gründerpaar erscheint. In: ORF at. 23. August 2021, abgerufen am 30. August 2021.