Humane Granulozytäre Anaplasmose
Die Humane Granulozytäre Anaplasmose (HGA) ist eine durch Anaplasma phagocytophilum hervorgerufene bakterielle Infektionskrankheit des Menschen. Sie wurde früher als Humane Granulozytäre Ehrlichiose (HGE) bezeichnet.
| Klassifikation nach ICD-10 | |
|---|---|
| A77.8 | Sonstige Zeckenbissfieber |
| ICD-10 online (WHO-Version 2019) | |
Die Erstbeschreibung der Erkrankung erfolgte in den 1990er Jahren in Wisconsin im Mittleren Westen der USA, der Region mit der weiterhin höchsten Fallzahl.[1][2]
Übertragung
Die Übertragung auf Menschen erfolgt durch Zeckenstiche. Der häufigste Überträger in Europa ist der Holzbock (Ixodes ricinus), in Nordamerika vor allem Ixodes scapularis und Ixodes pacificus. Ein Schutz vor Zecken ist also zugleich Infektionsprophylaxe.
Epidemiologie
Zecken, die mit Anaplasma phagocytophilum infiziert sind, und Patientenseren, welche Antikörper gegen dieses Bakterium enthalten, wurden in vielen europäischen Ländern gefunden (u. a. in Belgien, Deutschland, England, Frankreich, Großbritannien, Italien, den Niederlanden, Norwegen, Schweden, Österreich, der Schweiz und Slowenien).
In Süddeutschland sind 1,6 bis 4 % der erwachsenen Ixodes ricinus-Zecken infiziert. Die Prävalenz von Antikörpern, welche einen vorausgegangenen Kontakt mit dem Erreger bestätigen, liegt in Deutschland bei 1,9 bis 2,6 %. In Risikogruppen, wie Waldarbeitern oder Förstern, liegt sie mit 11,4 bis 18,4 % deutlich höher.
Trotzdem ist bisher in Deutschland kein gesicherter Fall einer akuten Erkrankung an humaner granulozytärer Anaplasmose bekannt. Fallberichte aus den USA, Österreich, Slowenien, Portugal, Belgien und Italien liegen dagegen vor.
Deutlich verbreiteter ist die humane granulozytäre Anaplasmose in den USA. Dort ist sie vor allem im oberen Mittleren Westen und im Nordosten vor. Seit 2000 wird ein kontinuierlicher Anstieg der Fallzahlen in diesen beiden Regionen verzeichnet.[3]
Da Anaplasma phagocytophilum auch Hunde (→ Canine Anaplasmose), Wiederkäuer, Katzen und Pferde befällt, stellen diese ein Erregerreservoir dar.
Klinik
67 bis 75 % aller Infektionen verlaufen asymptomatisch. Nach einer Inkubationszeit von etwa 5 bis 30 Tagen kann es jedoch zu hohem Fieber und grippeähnlicher Symptomatik mit Kopf-, Glieder-, Muskel- und Gelenkschmerzen kommen. Selten treten zudem Bauchschmerzen, Übelkeit, Erbrechen und Diarrhoe auf. Auch trockener Husten und Exantheme wurden beschrieben.
Als schwere Komplikationen gefürchtet sind Multiorganversagen, Meningoenzephalitis und ein akutes Atemnotsyndrom, welche vor allem bei immunsupprimierten Patienten (HIV, Organtransplantation) auftreten. Die Letalität einer symptomatischen Anaplasmose liegt bei 2 bis 3 %.
Diagnostik
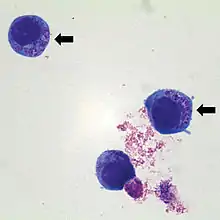
Auch ohne klinische Symptomatik können bei 86 % aller Infizierten typische Laborveränderungen gefunden werden. Dazu gehören neben einem Anstieg der Lebertransaminasen auch eine Leukozytopenie mit Lymphopenie und Neutropenie sowie eine Thrombopenie. C-reaktives Protein (CRP) und Blutsenkung sind erhöht. Auch die Kreatinkinase kann erhöht sein.
Bei Verdacht auf Vorliegen einer Anaplasmose werden der mikroskopische Direktnachweis von Morulae im Blutausstrich, der Nachweis spezifischer DNA mittels PCR, die Anzucht in Zellkultur und der Nachweis von Antikörpern über Immunfluoreszenztest durchgeführt. Spätere Titeruntersuchungen sind als Kontrolle nicht nutzbar, weil Antikörper auch noch lange nach Eliminierung der Erreger bestehen bleiben können. Eine PCR-Untersuchung ist etwas zuverlässiger, aber auch sie bietet keine vollkommene Sicherheit.
Therapie
Mittel der Wahl ist Doxycyclin. Beim Menschen werden zweimal 100 mg pro Tag für zwei bis drei Wochen empfohlen. Bei einer Kontraindikation von Doxycyclin ist eine Gabe von Rifampicin möglich.
Literatur
- F.D. von Loewenich u. a.: Ehrlichiose – Die unbekannte Zeckenerkrankung. In: Der Hausarzt. 10/01, S. 39–41.
- F.D. von Loewenich u. a.: A Case of Equine Granulocytic Ehrlichiosis Provides Molecular Evidence for the Presence of Pathogenic Anaplasma phagocytophilum in Germany. In: Eur J Clin Microbiol Infect Dis. (2003) 22, S. 303–305.
- G. Walder u. a.: Human granulocytic anaplasmosis in Austria: epidemiological, clinical, and laboratory findings in five consecutive patients from Tyrol, Austria. In: Int J Med Microbiol. 2006 May;296 Suppl 40, S. 297–301.
- G. Walder u. a.: First documented case of human granulocytic ehrlichiosis in Austria. In: Wien Klin Wochenschr. 2003 Apr 30;115(7-8), S. 263–266.
Einzelnachweise
- N. Ohashi u. a.: Anaplasma phagocytophilum–infected ticks, Japan. In: Emerg Infect Dis. (2005) online, abgerufen am 8. Mai 2007.
- J. Stephen Dumler, Kyoung-Seong Choi, Jose Carlos Garcia-Garcia, Nicole S. Barat, Diana G. Scorpio, Justin W. Garyu, Dennis J. Grab, Johan S. Bakken: Human Granulocytic Anaplasmosis and Anaplasma phagocytophilum. Emerging Infectious Diseases 2005, Band 11, Ausgabe 12, Seiten 1828–1834, doi:10.3201/eid1112.050898, PMC 3367650. PMID 16485466, (online) abgerufen am 8. Mai 2007
- David B. Sykes, Eric W. Zhang, Rebecca S. Karp Leaf, Valentina Nardi, Sarah E. Turbett: Case 10-2020: An 83-Year-Old Man with Pancytopenia and Acute Renal Failure; New England Journal of Medicine 2020, Band 382, Ausgabe 13 vom 26. März 2020, Seiten 1258-1266, DOI: 10.1056/NEJMcpc1916250