Pneumokokken
Pneumokokken, eingedeutschter Plural aus dem latinisierten Singular Pneumococcus (altgr. πνεύμων pneúmōn ‚Lunge‘ und κόκκος kókkos ‚Kern‘, ‚Korn‘),[1] sind grampositive Bakterien der Art Streptococcus pneumoniae, die morphologisch zu der Gruppe der Diplokokken gehören, also paarweise gelagert sind.
| Pneumokokken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
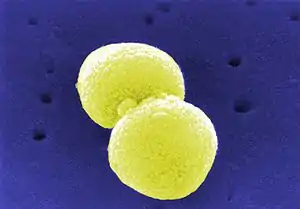
Streptococcus pneumoniae | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Streptococcus pneumoniae | ||||||||||||
| (Klein 1884) Chester 1901 |
Erreger
S. pneumoniae gehören zu den Gram-positiven Bakterien, bilden ovoide bis lanzettförmige Diplokokken und sind bekapselt.[2][3] Durch die Polysaccharidkapsel besitzt der Erreger einen wichtigen Virulenzfaktor, außerdem sind aufgrund der verschiedenen darin vorkommenden Polysaccharide über 97 Serotypen bekannt.[2][4] Serogruppen sind Serotypen chemisch verwandter Polysaccharide.
Die Kolonien von bekapselten Stämmen zeigen einen schleimigen Glanz: S-Formen („smooth“: glatt). Kapseln erschweren die Phagozytose der Pneumokokken: Nur S-Formen sind virulent. Die Virulenz der Pneumokokken ist der Dicke der Kapsel proportional. Pneumokokken, die besonders reich an Kapselsubstanz sind, sind daher hochvirulent. Schwere Pneumokokkenerkrankungen werden durch Kapseltypen ausgelöst, die Komplement über den alternativen Weg nicht aktivieren: Sie entgehen der komplementvermittelten Phagozytose, was sich besonders nachteilig in der Frühphase der Infektion, d. h. vor der Antikörperbildung, auswirkt.[5]
Kolonien unbekapselter Stämme sind glanzlos, sie wirken wie aufgeraut („rough“: rau). R-Formen sind avirulent.[5] Jedoch wurden unbekapselte Stämme seit der Einführung der Impfung vermehrt in Krankheitsbildern vermerkt besonders in Kindern unter dem Alter von fünf Jahren.[6] NESp (non-encapsulated S. pneumoniae) wurde vor allem in Fällen der Hornhautentzündung, in simplen Besiedlung des Nasopharynx (4-19%), aber auch in der Mittelohrentzündung bemerkt.[6][7] Diese Stämme enkodieren verschiedene Virulenz Faktoren und werden weiterhin nach diesen in verschiedene Gruppen eingeteilt bzw. in 3 NCC (null capsule clades).[8] Zusätzlich, haben NESp eine höhere Transformations Effizienz als ESp und sind deshalb Reservoire für Resistenzen gegen Antibiotika.[6]
Infektionsweg und Krankheitsbild
Pneumokokken können durch Schmierinfektion von Mensch zu Mensch weitergegeben werden, meist handelt es sich aber um endogene Infektionen. Sie besiedeln die Schleimhäute des Nasenrachens (Nasopharynx).[2] 27-65 % der Kinder sind hauptsächlich Träger und Überträger von Pneumokokken in den ersten beiden Lebensjahren, Erwachsene ohne Kontakt zu Kleinkindern sind nur zu etwa 5 % besiedelt, eine Zahl die allerdings mit zunehmendem Alter (>65 Jahre) und schwächerem Immunsystem wieder ansteigt.[9] Überträger werden meist von einem bis maximal drei verschiedenen Serotypen zugleich besiedelt, die jedoch immer wieder durch neue ersetzt werden. Die Übertragung erfolgt auch via Tröpfcheninfektion.[3]
Eine Besiedlung mit Pneumokokken im Nasenrachenraum ist meist symptomlos und ohne Krankheitsbild (eventuell leichte Erkältung).[3] Sie binden jedoch die körpereigenen Abwehrkräfte, stören die Abwehrmechanismen. Im oberen Respirationstrakt muss sich der Erreger der Elimination durch die mukoziliäre Clearance erwehren. Das bei der Autolyse der Pneumokokken freiwerdende Pneumolysin, das als Cholesterol-abhängiges Zytolysin durch die Bildung transmembranöser Poren in der Zellmembran seiner Zielzellen wirkt, ist in der Lage, diesen Abwehrmechanismus zu hemmen und zilientragende Epithelzellen zu zerstören. Ebenso kann Pneumolysin Granulo- und Lymphozyten funktionell beeinträchtigen und in höheren Dosen durch Porenbildung lysieren. Die Polysaccharidkapsel wirkt phagozytosehemmend. Die von Pneumokokken sezernierte IgA1-Protease kann die Etablierung auf der Schleimhaut durch den Abbau von IgA-Antikörpern unterstützen.[5]
Falls sich Pneumokokken in den oberen oder unteren Respirationstrakt ausbreiten, kann dies eine Nasennebenhöhlen-, Mittelohr- oder Lungenentzündung zur Folge haben. Je nach Serotyp können Pneumokokken auch sogenannte „invasive Pneumokokken-Erkrankungen“ (IPD) auslösen. Dies bedeutet, dass sie in normalerweise sterilen Körperflüssigkeiten wie z. B. im Blut oder im Liquor cerebrospinalis nachgewiesen werden.[3] So können sich Pneumokokken in roten Blutkörperchen einnisten, um einer Entdeckung durch Neutrophile (weiße Blutkörperchen) zu entgehen[10] – und tragen dadurch zu erhöhter Infektionsgefahr bei, vor allem durch Virusinfektionen mit chronischen Krankheiten, besonders im Alter. Damit fördern sie zusätzlich die Ausbreitung des Bakteriums. Mittelohr-, Nasennebenhöhlen-, Lungen- oder Hirnhautentzündung können dann die Folge sein, während ein Übergang in die Blutbahn (zumeist über vorherige Infektion der Lunge) zu Sepsis (Blutvergiftung) führt. Allerdings sind die genauen Gründe, warum bei gewissen Menschen eine Besiedlung zu lebensbedrohlichen Krankheiten führt, während die meisten keinerlei Symptome zeigen, noch nicht vollständig erforscht. In hohem Maße gefährdet sind die am meisten besiedelten Bevölkerungsgruppen wie Kinder in den ersten beiden Lebensjahren (noch nicht vollständig angepasstes Immunsystem), und alte Menschen. Teilweise wurden missense Mutationen festgestellt, die höhere Prevelanz in Meningitis erzeugt haben.[11]
Pneumokokken können eine Vielzahl von Krankheiten hervorrufen. Bei Säuglingen, Kleinkindern, älteren Menschen und Personen mit chronischen Grundleiden können sie besonders gefährlich werden.
Die meisten Menschen, die an Lungenentzündung (Pneumonie) erkranken, sind über 50 Jahre alt. Diese ist auch deshalb besonders gefährlich, weil sie leicht übersehen wird. Typische Krankheitssymptome, wie plötzliches hohes Fieber, Schüttelfrost, Husten, eitriger Auswurf, sind im Alter seltener. Typischerweise beginnt die Lungenentzündung nach vorausgegangenem Infekt der oberen Atemwege.
Säuglinge zeigen neben Husten oftmals untypische Symptome wie Trinkschwäche oder Schnupfen. Kleinkinder leiden unter Husten, schnellem Puls, sind blass und haben Fieber.
Einer Hirnhautentzündung (Meningitis) geht meist eine Infektion der oberen Atemwege voraus. Im Säuglingsalter haben Kinder hohes Fieber, erbrechen, sind apathisch oder unruhig, verweigern die Nahrung oder erleiden Krampfanfälle. Sind die Kinder älter als ein Jahr, tritt die typische Nackensteifheit (Meningismus) auf, darüber hinaus Kopfschmerzen und Bewusstlosigkeit. Auch wenn das Kind die Infektion überlebt, kann es Hirnschäden zurückbehalten, taub sein oder schlechter sehen. Bei Kindern unter fünf Jahren sind Pneumokokken die zweithäufigste Ursache bei akuten bakteriellen Hirnhautentzündungen.
Eine Mittelohrentzündung (Otitis media) verursacht bei den betroffenen Kindern starke Ohrenschmerzen und Fieber. Manche Kinder leiden unter häufig wiederkehrenden Mittelohrentzündungen. In Deutschland erkranken nach Schätzungen jährlich 300.000 bis 600.000 Kinder unter fünf Jahren an akuter Mittelohrentzündung.
Bei der Nasennebenhöhlenentzündung (Sinusitis) treten Fieber und Kopfschmerzen auf, die Nebenhöhlen sind vereitert. Säuglinge erkranken nur selten an einer Entzündung der Kieferhöhlen, weil diese noch nicht vollständig ausgebildet sind. Das sogenannte Siebbeinzellensystem kann aber bei ihnen auch betroffen sein.
Eine Hornhautentzündung durch Pneumokokken verläuft oft rasch penetrierend und schmerzhaft (Ulcus serpens).
Epidemiologie
Vor Verbreitung von Pneumokokkenimpfstoffen 2006 waren 6 bis 11 Serotypen für mindestens 70 % der IPD bei Kindern unter 5 Jahren verantwortlich.[12] Damals lag die Inzidenz von IPD bei Kindern unter 2 Jahren bei 44,4 (Europa), 167 (USA), 60 (Südafrika) bis hin zu 797 (Mosambik) pro 100.000 und Jahr. Nach offizieller Schätzung der WHO starben im Jahr 2005 etwa 1,6 Millionen Menschen durch Pneumokokkeninfektionen[13], davon Anfang der 2000er Jahre geschätzt 826.000 Kinder unter 5 Jahren.[14] 2008 sanken die Todesfälle auf jährlich etwa 476.000 Kinder unter 5 Jahren[15], 2015 auf 294.000 bzw. 317.300, falls Co-Infektionen mit HIV mitgezählt werden.[12]
In Deutschland fallen jedes Jahr mehr als 10.000 Menschen einer Lungenentzündung durch Pneumokokken zum Opfer.[16] Trotz Antibiotika tritt die Hälfte dieser Todesfälle bereits innerhalb der ersten 48 Stunden ein. In der Akutphase liegt die Sterblichkeit bei etwa acht Prozent, in den darauffolgenden Monaten bei weiteren etwa fünf Prozent.[Beleg fehlt]
Bundesweit gibt es keine Meldepflicht, jedoch besteht in einigen Bundesländern wie Sachsen-Anhalt, Sachsen, Mecklenburg-Vorpommern, Brandenburg und Thüringen eine Meldepflicht für IPD aufgrund von Landesverordnungen.[3]
Diagnostik
Pneumokokken können mikroskopisch und kulturell in entsprechenden Untersuchungsproben (Blut, Sputum, Bronchialsekret, Liquor) nachgewiesen werden. Auf Blutagar zeigen sie eine α-Hämolyse. Außerdem gibt es einen Schnelltest, der Pneumokokkenantigen im Urin nachweist.
Therapie
Trotz der weltweit steigenden Antibiotikaresistenzen sind Penicilline weiterhin Mittel der 1. Wahl zur Therapie von Pneumokokken-Infektionen.[17] Besonders in Deutschland ist die Resistenzsituation der Pneumokokken gegenüber Schmalspektrumpenicillinen äußerst günstig, weswegen oftmals eine gezielte und leitliniengerechte Therapie z. B. mit Penicillin G indiziert ist.[18] Vorteile bietet auch die Verwendung von Aminopenicillinen, da sie auch gegen differenzialdiagnostisch wichtige Keime wie Haemophilus influenzae ebenfalls gut wirksam sind. Eine Ausnahme bildet die Pneumokokken-Meningitis, da hier mit den schlecht liquorgängigen Penicillinen keine ausreichend hohen Wirkstoffdosen am Entzündungsherd erreicht werden. Bei Verdacht auf Pneumokokken-Meningitis sollte unmittelbar eine Therapie mit Cephalosporinen begonnen werden. Als Reserveantibiotika bei penicillinresistenten Pneumokokken-Stämmen stehen Rifampicin und Vancomycin zur Verfügung.[19] Zur Postexpositionsprophylaxe (bei asplenischen Patienten) erfolgt eine Chemotherapie mit Penicillin V.[20]
Impfung
Die Pneumokokken-Impfung schützt vor invasiven Infektionen durch Pneumokokken. Für die zur Infektionsprophylaxe[21] eingesetzte Impfung gegen Pneumokokken stehen zwei Arten von Pneumokokkenimpfstoffen zur Verfügung:
- Ein sogenannter Polysaccharidimpfstoff (PPV23) richtet sich gegen 23 verschiedene Pneumokokkentypen, die für 90 Prozent der Erkrankungen verantwortlich sind (Handelsname Pneumovax 23). Er ist für Kinder ab 2 Jahren und Erwachsene (insbesondere ab 60 Jahren) bestimmt.[22]
- Da der Polysaccharidimpfstoff keine ausreichende Immunantwort bei Kindern unter 2 Jahren auslöst, wurden konjugierte Impfstoffe entwickelt.[22] Es sind zwei dieser Impfstoffe zugelassen: Einer richtet sich gegen 10 Seroptypen (Synflorix, bis zu einem Alter von 5 Jahren). der andere gegen 13 Serotypen (Prevenar13). Seit März 2015 ist letzterer für alle Altersgruppen freigegeben.[23]
Obwohl die Impfung gut verträglich ist, ist nur ein kleiner Teil der Menschen, für die sie empfohlen wird, geimpft. Insbesondere wird von der Impfung erhofft, das Entstehen von Antibiotika-Resistenzen einzudämmen, die das Behandeln von Pneumokokken-Infektionen weltweit erschweren. Daher wird von einigen Stellen gefordert, die Impfung sollte in größerem Umfang genutzt werden als bisher.
Der beträchtliche ökonomische Nutzen von Pneumokokken-Impfungen konnte durch die Analyse von Silvia Evers und Mitarbeitern der Universität Maastricht 2007 gezeigt werden.[24] Als obere Schranke galten dabei 50.000 Euro pro qualitätsgleichem Lebensjahr (QALY; 1 QALY entspricht kurz gesagt einem in völliger Gesundheit verbrachten Lebensjahr). Maßnahmen, die weniger als 50.000 Euro pro QALY kosten, gelten Gesundheitsökonomen als kosteneffizient. Evers’ Analyse erstreckte sich auf zehn europäische Länder. Es ergaben sich Kosten-Nutzen-Verhältnisse zwischen 9239 (Dänemark) und 23.657 Euro pro QALY (Schweden). Deutschland rangiert in diesen Berechnungen mit 17.093 Euro pro QALY im Mittelfeld.
Meldepflicht
In Deutschland ist der direkte Nachweis von Streptococcus pneumoniae namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist und der Nachweis aus Liquor, Blut, Gelenkpunktat oder anderen normalerweise sterilen Substraten gewonnen wurde. Die Meldepflicht betrifft in erster Linie die Leitungen von Laboren (§ 8 IfSG).
In der Schweiz ist der positive laboranalytische Befund zu Streptococcus pneumoniae bzw. der einer invasiven Pneumokokken-Erkrankung für Laboratorien bzw. Ärzte, Spitäler usw. meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 bzw. Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen.
Weblinks
- Pneumokokken-Infektionen – Informationen des Robert Koch-Instituts
Einzelnachweise
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/Wien 1965.
- Ulrich Heininger, Mark van der Linden: Pneumokokken. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 242 ff., doi:10.1055/b-0035-127594.
- Wissenschaftliche Begründung für die Aktualisierung der Pneumokokken-Impfempfehlung für Senioren. (PDF) In: Epidemiologisches Bulletin. Robert Koch-Institut, 12. Dezember 2016, abgerufen am 24. November 2019.
- K. Aaron Geno, Gwendolyn L. Gilbert, Joon Young Song, Ian C. Skovsted, Keith P. Klugman: Pneumococcal Capsules and Their Types: Past, Present, and Future. In: Clinical Microbiology Reviews. Band 28, Nr. 3, Juli 2015, ISSN 0893-8512, S. 871–899, doi:10.1128/CMR.00024-15.
- Sören Gatermann: Medizinische Mikrobiologie und Infektiologie. Hrsg.: Suerbaum, Burchard, Kaufmann, Schulz. 8. Auflage. Springer, Berlin / Heidelberg 2016, ISBN 978-3-662-48677-1, S. 205.
- Jessica L. Bradshaw, Larry S. McDaniel: Selective pressure: Rise of the nonencapsulated pneumococcus. In: PLOS Pathogens. Band 15, Nr. 8, 29. August 2019, ISSN 1553-7374, S. e1007911, doi:10.1371/journal.ppat.1007911, PMID 31465516, PMC 6715154 (freier Volltext).
- Lance E. Keller, D. Ashley Robinson, Larry S. McDaniel: Nonencapsulated Streptococcus pneumoniae: Emergence and Pathogenesis. In: mBio. Band 7, Nr. 2, 4. Mai 2016, ISSN 2161-2129, doi:10.1128/mBio.01792-15, PMID 27006456, PMC 4807366 (freier Volltext).
- Mitsuyo Kawaguchiya, Noriko Urushibara, Meiji Soe Aung, Kenji Kudo, Masahiko Ito: Clonal lineages and antimicrobial resistance of nonencapsulated Streptococcus pneumoniae in the post-pneumococcal conjugate vaccine era in Japan. In: International Journal of Infectious Diseases. Band 105, April 2021, S. 695–701, doi:10.1016/j.ijid.2021.02.109 (elsevier.com [abgerufen am 15. Dezember 2021]).
- Jeffrey N. Weiser, Daniela M. Ferreira, James C. Paton: Streptococcus pneumoniae: transmission, colonization and invasion. In: Nature Reviews Microbiology. Band 16, Nr. 6, Juni 2018, ISSN 1740-1526, S. 355–367, doi:10.1038/s41579-018-0001-8, PMID 29599457, PMC 5949087 (freier Volltext).
- Masaya Yamaguchi et al.: Streptococcus pneumoniae Invades Erythrocytes and Utilizes Them to Evade Human Innate Immunity. In: PLOS ONE. Band 8, Nr. 10, 23. Oktober 2013, ISSN 1932-6203, S. e77282, doi:10.1371/journal.pone.0077282, PMID 24194877, PMC 3806730 (freier Volltext).
- Yuan Li, Benjamin J. Metcalf, Sopio Chochua, Zhongya Li, Hollis Walker: Genome-wide association analyses of invasive pneumococcal isolates identify a missense bacterial mutation associated with meningitis. In: Nature Communications. Band 10, Nr. 1, Dezember 2019, ISSN 2041-1723, S. 178, doi:10.1038/s41467-018-07997-y, PMID 30643125, PMC 6331587 (freier Volltext).
- Position paper on pneumococcal conjugate vaccines (PCV) – February 2019. (PDF) Weltgesundheitsorganisation, 22. Februar 2019, S. 85–104, abgerufen am 24. November 2019 (englisch).
- Pneumococcal conjugate vaccines. WHO, abgerufen am 19. Januar 2021 (englisch).
- Katherine L. O’Brien et al.: Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates. In: Lancet (London, England). Band 374, Nr. 9693, 12. September 2009, S. 893–902, doi:10.1016/S0140-6736(09)61204-6, PMID 19748398.
- Pneumococcal vaccines WHO position paper – 2012. (PDF) Weltgesundheitsorganisation, 6. April 2012, abgerufen am 24. November 2019 (englisch).
- R. Gross: Pneumokokken. In: Der niedergelassene Arzt. 1, 2014.
- R. R. Reinert: The antimicrobial resistance profile of Streptococcus pneumoniae. In: Clinical Microbiology and Infection. Band 3, April 2009, S. 7–11, PMID 19366363.
- GERMAP 2010. Abgerufen am 15. Dezember 2011.
- ZCT 5-2004: Streptococcus pneumoniae. (Memento vom 24. Oktober 2010 im Internet Archive)
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 320m und 322.
- Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 326 f.
- Schutzimpfung gegen Pneumokokken: Häufig gestellte Fragen und Antworten. In: RKI. 23. Juni 2020, abgerufen am 16. Dezember 2021.
- Pfizer Receives European Approval for New Indication for Prevenar 13. Pfizer, 3. März 2015, abgerufen am 31. Juli 2015.
- Silvia Evers et al.: Cost-effectiveness of pneumococcal vaccination for prevention of invasive pneumococcal disease in the elderly: an update for 10 Western European countries. In: European Journal of Clinical Microbiology & Infectious Diseases: Official Publication of the European Society of Clinical Microbiology. Band 26, Nr. 8, August 2007, S. 531–540, doi:10.1007/s10096-007-0327-z, PMID 17570001.