DNA-Impfstoff
DNA-Impfstoffe (englisch DNA vaccines) bezeichnen Impfstoffe, die anstatt eines Proteins eines Krankheitserregers ausschließlich die DNA-Teile aus seinem Genom verwenden, welche die genetische Information für ein oder mehrere Proteine enthalten, die anschließend dem Immunsystem als Antigene dienen und eine Immunantwort hervorrufen.[1] Daher gehören DNA-Impfstoffe zu den genetischen Impfstoffen. Die DNA selbst wird nicht vom Immunsystem als Antigen erkannt, sondern über mehrere Schritte in ein Protein übersetzt. Die DNA wird nach kurzer Zeit in der Zelle durch Nukleasen abgebaut. Diese Art der Impfung wird DNA-Impfung oder auch DNA-Vakzinierung genannt.[2] Der weltweit erste DNA-Impfstoff war gegen das West-Nil-Virus gerichtet und wurde 2005 in den USA für Pferde zugelassen.[3] ZyCov-D war 2021 der weltweit erste für den Menschen zugelassene DNA-Impfstoff.[4]

Prinzip
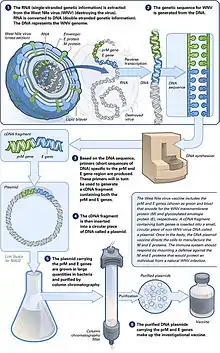

Der Träger für die genetische Information des Antigens ist in der Regel ein ringförmiges DNA-Molekül (Plasmid), das in ungefährlichen Bakterien unter kontrollierten Bedingungen hergestellt wird.[1] Die DNA wird meistens mit einem Transfektionsreagenz versehen. Üblicherweise wird als Transfektionsreagenz ein basisches Lipid verwendet, das der DNA ermöglicht, per Endozytose in eine Zelle aufgenommen zu werden[5] und die Membran des Endosom zu durchdringen und dieses somit zu verlassen. Die DNA liegt mit dem Lipid in Form flüssiger Nanopartikel vor (kationische Liposomen).[6][7]
Die DNA wird in den Zellkern importiert, wo die Transkription stattfindet, dem ersten Schritt der Genexpression. Dabei wird die DNA in mRNA umgeschrieben. Die mRNA wird aus dem Zellkern ins Zytosol ausgeschleust. Die Übersetzung der mRNA in ein Protein (das als Antigen wirkt) wird als Translation bezeichnet und findet im Zytosol an Ribosomen statt. Das entstandene Erregerprotein wird anschließend am Proteasom zu Peptiden proteolysiert, welche an MHC I und in geringem Umfang auch an MHC II präsentiert werden. Dadurch entsteht sowohl eine zelluläre als auch eine humorale Immunantwort. Membranproteine werden (zusätzlich zur MHC-Präsentation der Peptide) an der Zelloberfläche präsentiert. Durch diesen Vorgang wird auf zellulärer Ebene eine symptomfreie Infektion im Wirtskörper simuliert, die eine Immunantwort auslöst. Zudem können Sequenzen pro-inflammatorischer Zytokine (z. B. IL-2 oder GM-CSF) in die Plasmide eingebaut werden bzw. in einem zusätzliches Plasmid enthalten sein, welche dann exprimiert werden.[2][8] Dies verbessert den Effekt der Immunisierung.[8]
DNA-Impfstoffe können unter anderem intramuskulär injiziert oder bioballistisch (per Genkanone) verabreicht werden. Für DNA-Impfungen werden nadelfreie Injektionssysteme entwickelt: Dabei wird die DNA an Goldpartikel gebunden und in den Muskel durch eine Impfpistole injiziert.[2] Bei der Injektion in das Muskelgewebe konnte eine höhere Expressionsrate als in anderen Gewebetypen festgestellt werden. Es wird vermutet, dass die Struktur der Muskelzellen dabei eine Rolle spielt.[9] Mögliche weitere Verabreichungsmethoden sind selbstklebende Pflaster, die mit antigen-kodierenden Plasmiden beschichtet sind, oder der Einsatz elektrischer Impulse zur Stimulierung der Aufnahme des Wirkstoffs in das Gewebe (Elektroporation).[10]
Verwendung
Die ersten DNA-Impfstoffe wurden an HIV-positiven Patienten getestet, weitere Tests fanden an Gesunden statt, um Impfstoffe gegen HIV zu testen. Obschon die Immunantwort im Menschen eher schwach ausfällt, zeigte sich in Verwendung mit rekombinanten Vektoren und Hilfsstoffen eine Schutzwirkung in Primaten.
Neben HIV-Impfstoffen wird auch verstärkt nach Influenza-Impfstoffen geforscht. 2002 stellten Forscher die Vermutung auf, dass DNA-Impfungen eine erste Maßnahme gegen Influenza-A/H5N1-Stämme mit hoher Letalität bilden könnten, stellten jedoch auch fest, dass die DNA-Impfung allein nur einen sehr beschränkten Schutz gegen den für Mäuse pandemischen HK/483-Stamm boten.[11] In der Tiermedizin starteten die ersten Versuche der DNA-Impfung 1993 bei Geflügel, getestet wurde der Effekt auf Geflügelpest.[12] Dort gibt es mittlerweile eine DNA-Impfung gegen die Vogelgrippe H5N1 bei Hühnern.[12]
Zur oralen Impfung von Bienen gegen die Varroa-Milbe wurde ein DNA-Impfstoff entwickelt,[13] eine praktische Anwendung ist jedoch nicht bekannt (Stand Mai 2020).
In klinischer Prüfung befindet sich auch DNA-Impfstoffkandidaten zur Behandlung verschiedener Tumoren, wie z. B. Zervix- oder Kopf-Hals-Karzinome.[14]
Das indische Unternehmen Cadila Healthcare hatte bei den indischen Behörden eine Notfallzulassung für den DNA-Impfstoff ZyCoV-D beantragt.[15][16] Die Zulassung erfolgte im August 2021. Auch das amerikanische Unternehmen Inovio ist dabei, einen DNA-Impfstoff gegen SARS-CoV-2 zu entwickeln.[17]
Abgrenzung zu Impfungen mit Vektorviren
Eine Möglichkeit der Impfung kann auch das Einbringen der DNA mittels eines viralen Vektors sein. Der virale Vektor ist dabei nicht der zu bekämpfende Erreger selbst, sondern ein Trägervirus, in das der Teil der DNA des Erregers eingebaut wurde, der für das Antigen codiert. Als Trägerviren werden unter anderem abgeschwächte Adenoviren verwendet, die nicht humanpathogen sind. Teilweise wird für diese Form der DNA-Einbringung der Begriff "DNA-basiert" (engl. "DNA-based")[18] oder auch "DNA-Impfung" verwendet.[19] Es gibt jedoch auch RNA-basierte virale Vektoren, die nicht dieser Definition entsprechen. In der Impfstoffentwicklung werden derartige Impfstoffe daher als Vektorimpfstoffe bezeichnet.[6]
Vergleich mit anderen Impfstofftypen
Die Hauptvorteile von DNA-Impfstoffen gegenüber einer Impfung mit gereinigten oder rekombinanten Antigenen liegen in der einfachen und sehr kostengünstigen[2] Herstellung per Fermentation, der biologischen und chemischen Stabilität, der einfachen Anpassung der Impfstoffe sowie einer Aktivierung der zellulären Immunität. Außerdem könnten Massenimpfungen sicherer und schneller durchgeführt werden.[2] Außerdem enthält die eingebaute DNA starke Promotoren.[2] Die Weltgesundheitsorganisation stellte 2005 Richtlinien für die Herstellung von DNA-Impfstoffen auf,[20] die 2020 aktualisiert wurden.[21] Nachteile von DNA-Impfstoffen sind eine oftmals geringe Immunogenität ohne mitexprimierte Zytokine[22][23] und die Möglichkeit der Insertion ins Genom[24] des Geimpften. Im Zuge der Immunantwort durch cytotoxische T-Zellen werden die exprimierenden Zellen aber ohnehin zerstört. Um die Immunantwort zu verbessern, werden nur bestimmte Promotoren und Polyadenylierungssignale verwendet, eine Codon-Optimierung durchgeführt und das Einfügen von Introns untersucht.[25]
Im Gegensatz zu RNA-Impfstoffen werden DNA-Impfstoffe in den Zellkern transportiert und sind vom Import in den Zellkern und von der Transkription abhängig.[26] RNA in RNA-Impfstoffen ist im Vergleich zu DNA relativ empfindlich für abbauende Enzyme (bei RNA sind das RNasen), die ubiquitär vorkommen.[27] DNA ist dagegen stabil auch bei Raumtemperatur und erfordert keine Kühlkette.[28] RNA ist kostenintensiver herzustellen als Plasmid-DNA.[29] Bei viralen Vektoren, DNA-, RNA- und Untereinheitenimpfstoffen wird kein vollständiger Erreger zur Produktion verwendet, wodurch für die Produktionsstätte keine zusätzliche Zulassung notwendig ist, in Deutschland nach dem Infektionsschutzgesetz und der Biostoffverordnung. Die Herstellung von RNA-Impfstoffen per In-vitro-Transkription erfolgt zudem ohne eine Verwendung lebender Zellen (zellfreie Produktion).[30]
Im Gegensatz zu attenuierten (aus in ihrer Wirkung abgeschwächten Erregern bestehenden) Impfstoffen kann keine Reversion (Rückmutation) zu einem Pathogen auftreten, da nur einzelne Bestandteile eines Pathogens verwendet werden. Im Vergleich zu viralen Vektoren erzeugt RNA (und DNA) keine Vektorimmunität,[29] da RNA-Lipid-Nanopartikel keine Proteine aufweisen, die sonst bei viralen Vektoren und ihrer erneuten Anwendung zu einem vorzeitigen Abbau eines Anteils der viralen Vektoren führt. Im Gegensatz zu älteren Impfstofftypen wie Totimpfstoffen, darunter auch Untereinheitenimpfstoffe und Peptidimpfstoffe, wird bei genetischen Impfstoffen (DNA-Impfstoffe, RNA-Impfstoffe oder virale Vektorimpfstoffe) das Antigen im Zytosol erzeugt, wodurch nicht nur eine humorale, sondern auch eine zelluläre Immunantwort ausgelöst wird.
Literatur
- L. Li, N. Petrovsky: Molecular mechanisms for enhanced DNA vaccine immunogenicity. In: Expert review of vaccines. Band 15, Nummer 3, 2016, S. 313–329, doi:10.1586/14760584.2016.1124762, PMID 26707950, PMC 4955855 (freier Volltext).
- J. Lee, S. Arun Kumar, Y. Y. Jhan, C. J. Bishop: Engineering DNA vaccines against infectious diseases. In: Acta Biomaterialia. Band 80, 10 2018, S. 31–47, doi:10.1016/j.actbio.2018.08.033, PMID 30172933, PMC 7105045 (freier Volltext).
- E. N. Gary, D. B. Weiner: DNA vaccines: prime time is now. In: Current opinion in immunology. Band 65, August 2020, S. 21–27, doi:10.1016/j.coi.2020.01.006, PMID 32259744, PMC 7195337 (freier Volltext).
Einzelnachweise
- Paul-Ehrlich-Institut: Neuer WHO-Leitfaden zu modernen DNA-Impfstoffen. Auf: pei.de vom 9. Juli 2020; zuletzt abgerufen am 19. Januar 2021.
- Barbara Bröker, Christine Schütt, Bernhard Fleischer: Grundwissen Immunologie. Springer-Verlag, Berlin/ Heidelberg 2019, ISBN 978-3-662-58330-2, S. 252.
- Veterinary Vaccine - an overview – ScienceDirect Topics. Abgerufen am 12. Juni 2021 (englisch).
- Manavi Kapur: What we know about ZyCoV-D, the world's first DNA Covid vaccine. In: MSN vom 23. August 2021.
- Max-Planck-Institut für Kolloid- und Grenzflächenforschung - Reinhard Lipowsky, Jaime Agudo-Canalejo: Wechselwirkung von Nanopartikeln mit Membranen und Vesikeln. - Forschungsbericht 2016, doi:10.17617/1.5G Auf: mpg.de von 2016; zuletzt abgerufen am 20. Januar 2021.
- Paul-Ehrlich-Institut: Welche Impfstoffkonzepte werden bei der Entwicklung eines Impfstoffs gegen SARS-CoV-2 verfolgt? Auf: pei.de vom 3. April 2020; zuletzt abgerufen am 19. Januar 2021.
- Fraunhofer-Institut für Produktionsanlagen und Konstruktionstechnik: Die Rettung naht- mRNA-basierte Impfstoffe gegen das neuartige Coronavirus sind vielversprechend, aber schwierig herzustellen. Lässt sich ihre Produktion durch neue Verfahren beschleunigen? Abschnitt "Molekulare Schützenhilfe" Auf: ipk.fraunhofer.de von 2021, zuletzt abgerufen am 19. Januar 2021.
- Kenneth Murphy, Casey Weaver: Die gezielte Beeinflussung der Immunantwort. In: Janeway Immunologie. Springer, Berlin, Heidelberg 2018, ISBN 978-3-662-56004-4, S. 961, doi:10.1007/978-3-662-56004-4_16.
- Impfstoffe. auf: Naturwissenschaften-verstehen.de – Biologie für Schule, Studium und Ausbildung – verständlich erklärt. Abgerufen am 20. Mai 2020.
- Bernadette Ferraro et al.: Clinical Applications of DNA Vaccines: Current Progress. In: Clinical Infectious Diseases. Band 53, Nr. 3, 1. August 2011, S. 296–302, doi:10.1093/cid/cir334, PMID 21765081.
- S. L. Epstein, T. M. Tumpey, J. A. Misplon, C. Y. Lo, L. A. Cooper, K. Subbarao et al.: DNA Vaccine Expressing Conserved Influenza Virus Proteins Protective Against H5N1 Challenge Infection in Mice. In: Emerging Infectious Diseases. 2002, PMC 2732511 (freier Volltext).
- Seyed Davoud Jazayeri und Chit Laa Poh: Recent advances in delivery of veterinary DNA vaccines against avian pathogens. In: Veterinary Research. Band 50, Nr. 1, 10. Oktober 2019, S. 78, doi:10.1186/s13567-019-0698-z, PMID 31601266, PMC 6785882 (freier Volltext).
- S. Giese, M. Giese: Oral Vaccination of Honeybees Against Varroa Destructor. In: M. Giese (Hrsg.): Molecular Vaccines: From Prophylaxis to Therapy. Volume 1, Band 1. Springer-Verlag, 2013. S. 269 ff. (eingeschränkte Vorschau in der Google-Buchsuche)
- Rebecca Sheets et al.: WHO informal consultation on the guidelines for evaluation of the quality, safety, and efficacy of DNA vaccines, Geneva, Switzerland, December 2019. In: NPJ Vaccines. Band 5, 18. Juni 2020, doi:10.1038/s41541-020-0197-2, PMID 32579135, PMC 7303131 (freier Volltext).
- Staff Writer: Cadila Healthcare starts production of Covid vaccine candidate (en) In: mint. 24. April 2021. Abgerufen am 27. April 2021.
- Zydus may seek jab nod this month.
- Covid-19 | INOVIO Pharmaceuticals. 8. April 2020, abgerufen am 14. Januar 2021 (englisch).
- Sanjay Kumar Mishra, Timir Tripathi: One year update on the COVID-19 pandemic: Where are we now?. In: Acta Tropica. Band 214, Februar 2021. doi:10.1016/j.actatropica.2020.105778. PMC 7695590 (freier Volltext).
- genetische Impfung. Auf: Spektrum.de, abgerufen am 21. Januar 2021.
- Guidelines for assuring the quality and non-clinical safety evaluation of DNA vaccines. Abgerufen am 13. Juni 2021 (englisch).
- David W. C. Beasley: New international guidance on quality, safety and efficacy of DNA vaccines. In: npj Vaccines. 5, 2020, doi:10.1038/s41541-020-0199-0.
- D. B. Weiner, G. J. Nabel: Development of gene-based vectors for immunization. In: Plotkin's Vaccines. 7. Auflage, Herausgeber: S. A. Plotkin, W. A. Orenstein, P. A. Offit und K. M. Edwards 2018. S. 1305–1319. doi:10.1016/B978-0-323-35761-6.00067-5.
- L. Li, N. Petrovsky: Molecular mechanisms for enhanced DNA vaccine immunogenicity. In: Expert review of vaccines. Band 15, Nummer 3, 2016, S. 313–329, doi:10.1586/14760584.2016.1124762, PMID 26707950, PMC 4955855 (freier Volltext).
- Rein Verbeke, Ine Lentacker, Stefaan C. De Smedt, Heleen Dewitte: Three decades of messenger RNA vaccine development. In: Nano Today. 28, 2019, S. 100766, doi:10.1016/j.nantod.2019.100766.
- M. Šimčíková, K. L. Prather, D. M. Prazeres, G. A. Monteiro: Towards effective non-viral gene delivery vector. In: Biotechnology & genetic engineering reviews. Band 31, Nummer 1–2, 2015 Apr-Oct, S. 82–107, doi:10.1080/02648725.2016.1178011, PMID 27160661.
- C. Poveda, A. B. Biter, M. E. Bottazzi, U. Strych: Establishing Preferred Product Characterization for the Evaluation of RNA Vaccine Antigens. In: Vaccines. Band 7, Nummer 4, September 2019, S. , doi:10.3390/vaccines7040131, PMID 31569760, PMC 6963847 (freier Volltext).
- S. C. Tan, B. C. Yiap: DNA, RNA, and protein extraction: the past and the present. In: Journal of biomedicine & biotechnology. Band 2009, 2009, S. 574398, doi:10.1155/2009/574398, PMID 20011662, PMC 2789530 (freier Volltext).
- L. Li, N. Petrovsky: Molecular mechanisms for enhanced DNA vaccine immunogenicity. In: Expert review of vaccines. Band 15, Nummer 3, 2016, S. 313–329, doi:10.1586/14760584.2016.1124762, PMID 26707950, PMC 4955855 (freier Volltext).
- P. Borah, P. K. Deb, N. A. Al-Shar'i, L. A. Dahabiyeh, K. N. Venugopala, V. Singh, P. Shinu, S. Hussain, S. Deka, B. Chandrasekaran, D. M. Jaradat: Perspectives on RNA Vaccine Candidates for COVID-19. In: Frontiers in Molecular Biosciences. Band 8, 2021, S. 635245, doi:10.3389/fmolb.2021.635245, PMID 33869282, PMC 8044912 (freier Volltext).
- K. Bloom, F. van den Berg, P. Arbuthnot: Self-amplifying RNA vaccines for infectious diseases. In: Gene therapy. Band 28, Nummer 3–4, April 2021, S. 117–129, doi:10.1038/s41434-020-00204-y, PMID 33093657, PMC 7580817 (freier Volltext).