Polioimpfstoff
Ein Polioimpfstoff ist ein Impfstoff zur Prophylaxe einer durch das Poliovirus hervorgerufenen Poliomyelitis. Zwei grundlegend verschiedene Impfstoffe stehen zur Verfügung: seit 1955 eine von Jonas Salk entwickelte inaktivierte Polio-Vakzine, abgekürzt IPV, sowie seit 1960 eine von Albert Sabin entwickelte orale Polio-Vakzine, abgekürzt OPV.[1] Mit dem Einsatz beider Impfstoffe, die jeweils spezifische Vor- und Nachteile haben,[2][3] wurde die Zahl der Poliomyelitis-Erkrankungen seit den 1950er Jahren weltweit drastisch reduziert.
Zur Grundimmunisierung von Kindern und Jugendlichen wird in Deutschland seit 1998 nur noch der inaktivierte Polioimpfstoff eingesetzt. Die Weltgesundheitsorganisation (WHO) hat mit einigen anderen Organisationen das Ziel, im Rahmen der 1988 beschlossenen Global Polio Eradication Initiative (GPEI)[4] das Poliovirus vor allem durch Impfungen mit OPV und abschließender Umstellung auf IPV[5] weltweit auszurotten.
Inaktivierter Polioimpfstoff (Salk, IPV)
Der inaktivierte Polioimpfstoff nach Salk, ein Totimpfstoff, ist der derzeit in Europa routinemäßig eingesetzte Impfstoff.
Herstellung
Virulente Polioviren der Typen 1, 2 oder 3 werden durch Zellkultur in Vero-Zellen, einer etablierten Zelllinie aus Nierenzellen der grünen Meerkatze, alternativ auch in humanen diploiden Zellen, vermehrt.[6] Aus dem Kulturmedium wird durch Filtration, Ultrafiltration und Chromatografie eine gereinigte Virussuspension erzeugt. Die sorgfältige Abtrennung von Zellbestandteilen ist eine Voraussetzung für die vollständige Virusinaktivierung. Diese erfolgt durch mehrtägige Behandlung mit Formaldehyd; durch chemische Reaktion des Formaldehyds mit Virusbestandteilen geht die Vermehrungsfähigkeit der Viren verloren. Nachdem keine infektiösen Viren mehr nachweisbar sind, wird das restliche Formaldehyd entfernt. Die Prüfung auf nicht inaktivierte Viren erfolgt in einem Zellkultur-Test, der Nachweis des Antigen-Gehalts wird mit einem ELISA-Test durchgeführt, oft auch ergänzt durch Tierversuche mit Ratten, die nach einer Testimpfung schützende Antikörper entwickeln müssen.
Der fertige Impfstoff, monovalent oder eine der Kombinationen aus inaktivierten Polioviren der Typen 1, 2 und/oder 3, enthält oft noch Spuren von Antibiotika wie Neomycin oder Streptomycin.
Anwendung
Der inaktivierte Polioimpfstoff wird intramuskulär injiziert. Heute wird der Impfstoff häufig als Bestandteil eines Kombinationsimpfstoffes, beispielsweise eines hexavalenten Impfstoffs, eingesetzt. Er kann auch bei Patienten mit einem Immundefekt angewendet werden, da kein infektiöses Virus enthalten ist. Einerseits sind Säuglinge von Müttern, die ihre Polio-Antikörper über die Plazenta auf das Ungeborene übertragen haben (Nestschutz), dadurch zunächst vor Polio geschützt,[7] andererseits führt die Impfung bei ihnen in dieser Zeit nur unzureichend zur Bildung eigener Antikörper.
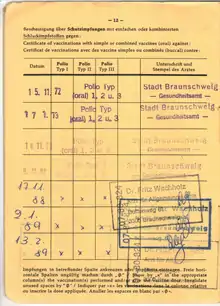
Nach Empfehlung der STIKO (und einigen anderen europäischen Ländern) wird die Grundimmunisierung durch ein „2+1-Schema“ realisiert (Impfung im 2. und 4. Monat, abschließend im 11. Monat), falls die einzelnen Impfungen zu den empfohlenen Zeitpunkten durchgeführt und das Impfschema rechtzeitig abgeschlossen wird.[8] Bei Frühgeborenen wird eine zusätzliche Impfstoffdosis im Alter von 3 Monaten empfohlen (sogenanntes „3+1-Schema“). Bei der Impfung handelt es sich in der Regel um Kombinationsimpfstoffe (z. B. mit azellulärer Pertussis- und Diphtheriekomponente). Sofern kein Kombinationsimpfstoff verwendet wird, werden je nach Impfstoff zwei bzw. drei Impfungen im 1. und 2. Lebensjahr durchgeführt.
Im Alter von 9–17 Jahren wird eine Auffrischimpfung mit einem IPV-haltigen Impfstoff empfohlen. Eine mit OPV begonnene Grundimmunisierung wird mit IPV komplettiert.[7]
Nebenwirkungen
Bei der Anwendung des inaktivierten Polioimpfstoffs gibt es kaum Nebenwirkungen. Sie beschränken sich in der Regel auf Schmerzen an der Injektionsstelle.
Kontraindikationen
Der Impfstoff soll nicht angewendet werden, wenn eine bekannte schwere Allergie gegen einen der Bestandteile vorliegt. Auch während einer akuten, schwerwiegenden und fieberhaften Erkrankung sollte nicht geimpft werden.
Wirkung
Die IPV schützt weitgehend unabhängig von Randbedingungen (Hygiene, Ernährungszustand, Durchfallerkrankungen) schon nach zwei Impfungen nahezu alle Geimpften vor den schweren Folgen der Infektion, insbesondere Lähmungen, sofern die erste Impfung erst in oder kurz nach der 8. Woche nach der Geburt und die zweite Impfung nach frühestens weiteren 8 Wochen erfolgt. Selbst in einem Land mit eingeschränkten hygienischen Bedingungen wie Puerto Rico haben nach drei Impfungen (zwei, vier und sechs Monate nach der Geburt) über 99,5 % der Geimpften schützende Antikörper gegen alle drei Poliovirus-Typen. Dieser Schutz hält vermutlich Jahrzehnte an.[2] Im Erwachsenenalter wird daher eine routinemäßige Auffrischung des Impfschutzes nur noch bei Personen mit einem erhöhten Risiko, an Polio zu erkranken, empfohlen. Dazu zählen Personen, die eine Reise in ein Endemiegebiet planen, aber auch medizinisches Personal.[7]
Fehlende sterile Immunität
Die IPV führt – anders als die OPV – nicht zu einer sterilen Immunität: Wiederholte Gaben von IPV erhöhen zwar die Immunität an den Schleimhäuten, dieser Booster-Effekt ist aber weniger wirksam als der nach OPV-Impfungen.[3] So erwerben mit IPV geimpfte Personen keinen zuverlässigen Schutz vor der Aufnahme von Polio-Viren vor allem über den Darm – etwa aus kontaminiertem Trinkwasser. Nach Infektion bleiben sie zwar selbst symptomfrei oder doch symptomarm, vermehren den Erreger aber unbemerkt und scheiden ihn vor allem über den Darm aus. Dadurch können IPV-Geimpfte den Erreger unter ungünstigen hygienischen Bedingungen an Dritte weiterverbreiten.[9] Das ergab beispielsweise die Untersuchung des Ausbruchs einer Polio-Epidemie in Israel im Jahr 2013.[10][11]
Risiko bei der Herstellung
Zur Herstellung der IPV werden vermehrungsfähige Viren verwendet. Dementsprechend hoch sind die Sicherheitsanforderungen an die Impfstoffhersteller. Die WHO empfiehlt für die Zeit nach der Ausrottung des Wildvirus für IPV-Herstellungseinrichtungen die Biologische Schutzstufe 3/Polio. Eine mögliche Lösung für dieses Problem könnte die Verwendung von attenuierten Viren zur Herstellung des inaktivierten Polioimpfstoffs sein.
Oraler Polioimpfstoff (Sabin, OPV)
%252C_Live_at_PRC70_Exhibition_(20191203153024).jpg.webp)
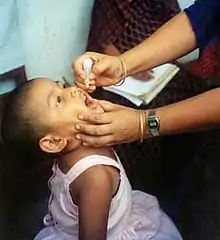
Der orale Polioimpfstoff nach Sabin, ein Lebendimpfstoff zur Schluckimpfung, war lange Zeit der in den meisten Ländern Europas eingesetzte Impfstoff; lediglich in Skandinavien und den Niederlanden wurde durchgehend der inaktivierte Impfstoff eingesetzt. Weil bei der Anwendung des oralen Impfstoffs (OPV) ein wenn auch extrem geringes Risiko einer sogenannten Vakzin-assoziierten paralytischen Poliomyelitis (VAPP, auch Impf-Poliomyelitis) besteht, hat die gerichtliche Behandlung von Impfschadensfällen dazu geführt, dass in Deutschland seit 1998 nur noch mit IPV geimpft wird. Dadurch wird jedoch die von der WHO angestrebte globale Ausrottung der Polioviren erschwert. Ein Team aus der Schweiz, das seit 2004 auf dieses Problem hinweist, empfiehlt deshalb ein sequenzielles Impfschema, bei dem zuerst IPV und danach OPV gegeben wird.[12] Der orale Polioimpfstoff wird wegen seiner Wirksamkeit, der niedrigen Kosten und der einfachen Anwendung nach wie vor in Ländern verwendet, in denen Poliomyelitis auftritt, um den Erreger einzudämmen und auszurotten. Ein vollständiger Schutz gegen Lähmungen durch das Virus wird in der Regel nach vier Impfungen erreicht.
Herstellung
Auch der orale Polioimpfstoff wird in Zellkulturen, meist in humanen diploiden Zellen, vermehrt. Allerdings kommen hierbei keine krankheitserregenden, sondern besondere, abgeschwächte Viren der Typen 1, 2 und 3 zum Einsatz. Diese Polioviren haben im Genom eine größere Anzahl von Mutationen, die dazu führen, dass eine Infektion mit diesen Viren keine Poliomyelitis mehr hervorruft. Zur Attenuierung wurden in den 1950er Jahren humane Polioviren der Typen 1 und 3 in mehreren Dutzend Passagen in Affen, teils bei niedrigen Temperaturen in Zellkulturen, teils in lebenden Tieren, vermehrt. Hierbei traten spontane Mutationen auf; solche, die die Virulenz verminderten, wurden ausgewählt und weiter gezüchtet. Für den Typ 2 wurde ein natürlich vorkommendes, abgeschwächtes Virus benutzt, das aus dem Stuhl eines gesunden Kindes isoliert worden war.[13]
Molekulare Analysen ergaben später, dass bei allen Impfviren Mutationen in der internen ribosomalen Eintrittsstelle im 5'-untranslatierten Bereich des Virusgenoms für den Verlust der Neurovirulenz verantwortlich sind.[14] Das mutierte Virus kann sich in Nervenzellen nicht vermehren; die Vermehrung im Darm wird aber nicht beeinträchtigt.
Referenzkulturen der Impfviren, die auf die von Sabin benutzten attenuierten Virenstämme zurückgehen, werden von der Weltgesundheitsorganisation für die Impfstoffherstellung zur Verfügung gestellt; die Hersteller vermehren diese Viren in einem Saatgutsystem. Die Viren werden für jeden Typ einzeln in Zellkultur bei 33 bis 35 °C kultiviert und durch Filtration gereinigt; die so gewonnene Virussuspension wird dann zur Sicherheit auf krankheitserregende Viren getestet.[6] Jahrzehntelang musste zu diesem Zweck jede Charge des Impfstoffes nach der Herstellung in Rhesusaffen getestet werden. Erst im Jahr 2000 wurde ein Neurovirulenztest in transgenen Mäusen, die einen humanen Rezeptor (CD155) für das Poliovirus tragen, von der Weltgesundheitsorganisation zugelassen.[15] Nach der Prüfung werden die Präparationen der einzelnen Virustypen gemischt. Oft enthalten auch orale Polioimpfstoffe Spuren von Antibiotika wie Neomycin.
Für Massenimpfungen werden insbesondere Impfstoffe mit nur einem Virus (monovalent OPV, „mOPV“) oder zwei Virustypen (bivalent OPV, „bOPV“) hergestellt und eingesetzt,[16] so in manchen Regionen Indiens, wo nur noch der Typ 1 endemisch ist, als mOPV1.[17] Die monvalenten Impfstoffe mOPV1 und mOPV3 wurden 2005, bivalente Impfstoffe 2009 eingeführt.[16]
Anwendung und Wirkung
Der orale Polioimpfstoff wird als Schluckimpfung angewendet; dabei wird der Impfstoff oft auf ein Stück Würfelzucker gegeben, das dann geschluckt wird. Die Impfung führt nach regelrechter Anwendung unter günstigen Randbedingungen bei nahezu 100 % der Geimpften[18] zu einer stillen Feiung, indem nach einer Infektion des Magen-Darm-Traktes ohne Krankheitssymptome zuverlässig vor den Lähmungen schützende Antikörpern nicht nur im Blut, sondern in Form von IgA auch in den Schleimhäuten des Darmes erzeugt werden. Da das Impfvirus nach der Impfung teilweise ausgeschieden wird, können durch das Impfvirus auch Kontaktpersonen infiziert werden, die auf diese Weise ebenfalls einen Impfschutz gewinnen („passive“ Immunisierung). Der orale Polioimpfstoff kann somit eine Herdenimmunität erzeugen. Das erklärt, dass die tatsächliche Wirksamkeit (efficiency) der OPV-Kampagnen gerade in Entwicklungsländern höher war als auf Grund dort manchmal ungünstiger Randbedingungen erwartet. Aus diesem Grund wird in Ländern, in denen das Poliovirus noch auftritt, trotz der bekannten Einschränkungen und Risiken durch VAPP und VDPV zumindest zu Beginn von Impfkampagnen noch der Lebendimpfstoff verwendet. Es kommt hinzu, dass der orale Impfstoff kostengünstig herzustellen und einfach anzuwenden ist.
In Deutschland und vielen anderen Polio-freien Ländern wird der orale Polioimpfstoff wegen seiner Risiken durch VAPP und VDPV nicht mehr regelmäßig angewandt; vorgesehen ist sein Einsatz nur noch als Riegelimpfung im Fall von Polio-Ausbrüchen nach Einschleppung aus dem Ausland. Auch weltweit wird die Verwendung des Lebendimpfstoffs mittelfristig eingestellt werden, nachdem das Ziel erreicht ist, das Wildvirus auszurotten.
Einfluss ungünstiger Randbedingungen
Die tatsächliche Wirksamkeit (efficiency) der OPV wird vor allem verringert durch:[18][17]
- mütterliche Leihantikörper bei Neugeborenen (nachteilig auch bei IPV),
- geringe intestinale Immun-Kompetenz bei mangelernährten Kindern,
- Durchfall und Darminfektionen,
- eingeschränkte Qualität des Impfstoffes (Kühlkette)
Durch solche ungünstigen Bedingungen kann die tatsächliche Wirksamkeit von OPV-Kampagnen deutlich absinken, so wurden in Ghana nach dreifacher OPV nur bei etwa 60 % der Geimpften neutralisierende Antikörper gegen alle 3 Poliovirus-Typen nachgewiesen.[19]
Kontraindikationen, Nebenwirkungen und Risiken
Der Lebendimpfstoff darf nicht bei Menschen mit Immundefekten eingesetzt werden; auch ein Einsatz bei Personen mit Kontakt zu Menschen mit Immundefekten sollte unterbleiben. Eine Überempfindlichkeit gegen einen der Inhaltsstoffe ist ebenfalls ein Ausschlusskriterium. Bei akuten fiebrigen Erkrankungen oder Darmstörungen sollte die Impfung verschoben werden. Die hohe Häufigkeit von Durchfällen bei Kindern ist eine Ursache für die Schwierigkeit, die Polio in Ländern wie Indien auszurotten. Bei Durchfall ist die Impfung oft nicht wirksam.
Die häufigsten Nebenwirkungen sind Kopfschmerzen, Erbrechen oder Durchfall. Ein wenn auch extrem selten eintretendes Risiko des oralen Polioimpfstoffs ist die Vakzin-assoziierte paralytische Poliomyelitis (vaccine-associated paralytic poliomyelitis, VAPP), die nach etwa 1 pro 2,7 Millionen Dosen des Impfstoffs auftritt und zumindest in manchen Fällen durch eine Immunschwäche ausgelöst wird.[5] Hintergrund ist die Art der Attenuierung der Impfviren (ausgeschaltete Neurovirulenz), da diese durch wenige Punktmutationen erfolgt.[12] In geimpften Personen können daher wenige Rückmutationen im Impfvirus (Revertanten) dazu führen, dass dieses wieder seine Neurotoxizität erlangt und das poliotypische Krankheitsbild verursacht. Bei der VAPP treten persistierende Lähmungen für einen Zeitraum von mindestens sechs Wochen auf.[20] Klinisch lassen sich die Symptome nicht von denen nach einer Wildvirus-Infektion unterscheiden, dies kann nur durch eine Laboranalyse erfolgen.[16] VAPP kann nach einer kürzlich erfolgten OPV-Gabe erfolgen.[21] Auch dem Geimpften engstehende Personen (beispielsweise Freunde oder Ehepartner) können nach Aufnahme der ausgeschiedenen Revertanten eine VAPP entwickeln, falls sie ungeimpft oder nicht gegen Polio immunisiert sind.[22] Nach einer OPV-Applikation kann ab und zu eine nur transiente Poliomyelitis beobachtet werden.[20]
In Deutschland kam es in der Zeit der Impfkampagnen mit OPV jährlich zu ein bis zwei Fällen von VAPP.[7] Hierbei trat die letzte VAPP im Jahr 2000 auf. Es handelte sich aber nicht um eine klassische VAPP, da die Erkrankte bereits zwei Jahre vorher (1998) mit OPV geimpft worden war.[23]
In noch selteneren Fällen kann das Virus nach OPV im Rahmen seiner Vermehrung zu einer vollständigen humanpathogenen Variante rückmutieren und dann in der Bevölkerung zirkulieren (zirkulierende, vom Impfstoff abgeleitete Polioviren bzw. circulating vaccine-derived poliovirus, cVDPV). Eine Nummer kennzeichnet dabei, um welchen der drei möglichen, rückmutierten Typen es sich handelt. Damit cVDPVs entstehen können, bedarf es mindestens 12 Monate in einer un- oder unterimmunisierten Population (eine ausreichend immunisierte Bevölkerung wäre gegen cVDPVs oder Polio-Wildviren geschützt). Wenn dieser Stamm mehr als 6 Monate zirkuliert, spricht man von persistierenden cVDPV.[22] Bis 2015 wurden über 90 % der untersuchten cVDPVs dem Typ 2 zugeordnet (cVDPV2).[24] Da das Polio-Wildvirus Typ 2 bereits 1999 ausgerottet war, wurde ab April 2016 bei Standardimmunisierungsprogrammen dem ehemals trivalenten OPV-Impfstoff die Typ 2-Komponente entfernt. VDPV wurden erstmals 2001 in Haiti und der dominikanischen Republik in 21 Fällen sicher nachgewiesen; inzwischen gibt es eine Reihe von derartigen Beispielen aus anderen Ländern.[13] Der bisher größte Fall mit 69 durch cVDPV erkrankten Kindern wurde 2007 in Nigeria bekannt.[25] Bei den cVDPV-Fällen handelt es sich meist um Polioviren der Typen 1 oder 2. 2019 wurde ein erster Fall von Polio seit Jahrzehnten auf den Philippinen von der WHO ebenfalls auf cVDPV zurückgeführt.[26] 2020 wurden in 14 Ländern Afrikas zusammen 172 cVDPV2-Fälle berichtet.[27]
Geschichte
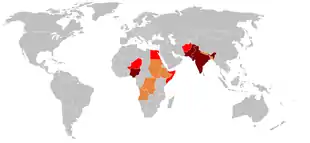
♦ Endemiegebiete
♦ Sporadische Erkrankungen
♦ Risiko der Wiedereinführung

Seit den 1930er Jahren gab es Versuche, einen Polioimpfstoff herzustellen, meist mit durch Formaldehyd inaktivierten Viren. Diese waren jedoch nicht wirksam. Erst 1954 konnte in den USA ein von Salk und Mitarbeitern hergestellter inaktivierter Polioimpfstoff in einer großen randomisierten klinischen Studie mit mehreren hunderttausend Kindern getestet werden. Eine Zulassung des Impfstoffes erfolgte unmittelbar nach Bekanntgabe der Studienergebnisse 1955.
Wenige Wochen nach Beginn des Routineeinsatzes des inaktivierten Impfstoffes in den USA kam es zu einem schweren Zwischenfall. Durch Mängel in der Produktion gelangten nicht inaktivierte Polioviren in den Impfstoff. Dadurch wurden mehrere hunderttausend Kinder infiziert, es kam zu 51 Fällen von dauerhafter Paralyse und zu fünf Todesfällen. Dieser nach dem Hersteller Cutter Laboratories benannte Cutter-Incident gilt als einer der schwersten Arzneimittelskandale in den USA. Untersuchungen ergaben, dass Reste von Zellkulturzellen in der Virussuspension die vollständige Inaktivierung durch Formaldehyd verhindert hatten.[28]
Parallel zu Salk entwickelten mehrere Wissenschaftler orale Polioimpfstoffe, darunter Albert Sabin. Erste Studien mit dem Sabin-Impfstoff wurden ab 1957 durchgeführt, eine erste Zulassung erfolgte in den USA 1961, seit 1963 war ein Dreifachimpfstoff gegen alle drei Virustypen zugelassen. Dieser wurde schnell zum Standard in vielen Ländern weltweit, bis Ende der 1990er Jahre viele entwickelte Länder dazu übergingen, wieder den inaktivierten Impfstoff einzusetzen, nachdem die Länder für Poliofrei erklärt worden waren.
Sowohl der inaktivierte Impfstoff als auch der orale Impfstoff waren teilweise bis Anfang der 1960er Jahre mit einem Affenvirus, dem SV40-Virus, kontaminiert. Möglicherweise kamen mehrere Millionen Menschen auf diesem Wege mit SV40 in Kontakt; es gibt allerdings keine adäquaten Belege dafür, dass es dadurch zu Erkrankungen kam.[29]
Aufgrund eines Angebotes der Sowjetunion und auf Empfehlung der WHO entwickelte Sabin Ende der 50er Jahre seinen Impfstoff gemeinsam mit dem sowjetischen Virologen Michail Petrowitsch Tschumakow (1909–1993) weiter, der dann 1958/1959 in klinischen Studien erprobt und als Sabin-Tschumakow-Impfstoff produziert, in der DDR und anderen Ländern des Ostblocks, aber auch in Mexiko und den Niederlanden verabreicht wurde. Gleichzeitig wurde in den USA und Westeuropa aufgrund medizinischer, aber auch ideologischer Vorbehalte weiter primär auf die Injektionen nach Salk gesetzt. In West-Berlin erhielten 1960 etwa 280.000 Kinder eine Schluckimpfung mit einem experimentellen Präparat nach Herald R. Cox, weil man das Eindringen abgeschwächter Polioviren aus dem bereits stark durchimpften Ost-Berlin befürchtete,[30] aber den Ostblock-Impfstoff nicht verwenden wollte. Angesicht von mehr als 400 neuen Poliofällen in Nordrhein-Westfalen bot der stellvertretende DDR-Ministerpräsident Willi Stoph im Juni 1961 der Bundesregierung drei Millionen Impfdosen aus sowjetischer Produktion an.[31][32] Die bundesdeutsche Verwaltung erklärte daraufhin, dass man nicht mit einem Stoff impfen könne, dessen Wirksamkeit und Restrisiko lediglich durch Studien aus dem Ostblock belegt seien.[33] Zudem spielten ideologische Ressentiments eine Rolle, so schätzte der damalige Bundeskanzler Konrad Adenauer das Hilfsangebot als Propaganda im Kalten Krieg ein.[31] In der DDR trat Polio aus Wildviren letztmals 1962 auf. In der Bundesrepublik wurde mit der Schluckimpfung flächendeckend erst 1962 begonnen, mit ähnlichem Erfolg.[34]
Seit 1988 hat die Weltgesundheitsorganisation sich das Ziel gesetzt, das Poliovirus durch eine weltweite Impfkampagne auszurotten. Auch wenn das ursprüngliche Ziel, dies bis 2000 zu erreichen, verfehlt wurde, gelang es, weite Teile der Erde als Poliofrei zu deklarieren. Das Poliovirus vom Typ 2 ist bereits seit 1999 nicht mehr nachgewiesen. 2007 gab es weltweit 1310 Fälle von Poliomyelitis durch Wildviren. 2008 waren Viren vom Typ 1 und 3 noch in vier Ländern endemisch: Nigeria, Indien, Pakistan und Afghanistan.[35] Am 5. Mai 2014 hat die World Health Organization (WHO) zur aktuell wieder zunehmenden Polioausbreitung eine „Gesundheitliche Notlage mit internationaler Tragweite“ (“Public Health Emergency of International Concern [PHEIC]”) erklärt und für bestimmte Konstellationen vorgezogene Auffrischimpfungen gegen Polio empfohlen. Diese teilweise temporären Empfehlungen werden auf der Informationsseite des Auswärtigen Amts bereitgestellt.[36] 2015 wurde Typ 2 durch die WHO als ausgerottet erklärt. Im April 2016 wurde ein koordiniertes Programm gestartet, um schrittweise den Einsatz von oralen Impfstoffen mit Viren aller drei Stämme zunächst durch orale Impfstoffe mit nur noch den Typen 1 und/oder 3 umzustellen, anschließend, um Rückmutationen zu humanpathogenen cVDPV zu verhindern, orale Impfstoffe insgesamt zu ersetzen durch IPV, die nur noch die Typen 1 und 3 enthalten.[5] Am Welt-Poliotag 2019 erklärte die WHO auch Typ 3 für ausgerottet.[37] Seit August 2020 gilt der Wildtyp des Poliovirus in der WHO-Region Afrika als ausgerottet.[38]
Seit dem Jahr 2000 wurden mehr als 3 Milliarden Kinder gegen Kinderlähmung geimpft.[39]
Literatur
- David M. Knipe, Peter M. Howley (Red.): Fields’ Virology. 5. Auflage. 2 Bände, Philadelphia 2007, ISBN 0-7817-6060-7, S. 878–884.
Einzelnachweise
- Sabine Reiter: Poliomyelitis. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 257, doi:10.1055/b-0035-127596.
- T. Jacob John: Role of injectable and oral polio vaccines in polio eradication, online 9. Januar 2014, abgerufen am 10. Oktober 2019, https://doi.org/10.1586/14760584.8.1.5
- Matthew R. Behrend et al.: A quantitative survey of the literature on poliovirus infection and immunity. In: International journal of infectious diseases: IJID: official publication of the International Society for Infectious Diseases. Band 18, Januar 2014, S. 4–13, doi:10.1016/j.ijid.2013.09.005, PMID 24246740.
- Global Polio Eradication Initiative
- WHO: Poliomyelitis und Impfstoffe zu ihrer Ausrottung – Fragen und Antworten, online 8. April 2016
- Technische Informationen der WHO zur Herstellung von Polioimpfstoffen
- Merkblatt Poliomyelitis des Robert Koch-Instituts
- Epidemiologisches Bulletin 26/2020. In: RKI. 25. Juni 2020, abgerufen am 31. Dezember 2020.
- Robert Koch-Institut: Schutzimpfung gegen Poliomyelitis: Häufig gestellte Fragen und Antworten – OPV gegenüber IPV, Stand 8. November 2013, Abruf 20. September 2019.
- ECDC: Epidemiological update: Polio virus in sewage and human faecal samples in Israel, August 2013, online 20. August 2013, Abruf 20. September 2019.
- Robert Koch-Institut: Epidemiologisches Bulletin 47/2013, Abruf 20. September 2019.
- H. Knolle et al.: Die Perspektive der globalen Ausrottung der Poliomyelitis. In: Das Gesundheitswesen. Band 66, Nr. 1, 2004, ISSN 0941-3790, S. 1–6, doi:10.1055/s-2004-812828.
- Olen M. Kew et al.: Vaccine-derived polioviruses and the endgame strategy for global polio eradication. In: Annual Review of Microbiology. Band 59, 2005, S. 587–635, doi:10.1146/annurev.micro.58.030603.123625, PMID 16153180.
- Nidia H. De Jesus: Epidemics to eradication: the modern history of poliomyelitis. In: Virology Journal. Band 4, 10. Juli 2007, S. 70, doi:10.1186/1743-422X-4-70, PMID 17623069, PMC 1947962 (freier Volltext).
- Eugenia Dragunsky et al.: Transgenic mice as an alternative to monkeys for neurovirulence testing of live oral poliovirus vaccine: validation by a WHO collaborative study. In: Bulletin of the World Health Organization. Band 81, Nr. 4, 2003, S. 251–260, PMID 12764491, PMC 2572431 (freier Volltext).
- Poliomyelitis. In: WHO. 4. September 2020, abgerufen am 5. September 2020 (englisch).
- Nicholas C. Grassly et al.: Protective efficacy of a monovalent oral type 1 poliovirus vaccine: a case-control study. In: Lancet (London, England). Band 369, Nr. 9570, 21. April 2007, S. 1356–1362, doi:10.1016/S0140-6736(07)60531-5, PMID 17448821.
- WHO: Weekly epidemiological record, Ausgabe 91 Nr. 12 von März 2016, Seiten 145-168, pdf (597 kB)
- Joseph Kl Opare et al.: Poliovirus neutralizing antibody levels among individuals in three regions of Ghana. In: Ghana Medical Journal. Band 53, Nr. 2, Juni 2019, S. 170–180, doi:10.4314/gmj.v53i2.13, PMID 31481814, PMC 6697761 (freier Volltext).
- Burghard Stück et al.: Neue Impfstrategie gegen Poliomyelitis: Lebend-Vakzine oder Inaktivierte Vakzine? Deutsches Ärzteblatt, 17. Oktober 1997, abgerufen am 7. Januar 2020.
- Lauren R. Platt et al.: Vaccine-Associated Paralytic Poliomyelitis: A Review of the Epidemiology and Estimation of the Global Burden. In: The Journal of Infectious Diseases. Band 210, suppl_1, 1. November 2014, S. S380–S389, doi:10.1093/infdis/jiu184.
- Vaccine-associated paralytic polio (VAPP) and vaccine-derived poliovirus (VDPV). (PDF) In: WHO. Februar 2015, abgerufen am 4. April 2021 (englisch).
- Epidemiologisches Bulletin 7/2002 - Impfpräventable Krankheiten in Deutschland bis zum Jahr 2000. (PDF) RKI, 15. Februar 2002, abgerufen am 7. Januar 2020.
- What is vaccine-derived polio? In: WHO. 19. April 2017, abgerufen am 5. September 2020 (englisch).
- Vaccine-derived poliomyelitis in Nigeria. In: Lancet. 2007 Oct 20;370(9596), S. 1394, PMID 17950846.
- Erster Fall von Polio auf Philippinen seit Jahrzehnten, Deutsches Ärzteblatt, online 19. September 2019, Abruf 22. September 2019
- Circulating vaccine-derived poliovirus type 2 – Sudan. In: WHO. 1. September 2020, abgerufen am 5. September 2020 (englisch).
- Paul A. Offit: The Cutter incident, 50 years later. In: The New England Journal of Medicine. Band 352, Nr. 14, 7. April 2005, S. 1411–1412, doi:10.1056/NEJMp048180, PMID 15814877.
- Danielle L. Poulin und James A. DeCaprio: Is there a role for SV40 in human cancer? In: Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. Band 24, Nr. 26, 10. September 2006, S. 4356–4365, doi:10.1200/JCO.2005.03.7101, PMID 16963733.
- Lea Münch: Polioschluckimpfung in Westberlin 1960. In: Monatsschrift Kinderheilkunde. 18. Oktober 2019, ISSN 1433-0474, doi:10.1007/s00112-019-00794-x.
- Von Pocken bis Corona: Die Geschichte des Impfens. In: Norddeutscher Rundfunk. 19. November 2021, abgerufen am 21. November 2021.
- Malte Thießen: Vorsorge als Ordnung des Sozialen. Impfen in der Bundesrepublik und DDR. In: Zeithistorische Forschungen. Leibniz-Zentrum für Zeithistorische Forschungen Potsdam, 12. Januar 2021, abgerufen am 21. November 2021.
- Aus dem Schnapsglas. In: Der Spiegel. 19. Juli 1961, ISSN 0038-7452 (spiegel.de [abgerufen am 29. März 2021] Online).
- Sabine Reiter: Poliomyelitis. In: Heinz Spiess, Ulrich Heininger, Wolfgang Jilg (Hrsg.): Impfkompendium. 8. Auflage. Georg Thieme Verlag, 2015, ISBN 978-3-13-498908-3, S. 258, doi:10.1055/b-0035-127596.
- Centers for Disease Control and Prevention (CDC): Progress toward interruption of wild poliovirus transmission--worldwide, January 2007-April 2008. In: MMWR. Morbidity and mortality weekly report. Band 57, Nr. 18, 9. Mai 2008, S. 489–494, PMID 18463607.
- Aktuelle reisemedizinische Hinweise (Stand 2019). Auswärtiges Amt, 18. Juni 2019, abgerufen am 13. Oktober 2019.
- Two out of three wild poliovirus strains eradicated: Global eradication of wild poliovirus type 3 declared on World Polio Day, online 24. Oktober 2019, abgerufen am 24. Oktober 2019
- https://www.zdf.de/nachrichten/panorama/afrika-polio-kinderlaehmung-100.html
- Dr Thomas Schmitz, Sven Siebert: Klartext: Impfen! - Ein Aufklärungsbuch zum Schutz unserer Gesundheit. 1. Auflage. HarperCollins, 2019, ISBN 978-3-95967-884-1, S. 125.