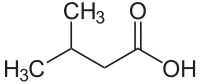
Fettsäuren
Fettsäuren sind aliphatische Monocarbonsäuren mit zumeist unverzweigter Kohlenstoffkette, die entweder gesättigt oder ungesättigt sind. Die Bezeichnung „Fettsäuren“ fußt auf der Erkenntnis, dass natürliche Fette und Öle aus den Estern langkettiger Carbonsäuren mit Glycerin bestehen. Aus dieser Sicht werden Fettsäuren auch zu den Lipiden gezählt. Später wurden auch alle anderen Alkylcarbonsäuren und deren ungesättigte Vertreter den Fettsäuren zugeordnet.[1]
Allgemeines und Struktur
Fettsäuren unterscheiden sich durch die Anzahl der C-Atome (Kettenlänge) sowie – bei ungesättigten Fettsäuren – in der Anzahl und Position von Doppelbindungen. Fettsäuren können aufgrund ihrer Kettenlängen in niedere, kurzkettige Fettsäuren (bis 6–8 C-Atome) (SCFA; Short Chain Fatty Acids), wobei hier die untere Grenze unterschiedlich aufgefasst wird, entweder 1, 2, 3 oder 4 C-Atome, mittlere, mittelkettige (6–8 bis 12 C-Atome) (MCFA; Middle Chain Fatty Acids) und höhere, langkettige (13 bis 21 C-Atome) (LCFA; Long Chain Fatty Acids) Fettsäuren eingeteilt werden. Fettsäuren mit mehr als 22 C-Atomen werden auch als VLCFAs (Very Long Chain Fatty Acids) bezeichnet.
Die Namensgebung als „Fettsäure“ suggeriert, dass eine individuelle Verbindung einmal eine Komponente eines Fettes gewesen sein muss, um eine Fettsäure zu sein, was aber nicht zwangsläufig der Fall ist. Unter diesem Begriff werden heute Carbonsäuren mit (kettenförmigen) Organylgruppen zusammengefasst.
Natürliche Fettsäuren bestehen in der Regel aus einer geraden Zahl von Kohlenstoffatomen und sind unverzweigt. Ausnahmen davon lassen sich jedoch in allen Reichen finden.[2][3] Eine Definition ist, dass die Kohlenstoffkette mindestens vier C-Atome lang sein muss; danach ist Buttersäure die einfachste natürliche Fettsäure. Eine andere Definition nutzt die Formel CH3(CH2)xCOOH, wobei x die Anzahl der Kohlenstoffatome in der Kohlenwasserstoffkette ist; hier können dann nur drei C-Atome vorhanden sein, wenn x = 1 ist, oder nur zwei, wenn x = 0 gesetzt wird; jedoch kann bei x = 0 strenggenommen nicht von einer „Kette“ gesprochen werden. Fettsäuren mit C=C-Doppelbindungen werden „ungesättigt“ genannt. Diese Doppelbindung ist in der Regel cis-konfiguriert. Liegen zwei oder mehrere Doppelbindungen vor, sind diese in der Regel durch jeweils eine Methylengruppe (-CH2-) voneinander getrennt.
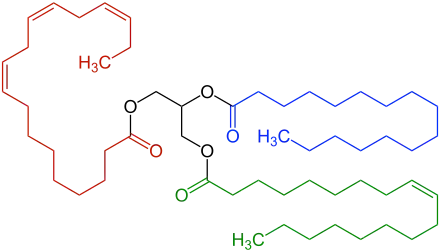
Eine große Vielfalt von Fettsäuren (mehr als 400 verschiedene Strukturen, wovon aber nur etwa 10–12 häufig sind) kommt – meist in Form der Triacylglyceride, also verestert mit Glycerin – in den Samenölen des Pflanzenreichs vor.[4] Seltene Fettsäuren, die verestert in größeren Prozentgehalten in Samen bestimmter Pflanzenfamilien auftreten, können entwicklungsgeschichtliche Zusammenhänge illustrieren (Verwandtschaftsbeziehungen, Chemotaxonomie, Evolution; vgl. z. B. auch Weltwirtschaft) wie zum Beispiel Petroselinsäure, Taririnsäure, Erucasäure, Cyclopentenfettsäuren und Cyclopropenfettsäuren. Manche Bakterienarten können anhand ihrer Fettsäurenzusammensetzung unterschieden werden.
Essenzielle Fettsäuren bezeichnen Fettsäuren, die ein Organismus benötigt, aber nicht selbst herstellen kann. Für Säugetiere sind solche Fettsäuren essenziell, die eine oder mehrere Doppelbindungen an höheren Positionen als C-9 (vom Carbonyl-Kohlenstoff aus gezählt) besitzen, da ihnen die Enzyme fehlen, solche Doppelbindungen einzufügen. Für den Menschen sind dies streng genommen nur Linolsäure und α-Linolensäure.
Fettsäuren werden in der Lebensmittelindustrie hauptsächlich als Rohstoff für verschiedene Emulgatoren verwendet, daneben jedoch auch als Trägerstoffe, Trennmittel (z. B. in Kaugummi) oder als Überzugsmittel (z. B. für Obst). Sie sind in der EU als Lebensmittelzusatzstoff der Sammelbezeichnung E 570 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Die Natrium- oder Kalium-Salze der höheren Fettsäuren sind als Seifen bekannt und werden als Tenside verwendet.
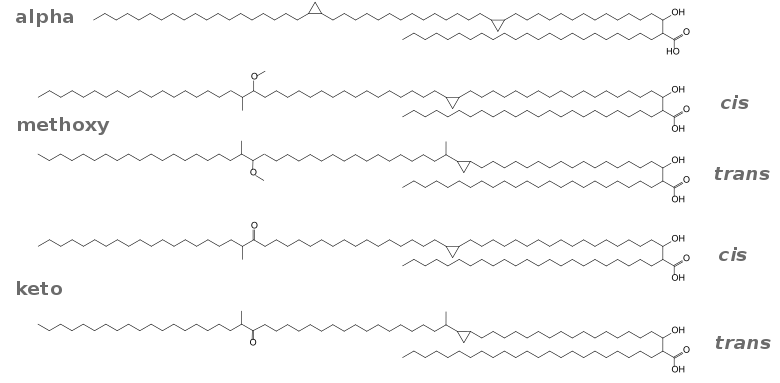
Gesättigte und ungesättigte Fettsäuren

.jpg.webp)
Eine gesättigte Fettsäure (SFA, von engl. saturated fatty acids) ist – als Untergruppe der Alkansäuren – eine Fettsäure, die keine Doppelbindungen zwischen C-Atomen aufweist. Die gesättigten Fettsäuren bilden eine homologe Reihe mit der Summenformel CnH2n+1COOH. Gesättigte Fette finden sich hauptsächlich in Lebensmitteln tierischen Ursprungs (Fleisch, Milchprodukte) und kommen nur in geringen Mengen in Lebensmitteln pflanzlichen Ursprungs vor. Ausnahmen sind Kokosfett oder Palmfett.[5]
Ungesättigte Fettsäuren besitzen als Alkensäuren mindestens eine C=C-Doppelbindung (MUFA, von engl. Monounsaturated fatty acids). Mehrfach ungesättigte Fettsäuren (PUFA, von engl. Polyunsaturated fatty acids) besitzen zwei oder mehr Doppelbindungen zwischen den Kohlenstoffatomen der Kette. Da in natürlichen Fettsäuren die Doppelbindungen meist in der cis-Konfiguration vorliegen, entsteht ein Knick von etwa 30° in der Kohlenwasserstoffkette. Dadurch ist die Van-der-Waals-Wechselwirkung zu anderen Molekülen abgeschwächt; der Schmelzpunkt wird verringert. Einige ungesättigte Fettsäuren sind für den Menschen essentiell, da sie der menschliche Körper nicht synthetisieren kann, sie aber benötigt. Dazu zählen Fettsäuren, die Doppelbindungen an bestimmten Positionen tragen, die Omega-n-Fettsäuren.
Man unterscheidet einfach (Monoensäuren), doppelt (Diensäuren), dreifach (Triensäuren) oder mehrfach (Polyensäuren) ungesättigte Fettsäuren.
Nomenklatur (cis, trans, ω)
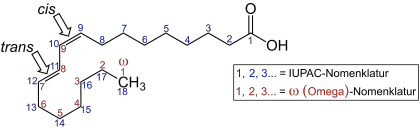
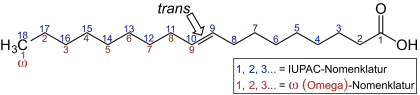
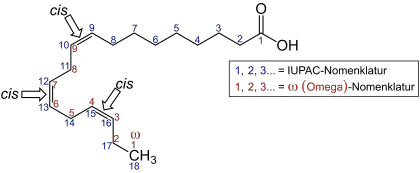
In den Omega-n-Fettsäuren steht n für eine Zahl und beschreibt die Position einer der Doppelbindungen. Bei der in der Lebensmittelchemie oft benutzten Omega-Zählweise wird vom „ω-Ende“ der Kohlenstoffkette aus gezählt, das der Carboxygruppe gegenübersteht. Die Doppelbindung nahe der Carboxygruppe erhält daher die größte Zahl; die Position der dem ω-Ende am nächsten stehenden Doppelbindung bestimmt den Typ der Omega-n-Fettsäure. In der Abbildung der Linolensäure ist die ω-Zählweise in rot dargestellt. Für die Einteilung in die verschiedenen Gruppen der Omega-n-Fettsäuren ist nur die als erstes gezählte Doppelbindung entscheidend.
Neben ungesättigten Fettsäuren in der cis-Konfiguration kommen in seltenen Fällen in der Natur auch Fettsäuren mit trans-konfigurierten Doppelbindungen vor, die trans-Fettsäuren. Glyceride der trans-Fettsäuren fallen teilweise als unerwünschtes Nebenprodukt bei der Margarineherstellung an und stehen unter Verdacht, gesundheitsschädliche Eigenschaften zu haben.[6] Insbesondere wird in der Literatur die negative Beeinflussung der koronaren Herzkrankheit angeführt.
Liegen mehrere Doppelbindungen – genauer C=C-Doppelbindungen – in einer Fettsäure vor, sind diese in der Regel – analog der oben rechts gezeigten Linolensäure – durch eine Methylengruppe (CH2-Gruppe) voneinander getrennt, man spricht dann von Isolensäuren. Sind die Doppelbindungen durch zwei oder mehrere Methylengruppen voneinander getrennt, so nennt man diese speziellen Fettsäuren bis- oder polymethylen-unterbrochene oder nicht-methylen-unterbrochene Isolensäuren (NMI; Non-Methylene-Interrupted oder PMI; Poly-Methylene-Interrupted).
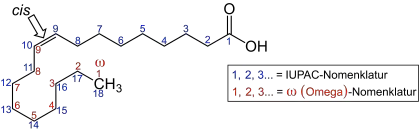
Es existieren jedoch auch konjugierte Fettsäuren (Konjuensäuren), bei denen die Doppelbindungen enger beieinander, nämlich konjugiert vorliegen. In der Abbildung der Rumensäure Octadeca-9c,11t-diensäure liegen die Doppelbindungen konjugiert vor. Da eine der Doppelbindungen hier als trans-Doppelbindung vorliegt, ist dies gleichzeitig eine trans-Fettsäure. Für die Bildung dieser Fettsäuren sind oft Bakterien im Verdauungstrakt der Wiederkäuer Ursache. Konjugierte Fettsäuren sind daher in allen Milchprodukten vertreten.
Ungeradzahlige Fettsäuren
Fettsäuren mit einer ungeraden Anzahl von Kohlenstoffatomen besitzen geringe Bedeutung und entstehen unter anderem durch die α-Oxidation aus Fettsäuren mit geradzahligen Kohlenstoffatomen. Beim Menschen betrifft dies vor allem die Phytansäure und die Pristansäure, welche anschließend in der β-Oxidation zu Propionyl-CoA abgebaut wird.
Verzweigte Fettsäuren
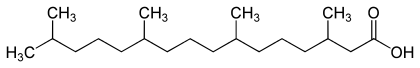
Niedere Fettsäuren mit Verzweigungen in der Kohlenstoffkette finden sich in einigen ätherischen Ölen. So enthalten die Extrakte aus Baldrian Ester der Isovaleriansäure.
Phytansäure (3,7,11,15-Tetramethylhexadecansäure) ist eine verzweigtkettige Carbonsäure, die als Abbauprodukt des Chlorophylls auftritt. In vielen Nahrungsmitteln (z. B. der Milch) sind Spuren dieser Verbindung zu finden. Die krankhafte Unfähigkeit zum Abbau dieser Carbonsäure führt zum Refsum-Syndrom.
Verzweigtkettige Fettsäuren finden sich in den Membranen zahlreicher Prokaryoten. Ihr Vorkommen wird genutzt, um eine Bakterienart zu identifizieren und um verwandtschaftliche Beziehungen der Organismen zu erforschen. Vor allem Fettsäuren mit einer Methylgruppe als Verzweigung in der Nähe vom „ω-Ende“ der Kohlenstoffkette sind von Bedeutung, wie die iso-Pentadecansäure (Methylgruppe am vorletzten Kohlenstoffatom) und die anteiso-Pentadecansäure (Methylgruppe am vorvorletzten Kohlenstoffatom).[7] Sie kommen in geringen Mengen auch im Milchfett vor.[8] Man geht davon aus, dass sie durch Bakterien im Pansen produziert werden und von den Kühen aufgenommen und in deren Fettgewebe bzw. im Milchfett eingelagert werden.[9]
Verzweigtkettige Fettsäuren werden auch als (BCFA; Branched Chain Fatty Acids) bezeichnet.
Zyklische Fettsäuren
Zyklische Fettsäuren oder auch CFAM (Cyclic Fatty Acid Monomers), sind Fettsäuren mit einem intramolekularen Ring aus 3, 5 oder 6 C-Einheiten, gesättigt oder mit Doppelbindung(en) im Ring. Z. B. Sterculiasäure und Chaulmoograsäure; siehe unter weitere Fettsäuren.
Liste von Fettsäuren und kürzeren Monocarbonsäuren
| Gesättigte Fettsäuren und kürzere Monocarbonsäuren | ||||||
|---|---|---|---|---|---|---|
| Zahl der C-Atome : Doppelbindungen | Trivialname | Chemische Bezeichnung | Bruttoformel | Vorkommen | Schmelzpunkt[10] | Siedepunkt[10] |
| 1:0 | Ameisensäure | Methansäure | HCOOH | Weitverbreitet, in fast allen Organismen | 8,3 °C | 101 °C |
| 2:0 | Essigsäure | Ethansäure | CH3COOH | Essig (durch Oxidation von Ethanol) | 16,6 °C | 118 °C |
| 3:0 | Propionsäure | Propansäure | C2H5COOH | Zwischenprodukt bei der Methangärung | −20,5 °C | 141 °C |
| 4:0 | Buttersäure | Butansäure | C3H7COOH | Milchfett, Schweiß, einfachste Fettsäure | −5,1 °C | 164 °C |
| 5:0 | Valeriansäure | Pentansäure | C4H9COOH | Baldrianwurzel, Holzessig | −34 °C | 186 °C |
| 6:0 | Capronsäure | Hexansäure | C5H11COOH | Milchfett, entsteht bei Buttersäuregärung | −4 °C | 205 °C |
| 7:0 | Önanthsäure | Heptansäure | C6H13COOH | als Ester im Kalmusöl (Acorus calamus) | −7,2 °C | 222 °C |
| 8:0 | Caprylsäure | Octansäure | C7H15COOH | Milchfett, Kokosfett | 16,5 °C | 239 °C |
| 9:0 | Pelargonsäure | Nonansäure | C8H17COOH | ätherisches Öl von Pelargonium roseum, Käse, Fuselöl, Wein | 12,4 °C | 254 °C |
| 10:0 | Caprinsäure | Decansäure | C9H19COOH | Tier- und Pflanzenfette | 31,4 °C | 269 °C |
| 11:0 | – | Undecansäure | C10H21COOH | Ätherische Öle (Iris- und Quendelöl Thymus serpyllum) | 28,5–29,3 °C | 280 °C |
| 12:0 | Laurinsäure | Dodecansäure | C11H23COOH | Milchfett, Pflanzenfette | 43,8 °C | 225 °C (100 Torr) |
| 13:0 | – | Tridecansäure | C12H25COOH | Pflanzenöle | 41,5 °C | 236 °C (100 Torr) |
| 14:0 | Myristinsäure | Tetradecansäure | C13H27COOH | Milchfett, Fischöl, Tier- und Pflanzenfette | 54,2 °C | 250 °C (100 Torr) |
| 15:0 | – | Pentadecansäure | C14H29COOH | Milch- und Körperfett von Wiederkäuern, Fischöl | 52,3 °C | 257 °C (100 Torr) |
| 16:0 | Palmitinsäure | Hexadecansäure | C15H31COOH | Tier- und Pflanzenfette | 62,5–63 °C[11] | 351,5 °C |
| 17:0 | Margarinsäure | Heptadecansäure | C16H33COOH | Tier- und Pflanzenfette | 61,3 °C | 227 °C (100 Torr) |
| 18:0 | Stearinsäure | Octadecansäure | C17H35COOH | Tier- und Pflanzenfette | 69,2–69,9 °C[12] | 350 °C (Zers.) |
| 19:0 | – | Nonadecansäure | C18H37COOH | Rinderfett, Dill (Anethum graveolens) | 69,4 °C | 297 °C (100 Torr) |
| 20:0 | Arachinsäure | Eicosan-/Icosansäure | C19H39COOH | in geringen Mengen in Pflanzensamen und Tierfetten | 75,5 °C | 328 °C (Zers.) |
| 21:0 | – | Heneicosansäure | C20H41COOH | in Pilzen der Gattung Armillaria (4–5 % der Fettsäuren) und in wenigen Pflanzen | 74–75 °C | |
| 22:0 | Behensäure | Docosansäure | C21H43COOH | in geringen Mengen in Pflanzensamen und Tierfetten, bei Morbus Gaucher | 79,5–80,5 °C | |
| 24:0 | Lignocerinsäure | Tetracosansäure | C23H47COOH | Holz, Teer, Erdnussöl, einige Pflanzenfette, Bestandteil der Sphingomyeline | 81,5–84,5 °C[12] | |
| 26:0 | Cerotinsäure | Hexacosansäure | C25H51COOH | Bienenwachs, Carnaubawachs, Montanwachs, Wollschweiß | 87,7–88,5 °C[12] | |
| 28:0 | Montansäure | Octacosansäure | C27H55COOH | Montanwachs, Bienenwachs, Chinawachs | 91–93 °C | |
| 30:0 | Melissinsäure | Triacontansäure | C29H59COOH | Bienenwachs, Selinum-, Trichosanthes- und Pericampylus-Arten | 92–94 °C | |
| 32:0 | Laccersäure | Dotriacontansäure | C31H63COOH | in Wachsen | 96 °C | |
| 34:0 | Geddinsäure | Tetratriacontansäure | C33H67COOH | in Wachsen | 98,4 °C | |
| Einfach ungesättigte Fettsäuren | ||||||
|---|---|---|---|---|---|---|
| Zahl der C-Atome : Doppelbindungen | Trivialname | Bruttoformel | Stellung der Doppel- bindung | Vorkommen | Schmelzpunkt | Chemische Bezeichnung |
| 11:1 | Undecylensäure | C10H19COOH | 10 | Salicornia brachiata (südasiatische Halophyte) | 24,5 °C | (10Z)- Undeca- 10- ensäure |
| 14:1 | Myristoleinsäure | C13H25COOH | 9 | seltene Fettsäure in wenigen Pflanzenölen, z. B. in Samen der Gattung Myristicaceae (Muskatnussgewächse) | −4,5 °C | (9Z)- Tetradeca- 9- ensäure |
| 16:1 | Palmitoleinsäure | C15H29COOH | 9 | Milchfett, Depotfett der Tiere, Fischtran, Pflanzenfett | 1 °C | (9Z)- Hexadeca- 9- ensäure |
| 17:1 | Margaroleinsäure | C16H29COOH | 9 | Depotfett der Tiere, Pflanzenfette | 11,4–12,2 °C, 14,5 °C[13] | (9Z)-Heptadeca- 9- ensäure |
| 18:1 | Petroselinsäure | C17H33COOH | 6 | in Korianderöl (Echter Koriander) | 29,8 °C | (6Z)- Octadeca- 6- ensäure |
| Ölsäure (OA) | 9 | in allen Naturfetten | 16 °C | (9Z)- Octadeca- 9- ensäure | ||
| Elaidinsäure1 | im Fett von Wiederkäuern | 44–45 °C | (9E)- Octadeca- 9- ensäure | |||
| Vaccensäure | 11 | im Fett von Wiederkäuern | 44 °C (trans), 14,5–15,5 °C (cis) | (11E)(11Z)- Octadeca- 11- ensäure | ||
| 20:1 | Gadoleinsäure | C19H37COOH | 9 | Pflanzenöle, Kohl-Arten (Brassica); Raps- und Brokkolisamenöl, Senföl, Fischöle | 24,5 °C | (9Z)- Eicosa- 9- ensäure |
| Gondosäure | 11 | in Jojoba-Öl, Seifenbaumgewächsen (Sapindaceae), Kohl-Arten (Brassica), Rapsöl (alte Sorten), Leindotteröl | 24 °C | (11Z)- Eicosa- 11- ensäure | ||
| 22:1 | Cetoleinsäure | C21H41COOH | 11 | Pflanzenöle, Fischöle | 32–33 °C[14] | (11Z)- Docosa- 11- ensäure |
| Erucasäure | 13 | Rapsöl (alte Sorten), Senföl | 33,5 °C[14] | (13Z)- Docosa- 13- ensäure | ||
| 24:1 | Nervonsäure | C23H45COOH | 15 | Samenöl des seltenen Baums Malania oleifera aus der Familie Olacaceae[15] | 42–43 °C | (15Z)- Tetracosa- 15- ensäure |
| Mehrfach ungesättigte Fettsäuren | ||||||
|---|---|---|---|---|---|---|
| Zahl der C-Atome : Doppelbindungen | Trivialname | Bruttoformel | Stellung der Doppel- bindungen | Vorkommen | Schmelzpunkt | Chemische Bezeichnung |
| 18:2 | Linolsäure (LA) | C17H31COOH | 9,12 | Pflanzenöle, insbesondere Distelöl, Sonnenblumenöl und Traubenkernöl | −7 °C[16] | (9Z,12Z)- Octadeca- 9,12- diensäure |
| 18:3 | Alpha-Linolensäure2 (ALA) | C17H29COOH | 9,12,15 | einige Pflanzenöle, insbesondere Leinöl, Walnussöl, Hanföl, Rapsöl und Sojaöl | −11 °C | (9Z,12Z,15Z)- Octadeca- 9,12,15- triensäure |
| Gamma-Linolensäure2 (GLA) | 6,9,12 | in wenigen Pflanzenölen wie Borretschöl, Nachtkerzenöl und Hanföl | −11 °C | (6Z,9Z,12Z)- Octadeca- 6,9,12- triensäure | ||
| Calendulasäure | 8,10,12 | Hauptfettsäure im fetten Pflanzensamenöl der Ringelblume | 40,5 °C | (8E,10E,12Z)- Octadeca- 8,10,12- triensäure | ||
| Punicinsäure | 9,11,13 | in wenigen Pflanzenölen, z. B. im Kernöl des Granatapfels | 43–44 °C | (9Z,11E,13Z)- Octadeca- 9,11,13- triensäure | ||
| Alpha-Eleostearinsäure | in wenigen Pflanzenölen, z. B. Hauptfettsäure im Öl der Samen von Bittermelonen (Momordica spp.) und Goldpflaumengewächsen (Parinari spp.), sowie im Tungöl (Vernicia spp.) | 49 °C | (9Z,11E,13E)- Octadeca- 9,11,13- triensäure | |||
| Beta-Eleostearinsäure | in wenigen Pflanzenölen, aus der α-Eleostearinsäure in den Samenölen durch Isomerisierung | 71,5 °C | (9E,11E,13E)- Octadeca- 9,11,13- triensäure | |||
| 18:4 | Stearidonsäure | C17H27COOH | 6,9,12,15 | Raublattgewächse (Boraginaceae), Primeln (Primula spp.), Algen, Pilze, Spirulina, Seetieröle, Hanfsamen, Johannisbeersamen | −57 °C | (6Z,9Z,12Z,15Z)- Octadeca- 6,9,12,15- tetraensäure |
| 20:4 | Arachidonsäure | C19H31COOH | 5,8,11,14 | Tierfette, Fischtran | −49,5 °C | (5Z,8Z,11Z,14Z)- Eicosa- 5,8,11,14- tetraensäure |
| 20:5 | Eicosapentaensäure (Timnodonsäure, EPA) | C19H29COOH | 5,8,11,14,17 | Fischöle | −53–54 °C | (5Z,8Z,11Z,14Z,17Z)- Eicosa- 5,8,11,14,17- pentaensäure |
| 22:2 | Docosadiensäure | C21H39COOH | 13,16 | Lebertran, Sonnenblumenöl, Rapsöl (alte Sorten)[17] | (13Z,16Z)- Docosa- 13,16- diensäure | |
| 22:4 | Docosatetraensäure (Adrensäure, ADA) | C21H35COOH | 7,10,13,16 | Fischöle | (7Z,10Z,13Z,16Z)- Docosa- 7,10,13,16- tetraensäure | |
| 22:5 | Docosapentaensäure, (Clupa(no)donsäure), (DPA-3) | C21H33COOH | 7,10,13,16,19 (4, 8, 12, 15, 19; 22:5n-3) (4, 7, 10, 13, 16; 22:5n-6, Osbondsäure, DPA-6, OBA)[18] | Fischöle | −78 °C | (7Z,10Z,13Z,16Z,19Z)- Docosa- 7,10,13,16,19- pentaensäure |
| 22:6 | Docosahexaensäure (Cervonsäure, Clupanodonsäure, DHA)[14][19] | C21H31COOH | 4,7,10,13,16,19 | Fischöle | −44 °C | (4Z,7Z,10Z,13Z,16Z,19Z)- Docosa- 4,7,10,13,16,19- hexaensäure |
| 24:6 | Tetracosahexaensäure (Nisinsäure) | C23H35COOH | 6,9,12,15,18,21 | Fischöle | (6Z,9Z,12Z,15Z,18Z,21Z)-Tetracosa-6,9,12,15,18,21- hexaensäure | |
- Anmerkungen
- 1 Die Elaidinsäure, das trans-Isomere der Ölsäure, entsteht bei der Fetthärtung zur Herstellung von Margarine durch partielle Hydrierung mehrfach ungesättigter Fettsäuren im Zuge einer Isomerisierung. In der Natur kommt sie im Fett von Wiederkäuern (Milch, Butter, Rindertalg) vor, da deren Pansenorganismen ebenfalls hydrierende Enzyme enthalten.
- 2 Beim Linolensäure-Isomeren mit den Doppelbindungen in den Positionen 9, 12 und 15 (alle in cis-Konfiguration) handelt es sich um die alpha-Linolensäure, das Isomer mit den Doppelbindungen in den Positionen 6, 9 und 12 (alle in cis-Konfiguration) wird als gamma-Linolensäure bezeichnet.
Weitere Fettsäuren
| Fettsäuren mit weiteren funktionellen Gruppen oder speziellen Bindungen | ||||||
|---|---|---|---|---|---|---|
| Zahl der C-Atome: funktionelle Gruppe Doppelbindungen | Trivialname | Bruttoformel | Stellung der funktionellen Gruppen/Bindungen | Vorkommen | Schmelz- punkt | Chemische Bezeichnung |
| 8:0cy-Dis Disulfid- | Liponsäure | C8H14S2O2 | 5 (1,2-Dithiolan, Disulfidbrücke) | Microorganismen, Algen, Leber | 46–48 °C[20] | 5-[(3R)-1,2-Dithiolan-3-yl]pentansäure |
| 18:0-9Br,10Br,12Br,13Br Brom- (Bromalkan, Haloalkan) | Tetrabromstearinsäure | C18H32Br4O2 | 9,10,12,13 (Bromgruppe) | Samenöl von Lippenblütlern (Eremostachys molucelloides) | 114,7–115,2 °C[21] | 9,10,12,13-Tetrabromooctadacansäure |
| 18:0-9Cl-10Cl Chlor- (Chloralkan, Haloalkan) | Dichlorstearinsäure | C18H34Cl2O2 | 9,10 (Chlorgruppe) | Europäischer Aal (Anguilla anguilla)[22] | 9,10-Dichloroctadecansäure | |
| 18:1cy (18:1-13-cp) Cyclopenten- | Chaulmoograsäure | C18H32O2 | 13 (Cyclopenten) | Samenöl Hydnocarpus wightianus, Hydnocarpus kurzii, Caloncoba echinata | 68,5 °C–71 °C[23][24] | 13-Cyclopent-2-enyl-tridecansäure |
| 18:1-delta-6a Dreifachbindung | Taririnsäure | C18H32O2 | 6 (Dreifachbindung) | Pflanzenöle | 49–50 °C | 6-Octadecinsäure |
| 18:1-delta-9c-12,13-O Epoxy- | Vernolsäure | C18H32O3 | 9 (Doppelbindung) 12,13 (Epoxygruppe) | Hauptfettsäure im Vernoniaöl (aus Samen von Scheinastern) | 23–25 °C | (12R,13S)-12,13-Epoxy-9-cis-octadecensäure |
| 18:1-delta-9c-12-OH Hydroxy- | Rizinolsäure | C18H34O3 | 9 (Doppelbindung) 12 (Hydroxygruppe) | Hauptfettsäure im Rizinusöl | 5 °C | (9Z,12R)-12-Hydroxy-9-Octadecensäure |
| 18:1-delta-9c-18-F Fluor- (Fluoralkan, Haloalkan) | Fluorölsäure | C18H33FO2 | 9 (Doppelbindung) 18 (Fluorgruppe) | Samen von Dichapetalaceae (Dichapetalum toxicarium) | 13,5 °C[25] | (9Z)-18-Fluor-9-Octadecensäure |
| 18:2-delta-5,6allene Allene- | Laballensäure | C18H32O2 | 5,6 (Kumulierte Doppelbindung) | In Arten von Lippenblütlern Lamiaceae | (R)-5,6-Octadecadiensäure | |
| 18:3-delta-4-Oxo-9c,11t,13t Doppelbindung, Carbonyl- | α-Licansäure (Couepinsäure) | C18H28O3 | 9,11,13 (Doppelbindung) 4 (Ketogruppe) Ketosäure | Hauptfettsäure im Oiticicaöl (aus den Samen von Licania rigida) | 74–75 °C | 4-Oxo-(9Z,11E,13E)-Octadecatriensäure |
| 18:3-delta-9a,11a,17-E Dreifachbindung, Ethen- | Isansäure | C18H26O2 | 9,11 (Dreifachbindung) 17 (Vinylgruppe) | Isanoöl (aus den Samen von Ongokea gore) | 42 °C[26] | Octadeca-17-en-9,11-diinsäure |
| 18:3-9-Oxa-8t,10t,12c Doppelbindung, Vinylether- | Colneleinsäure | C18H30O3 | 8,10,12 (Doppelbindung) 9 (Ethergruppe) | Pflanzenblätter- und Wurzeln | (8E)-9-[(1E,3Z)-1,3-Nonadien-1-yloxy]-8-nonensäure | |
| 18:4-delta-9c,11t,13t,15c Doppelbindung | α-Parinarsäure (Octadecatetraensäure) | C18H28O2 | 9,11,13,15 (Doppelbindung) | Samenöl Rosaceae, Balsaminaceae | 83,5 °C[26] | (9Z,11E,13E,15Z)-Octadecatetraensäure |
| 18:4-delta-9a,11a,13a,15a-17-OH Dreifachbindung, Hydroxy- | Minquartinsäure | C18H20O3 | 9,11,13,15 (Dreifachbindung) 17 (Hydroxygruppe) | Rinde von Minquartia guianensis, Coula edulis | 97 °C[13] | (S)-17-Hydroxy-9,11,13,15-Octadecatetrainsäure |
| 19:0-11,12-cpa Cyclopropyl- | Lactobacillsäure | C19H36O2 | 11,12 (Cyclopropan) | Wichtige Fettsäure in Lactobacillus-Arten | 28–29 °C | (11R,12S)-Methylenoctadecansäure |
| 19:0-2,6,10,14-tetra-Me (19:0br4) Methyl- | Pristansäure | C19H38O2 | 2,6,10,14 (Methylgruppe; Isoprenoid) | Tierfett, Milchfett, Fischöl | (2S,6R,10R)-2,6,10,14-Tetramethylpentadecansäure | |
| 19:1-9,10-cpe Cyclopropen- | Sterculiasäure | C19H36O2 | 9,10 (Cyclopropen) | In Pflanzensamen; Stinkbaum (Sterculia foetida), Kapokbaum (Ceiba pentandra), Afrikanischer Affenbrotbaum (Adansonia digitata) | 18,2–18,3 °C | 8-(2-Octylcyclopropen-1-yl)octansäure |
Fettsäuren mit einer Hydroxygruppe kommen in den Lipiden von Tieren, Pflanzen und Prokaryoten vor. Häufig findet sich die Hydroxygruppe am zweiten Kohlenstoffatom (vergleiche α-Hydroxycarbonsäuren). Auch β-Hydroxyfettsäuren kommen vor, ebenso wie Fettsäuren, bei denen die funktionelle Gruppe mitten in der Kohlenstoffkette vorkommt, wie bei der Rizinolsäure. Weitere funktionelle Gruppen mit einem Sauerstoffatom sind die Epoxygruppe, die Ketogruppe und die Furangruppe, die ebenfalls in Fettsäuren zu finden sind.[27]
Fettsäuren in den Membranlipiden von Bakterien weisen zum Teil ungewöhnliche Bestandteile im Molekül auf. So weisen alicyclische Fettsäuren einen Ring aus Kohlenwasserstoffen auf. Dieser kann sich, als Cyclopropan, mitten in der Kohlenstoffkette befinden, wie dies bei den Mykolsäuren oder der Lactobacillsäure der Fall ist.[28] Weiterhin können sie auch eine Ketogruppe aufweisen. Mykolsäuren sind außerdem die längsten natürlich vorkommenden Fettsäuren. Sie sind über Arabinogalaktan an das Murein in der Bakterienzellwand gebunden.
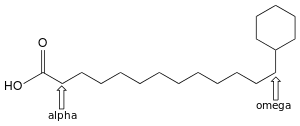
Ringe mit sechs oder sieben Kohlenstoffatomen (Cyclohexan bzw. Cycloheptan) finden sich häufig am Ende der eigentlichen Fettsäurekette, sie werden dann als Omega-alicyclische (ω-alicyclische) Fettsäuren bezeichnet, wobei der griechische Kleinbuchstabe ω als Lokant verwendet wird. Die Bakteriengattung Alicyclobacillus ist nach diesen Fettsäuren benannt worden, da sie diese in großen Mengen in den Membranlipiden enthält. Ein Beispiel ist die Omega-Cyclohexyltridecansäure, eine ω-alicyclische Fettsäure mit einem Cyclohexan-Rest und einer Kette mit 13 Kohlenstoffatomen.[29]
Stoffwechsel
Transport
Fettsäuren werden als Triglyceride im Fettgewebe gespeichert. Bei Bedarf, der durch die Botenstoffe Adrenalin, Noradrenalin, Glucagon oder ACTH angezeigt wird, findet dort eine Lipolyse statt.
Die freien Fettsäuren werden dann im Blutkreislauf zu den energiebenötigenden Zellen transportiert, wo sie zuerst unter ATP-Verbrauch an Coenzym A (CoA) gebunden (aktiviert) werden. Diese Reaktion wird durch die Hydrolyse des dabei entstehenden Pyrophosphats zu zwei Phosphaten (Pi) vorangetrieben.
Danach werden sie durch das Enzym Carnitin-Acyltransferase I an Carnitin gebunden und aktiv in die Matrix der Mitochondrien transportiert, wo sie durch Carnitin-Acyltransferase II wieder an CoA gebunden werden. Diese Aktivierung ist notwendig, damit Fettsäuren durch die Mitochondriummembran diffundieren können. Nur aktiv transportierte Fettsäuren werden zur β-Oxidation der Fettsäuren herangezogen. Die Acyl-Carnitin-Aktivierung ist nicht reversibel, eine aktivierte Fettsäure wird abgebaut.
Fettsäureabbau
In der Matrix des Mitochondriums findet die β-Oxidation der Fettsäuren zu Acetyl-CoA statt, welches im Citratzyklus weiterverwendet werden kann, um ATP zu gewinnen. Bei längeren Hungerperioden oder Ernährung mit sehr wenig Kohlenhydraten, wie z. B. der Atkins-Diät, werden die Fette stattdessen zu Ketonkörpern verstoffwechselt.
Zusätzlich zur mitochondrialen Fettsäureoxidation findet auch in den Peroxisomen eine Verwertung von Fettsäuren statt. Vor allem sehr langkettige Fettsäuren werden meist dort zuerst verkürzt, ehe sie in den Mitochondrien weiterverarbeitet werden können. Ein Ausfall dieser peroxisomalen Funktion führt zu Adrenoleukodystrophie.
Fettsäuresynthese
Die Fettsäuresynthese erfolgt im Gegensatz zum Abbau im Cytosol. Bei höheren Organismen sind alle dafür notwendigen Enzyme in einem einzigen Enzymkomplex, der Fettsäure-Synthase, zusammengefasst. Bei grünen Pflanzen jedoch findet der Aufbau bis höchstens zur C18-Fettsäure hauptsächlich in den Plastiden statt und wird dann erst ins Cytosol transportiert.
Dazu wird zuerst Malonyl-CoA aus Acetyl-CoA unter ATP-Verbrauch durch Carboxylierung gebildet. Dieses wird dann zu Malonyl-ACP umgewandelt, denn im Gegensatz zum Abbau dient bei der Synthese Acyl carrier protein (ACP) statt CoA als Carriermolekül. Die nachfolgende Kondensationsreaktion ist grob betrachtet eine Umkehr der Fettsäureoxidation (β-Oxidation). Jedoch finden sich im Detail einige bedeutende Unterschiede, die eine unabhängige, gezielte Steuerung beider Vorgänge erlauben.
Charakteristische Fettsäuren in Mikroorganismen
Arttypisch vorkommende Fettsäuren können als Biomarker verwendet werden.[30] Actinomyceten sind Gram-positive Bakterien, welche bei der Zersetzung von organischem Material vorkommen und unter anderem dabei einen erdigen Geruch erzeugen. Fettsäuren von Actinomyceten sind gelegentlich am C10 mit einer Methylgruppe verzweigt, z. B. 16:0 10-Methyl und 18:0 10-Methyl.[31] Bodenlebende Actinomyceten sind z. B. Rhodococcus, Nocardia, Corynebacterium und Streptomyces. Gram-positive Bakterien sind z. B. auch Bacillus spp. wie Bacillus cereus und Bacillus subtilis. Die Anzahl der Bakterien der Bacillus spp. nimmt in der Rhizosphäre zu. Sie bilden verzweigte Fettsäuren wie 15:0 iso and 15:0 anteiso.
Gram-negative Bakterien sind ein bedeutender Bestandteil der Rhizosphäre und Erhöhen die Verfügbarkeit von Phosphat, Eisen und anderen Mineralien, manche produzieren auch Fungizide.[32] Gram-negative Bakterien erzeugen höhere Konzentrationen an einfach ungesättigten Fettsäuren wie 16:1 Omega-7 und 18:1 Omega-9, die großteils zu Cyclopropyl-Fettsäuren wie 17:0 Cyclopropan und 19:0 Cyclopropan weiterverstoffwechselt werden.[33] Unter anaeroben Bedingungen entstehen Dimethylacetale (DMA), die als Biomarker verwendet werden können.[34] Bei strikt anaeroben Bedingungen, wie während einer Überflutung, nimmt die Anzahl fakultativ aerober Bakterien ab, die Anzahl der anaeroben Bakterien und Archaeen zu.[35]
Die Fettsäuren in den Lipiden von Archaeen sind nicht über eine Esterbindung verbunden, sondern über eine Etherbindung.[36] Mykorrhiza-Pilze bilden Speichervesikel, die unter anderem 18:2 (ω-6c) und 16:1 (ω-5c) enthalten.[37]
Verschiedene Fettsäuren als Biomarker:
- Geradzahlige Fettsäuren (z. B. 16:0, Palmitinsäure) – Prokaryoten und Eukaryoten
- iso-verzweigte Fettsäuren (z. B. 17:0 iso, 15-Methylpalmitinsäure) – Gram-positive Bakterien
- anteiso-verzweigte Fettsäuren (z. B. 17:0 anteiso, 14-Methylpalmitinsäure) – Gram-positive Bakterien
- 10-Methyl-verzweigte Fettsäuren (z. B. 19:0 10-methyl, Tuberculostearinsäure) – Actinomycetales
- Einfach ungesättigte Fettsäuren (engl. monounsaturated fatty acids, MUFA)
- 16:1 ω5c (Hexadecenonsäure) – Mykorrhiza
- Omega-5 und 7 Position (z. B. 16:1 ω7c, Palmitoleinsäure) – Gram-negative Bakterien
- 16:1 ω8c (8-Hexadecenonsäure) – Methan-oxidierende Bakterien Typ I
- 18:1 ω8c (10-Octadecenonsäure) – Methan-oxidierende Bakterien Typ II
- Omega-9 Position (z. B. 16:1 ω9c, cis-7-Palmitoleinsäure) – Ectomycorrhizale Pilze & Gram-positive Bakterien
- Mehrfach ungesättigte Fettsäuren (engl. polyunsaturated fatty acids, PUFA)
- 18:2 ω6c, (Linolsäure) – Ectomycorrhizale Pilze
- 20:2 ω6c, 20:3 ω6c, 20:4 ω6c – Protozoen
- Andere PUFA – Eukaryoten
- Cyclopropyl-Fettsäuren (z. B. 19:0 cyclo ω7c) – Bakterien
- Dimethylacetale (z. B. 16:0 DMA, Hexadecanal-Dimethylacetal) – Anaerobe Bakterien
Gesundheitliche Bedeutung
Sowohl gesättigte als auch ungesättigte Fettsäuren liefern viel Energie und wirken sich auf viele Stoffwechselprozesse positiv aus.
Die Deutsche Gesellschaft für Ernährung (DGE) hat im Jahr 2010 in einer Auswertung von Interventionsstudien mit über 13.600 Teilnehmern herausgefunden, dass ein hoher Anteil mehrfach ungesättigter Fettsäuren, zusammen mit einem niedrigen Anteil gesättigter Fettsäuren, das Risiko für koronare Herzkrankheiten (z. B. Herzinfarkt) senkt.[38] Sie bestätigte damit Ergebnisse, die Daniel und Hecht bereits 1990 veröffentlichten.[39][40] Günstige Verhältnisse mehrfach ungesättigter zu gesättigter Fettsäuren finden sich vor allem in Pflanzenfetten (z. B. Distelöl 74,5 %/8,6 %, Hanföl 70 %/10 %, Sonnenblumenöl 60,7 %/11,5 % und Sojaöl 61,0 %/13,4 %; Ausnahmen bilden Kokosöl 1,4 %/86,5 % und Palmöl 17 %/83 %)[40], Nüssen und Samen (z. B. Tahin 55 %/9 %, Haselnüsse 54 %/5 %).
Ungesättigte trans-Fettsäuren wirken sich ungünstig auf den Cholesterinspiegel aus. Insbesondere durch die Senkung des HDL-Cholesterol-Spiegels bei gleichzeitiger Erhöhung des LDL-Cholesterol-Lipoprotein(a)-Spiegels sowie proinflammatorische Effekte kommt es zu einem negativen Einfluss auf die endotheliale Funktion der Arterienwände.[41][42] Auch gibt es Vermutungen auf eine Verstärkung von Insulin-Resistenz und Adipositas, Zellmembranveränderungen und negative Effekte auf die Blutgerinnung.[43] Außerdem ist die Evidenz von Observationsstudien für einen Zusammenhang zwischen trans-Fettsäuren und erhöhtem Risiko für koronare Herzkrankheiten sehr überzeugend.[44] Lebensmittel mit trans-Fettsäure-haltigen Triglyceriden sind in den Inhaltsangaben oft mit dem Vermerk „Pflanzliches Öl, teilweise gehärtet“ gekennzeichnet.[45]
In Populationen, die im mediterranen Raum angesiedelt sind, beträgt die Zufuhr von einfach ungesättigten Fettsäuren zwischen 16 und 29 % der täglichen Gesamtenergiezufuhr (vor allem in Form von Ölsäure, z. B. Olivenöl). Untersuchungen zeigen, dass ein Austausch von gesättigten Fettsäuren durch etwa Kohlenhydrate, einfach ungesättigte oder mehrfach ungesättigte Fettsäuren kardiovaskuläre Risikofaktoren reduziert.[46] Im Vergleich zu Kohlenhydraten wirkten sich MUFAs positiv auf Triglyceride, HDL-Cholesterin und das Verhältnis Gesamtcholesterin:HDL-Cholesterin aus. Zwei Metaanalysen zeigten positive Auswirkungen einer erhöhten Zufuhr von einfach ungesättigten Fettsäuren auf folgende kardiovaskuläre Risikofaktoren: systolischer und diastolischer Blutdruck, glykiertes Hämoglobin (HbA1c) und Nüchternglukose.[47][48][49]
Die Omega-6-Fettsäuren (z. B. Linolsäure, Gamma-Linolensäure) und die Omega-3-Fettsäuren gehören zu den essentiellen Fettsäuren, da sie nicht vom menschlichen Organismus selbst hergestellt werden können. In Pflanzenölen kommt Linolsäure (Sonnenblumenöl, Sojaöl, Maiskeimöl) in recht hohen Konzentrationen (50–70 % bezogen auf den Gesamtfettsäureanteil) vor. Durch Dehydrierung und Kettenverlängerung kann der menschliche Organismus Linolsäure über mehrere Zwischenstufen bis zur Arachidonsäure umwandeln. Arachidonsäure kann im Körper weiter zu den Prostaglandinen umgewandelt werden. Lein- und Hanföl sind reich an Linolensäure, die Arachidonsäure wird nur in tierischen Produkten wie Leber, Eiern und Schmalz vorgefunden. Die essentiellen Fettsäuren sind am Aufbau von Zellmembranen beteiligt und senken den Blutfett- und Cholesterinspiegel.
Omega-6-Fettsäuren werden meist über die Arachidonsäure – aber nicht immer oder ausschließlich – zu entzündungsfördernden Prostaglandinen verstoffwechselt, Omega-3-Fettsäuren zu entzündungshemmenden.
Von der DGE wird empfohlen, etwa 30 % des Gesamtenergiebedarfs mit Fett zu decken. 10 % sollte mit gesättigten Fettsäuren gedeckt werden, 10 bis 13 % mit einfach ungesättigten und der Rest mit mehrfach ungesättigten. Die amerikanische Herzgesellschaft (ADA), die europäische Behörde für Lebensmittelsicherheit (EFSA) sowie die amerikanische Academy of Nutrition and Dietetics empfehlen, weniger als 35 % des Energiebedarfs aus Fett zu beziehen, wobei die ADA eine Energiezufuhr von weniger als 20 % an einfach ungesättigten Fettsäuren empfiehlt.[50][51][52] Um das Herz-Kreislauf-Risiko gering zu halten, sollte das Verhältnis von Omega-6- zu Omega-3-Fettsäuren maximal 5:1 betragen. Eine internationale Expertenkommission unter Leitung von Berthold Koletzko (Stiftung Kindergesundheit) hat Richtlinien für die Ernährung von Müttern und Babys entwickelt und veröffentlicht.[53] Darin wird beschrieben, dass der heranwachsende Fötus vermehrt langkettige, mehrfach ungesättigte Fettsäuren, so genannte LC-PUFA (Longchain polyunsaturated fatty acid), benötigt. Insbesondere sind dies die Arachidonsäure (Omega-6-Fettsäure, AA) und die Docosahexaensäure (Omega-3-Fettsäure, DHA). Die genannten Fettsäuren werden von Algen produziert und reichern sich über die Nahrungskette in fetten Seefischen (z. B. Hering, Makrele und Lachs) an. Eine vegane Alternative ist Algenöl.
Substituierte Fettsäuren mit Keto- und Hydroxygruppen sind in verdorbenen Ölen vorhanden. Sie sind teilweise für den menschlichen Organismus giftig. Eine weitere wichtige substituierte Fettsäure, die Ricinolsäure, ist im Ricinusöl zu etwa 80 % enthalten. Ricinusöl wird nicht im Darm aufgenommen und wirkt daher abführend.
Analytik von Fettsäuren
Die moderne qualitative und quantitative Analytik der Fettsäuren in der Lebensmittelchemie und in der physiologischen Forschung bedient sich in der Regel der chromatographischen Verfahren. Zum Einsatz kommen die Kapillar-Gaschromatographie (nach Umesterung zu Methylestern[54]), die HPLC und die Kopplung dieser Verfahren mit der Massenspektrometrie. Meist werden die Fettsäuren in Form geeigneter Derivate, wie z. B. der Fettsäuremethylester oder ihrer TMS-Derivate, chromatographisch getrennt. In besonderen Fällen wird auch noch heute die klassische Säulen- und Dünnschichtchromatografie eingesetzt; so erfolgt die Trennung von Isomeren über Silbernitrat-Dünnschichtchromatographie.[55]
Zählung von Fettsäuren
Die Anzahl der unverzweigten Fettsäuren (einschließlich kürzerer Monocarbonsäuren) mit verschieden vielen Doppelbindungen an verschiedenen Positionen als Funktion der Kettenlänge gehorcht der in der Zahlentheorie sehr bekannten Fibonacci-Folge.[56] Das folgt unter anderem daraus, dass (bis auf seltene Ausnahmen) bei Fettsäuren keine benachbarten Doppelbindungen auftreten. Speziell gibt es nur eine aliphatische Monocarbonsäure mit einem C-Atom: Ameisensäure, eine mit zwei C-Atomen: Essigsäure, zwei mit dreien: Propionsäure und Acrylsäure usw. Bei 18 C-Atomen ergeben sich 2.584 Varianten (wovon Stearinsäure, Ölsäure, Linolsäure und Linolensäure vier Beispiele sind).
Spezielle Fettsäuren
- Furanfettsäuren
- Freie Fettsäuren
- Liponsäure (schwefelhaltige Fettsäure)[57]
Literatur
- Wolf-H. Kunau: Chemie und Biochemie ungesättigter Fettsäuren. In: Angewandte Chemie. 88, 1976, S. 97–111 (doi:10.1002/ange.19760880402).
- J. Ernst, W. S. Sheldrick, J.-H. Fuhrhop: Die Strukturen der essentiellen ungesättigten Fettsäuren. Kristallstruktur der Linolsäure sowie Nachweis für die Kristallstrukturen der Linolensäure und der Arachidonsäure. In: Z. Naturforsch. 34b, 1979, S. 706–711.
- P. Nuhn, M. Gutheil, B. Dobner: Vorkommen, Biosynthese und Bedeutung verzweigter Fettsäuren. In: Fette-Seifen-Anstrichmittel. 87, 1985, S. 135.
- F. D. Gunstone, J. L. Harwood, F. B. Padley: The Lipid Handbook. Chapman and Hall, London/ New York 1986, ISBN 0-412-24480-2.
Weblinks
- Common (Nonsystematic) Names for Fatty Acids (PDF; 196 kB), bei AOCS, abgerufen am 20. Oktober 2017.
- PlantFA Database, abgerufen am 24. Mai 2017.
- Botanik online: Lipide auf biologie.uni-hamburg.de.
- Fettsäurezusammensetzung wichtiger pflanzlicher und tierischer Speisefette und -öle auf dgfett.de.
Einzelnachweise
- Eintrag zu fatty acids. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.F02330 – Version: 2.3.1.
- T. Rezanka, K. Sigler: Odd-numbered very-long-chain fatty acids from the microbial, animal and plant kingdoms. In: Progress in lipid research. Band 48, Nummer 3–4, 2009, S. 206–238, doi:10.1016/j.plipres.2009.03.003, PMID 19336244.
- Michael T. Madigan, John M. Martinko, Jack Parker: Brock Mikrobiologie. Deutsche Übersetzung herausgegeben von Werner Goebel, Spektrum Akademischer Verlag, Heidelberg / Berlin 2000, ISBN 3-8274-0566-1, S. 500–501.
- P. Pohl, H. Wagner: Fettsäuren im Pflanzen- und Tierreich (eine Übersicht). In: Fette, Seifen, Anstrichmittel. 74, 1972, S. 424–435 und 542–550.
- Harvard T.H. Chan School of Public Health: Types of Fat. 9. Juni 2014, abgerufen am 27. Januar 2022 (amerikanisches Englisch).
- Gebauer, Psota, Kris-Etherton: The diversity of health effects of individual trans fatty acid isomers. In: Lipids. Band 42(9), 2007, S. 787–799, doi:10.1007/s11745-007-3095-8.
- Toshi Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiological reviews. Band 55, Nummer 2, 1991, S. 288–302, PMID 1886522, PMC 372815 (freier Volltext), (Review).
- Hans-Dieter Belitz, Walter Grosch: Lehrbuch der Lebensmittelchemie. 4. Auflage. Springer Verlag, Heidelberg/ Berlin 1992, ISBN 3-540-55449-1, S. 465–466.
- William W. Christie: Fatty Acids: Branched-chain – Structure, Occurence and Biosynthesis. (Nicht mehr online verfügbar.) In: Webseite AOCS Lipid Library. 26. Juni 2012, archiviert vom Original am 12. Januar 2010; abgerufen am 8. März 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-4 – 3-523.
- Eintrag zu Palmitinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Albin H. Warth: The Chemistry and Technology of Waxes. Second Edition, Reinhold Publ., 1956, S. 34, online auf babel.hathitrust.org, abgerufen am 1. November 2017.
- Shmuel Yannai: Dictionary of Food Compounds. Second Edition, CRC Press, 2012, ISBN 978-1-4200-8351-4, S. 883, 1023.
- H. M. Rauen: Biochemisches Taschenbuch. Springer, 1956, ISBN 978-3-642-53241-2 (Reprint), S. 162, 232.
- Die Datenbank Seed Oil Fatty Acids (SOFA).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-338.
- Reinhard Lieberei, Christoph Reisdorff: Nutzpflanzen. 8. Auflage, Thieme, 2012, ISBN 978-3-13-530408-3, S. 137.
- Wolfgang Steglich, Burkhard Fugmann: RÖMPP Lexikon Naturstoffe. Thieme, 1997, ISBN 3-13-749901-1, S. 142.
- John W. Blunt, Murray H. G. Munro: Dictionary of Marine Natural Products. Chapman & Hall, 2008, ISBN 978-0-8493-8216-1, S. 701 f.
- J. Elks, C. R. Ganellin: The Dictionary of Drugs. Springer, 1990, ISBN 978-1-4757-2087-7, S. 734.
- Dictionary of Organic Compounds. Second Supplement, Sixth Edition, Chapman & Hall, ISBN 978-0-412-54120-9, S. 260.
- Frank D. Gunstone, John L. Harwood, Albert J. Dijkstra: The Lipid Handbook. Third Edition, CRC Press, 2007, ISBN 0-8493-9688-3, S. 12.
- R. Hegnauer: Chemotaxonomie der Pflanzen. Band 4, Springer, 1966, ISBN 978-3-0348-9383-1, S. 158.
- W. Ruhland (Hrsg.): Handbuch der Pflanzenphysiologie. Band 7, Springer, 1957, ISBN 978-3-642-94705-6, S. 20.
- W. Karrer: Konstitution und Vorkommen der organischen Pflanzenstoffe. Ergänzungsband 1, Birkhäuser, 1977, ISBN 978-3-0348-9378-7, S. 338.
- W. Karrer: Konstitution und Vorkommen der organischen Pflanzenstoffe. 2. Auflage, Springer, 1976, ISBN 978-3-0348-5143-5 (Reprint), S. 317, 395.
- William W. Christie: Fatty Acids: Hydroxy and other oxygenated – Structures, Occurence and Biochemistry. (Nicht mehr online verfügbar.) In: Webseite AOCS Lipid Library. 29. Oktober 2013, archiviert vom Original am 10. Dezember 2009; abgerufen am 8. März 2014.
- D. W. Grogan, J. E. Cronan: Cyclopropane ring formation in membrane lipids of bacteria. In: Microbiology and molecular biology reviews : MMBR. Band 61, Nummer 4, 1997, S. 429–441, PMID 9409147, PMC 232619 (freier Volltext). (Review).
- H. Matsubara, K. Goto u. a.: Alicyclobacillus acidiphilus sp. nov., a novel thermo-acidophilic, omega-alicyclic fatty acid-containing bacterium isolated from acidic beverages. In: International journal of systematic and evolutionary microbiology. Band 52, Nr. 5, 2002, S. 1681–1685. PMID 12361274.
- L. Zelles: Identification of single cultured micro-organisms based on their whole-community fatty acid profiles, using an extended extraction procedure. In: Chemosphere. Band 39, Nummer 4, August 1999, S. 665–682. PMID 10422254.
- A. Frostegård, A. Tunlid, E. Bååth: Phospholipid Fatty Acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals. In: Applied and Environmental Microbiology. Band 59, Nummer 11, November 1993, S. 3605–3617. PMID 16349080. PMC 182506 (freier Volltext).
- A. Pandey, P. Trivedi, B. Kumar, L. M. Palni: Characterization of a phosphate solubilizing and antagonistic strain of Pseudomonas putida (B0) isolated from a sub-alpine location in the Indian Central Himalaya. In: Current microbiology. Band 53, Nummer 2, August 2006, S. 102–107, doi:10.1007/s00284-006-4590-5. PMID 16832725.
- A. Kaur u. a.: Phospholipid fatty acid – A bioindicator of environmental monitoring and assessment in soil ecosystem. In: Current Science. Band 89, Ausgabe 7, 2005, S. 1103–1112.
- L. Zelles: Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. In: Biol Fertil Soils. Band 29, Ausgabe 2, 1999, S. 111–129.
- Q. Bai, A. Gattinger, L. Zelles: Characterization of Microbial Consortia in Paddy Rice Soil by Phospholipid Analysis. In: Microbial ecology. Band 39, Nummer 4, Mai 2000, S. 273–281. PMID 10882432.
- J. Lombard, P. López-García, D. Moreira: Phylogenomic investigation of phospholipid synthesis in archaea. In: Archaea (Vancouver, B.C.). Band 2012, 2012, S. 630910, doi:10.1155/2012/630910, PMID 23304072, PMC 3533463 (freier Volltext).
- I. M. van Aarle, P. A. Olsson: Fungal lipid accumulation and development of mycelial structures by two arbuscular mycorrhizal fungi. In: Applied and Environmental Microbiology. Band 69, Nummer 11, November 2003, S. 6762–6767, PMID 14602638, PMC 262256 (freier Volltext).
- Mehrfach ungesättigte Fettsäuren senken das Risiko für koronare Herzkrankheiten (PDF; 240 kB).
- H. Daniel, H. Hecht: Ernährung und Arteriosklerose. In: Deutsche Apotheker Zeitung. 1990, S. 1307–1318.
- Claus Leitzmann, Andreas Hahn: Vegetarische Ernährung. 1. Auflage. Ulmer, Stuttgart 1996, ISBN 3-8252-1868-6, S. 88, 89.
- R. Uauy, A. Aro, R. Clarke, Ghafoorunissa, M. R. L'Abbé, D. Mozaffarian, C. M. Skeaff, S. Stender, M. Tavella: WHO Scientific Update on trans fatty acids: summary and conclusions. In: European Journal of Clinical Nutrition. Band 63, S2, 2009, S. S68–S75, doi:10.1038/ejcn.2009.15.
- Renata Micha, Dariush Mozaffarian: Trans fatty acids: effects on metabolic syndrome, heart disease and diabetes. In: Nature Reviews Endocrinology. Band 5, Nr. 6, Juni 2009, S. 335–344, doi:10.1038/nrendo.2009.79.
- D. Mozaffarian, A. Aro, W. C. Willett: Health effects of trans-fatty acids: experimental and observational evidence. In: European Journal of Clinical Nutrition. Band 63, S2, Januar 2009, S. S5–S21, doi:10.1038/sj.ejcn.1602973.
- C. Murray Skeaff, Jody Miller: Dietary Fat and Coronary Heart Disease: Summary of Evidence from Prospective Cohort and Randomised Controlled Trials. In: Annals of Nutrition and Metabolism. Band 55, Nr. 1-3, September 2009, S. 173–201, doi:10.1159/000229002.
- Marcel Kollmar (2012): Gesättigte und ungesättigte Fettsäuren. Welche Fette braucht der Körper? auf joggen-online.de.
- The Joint FAO/WHO Expert Consultation on Fats and Fatty Acids in Human Nutrition November 10–14, 2008, Geneva Switzerland (2010): Interim summary of conclusions and dietary recommendations on total fat and fatty acids. (PDF; 1,9 MB).
- L. Schwingshackl, B. Strasser, G. Hoffmann: Effects of monounsaturated fatty on glycemic control in patients with abnormal glucose metabolism: a systematic review and meta-analysis. In: Ann Nutr Metab. 58, 2011, S. 290–296, doi:10.1159/000331214.
- L. Schwingshackl, B. Strasser, G. Hoffmann: Effects of Monounsaturated Fatty Acids on Cardiovascular Risk Factors: A Systematic Review and Meta-Analysis. In: Ann Nutr Metab. 59, 2011, S. 176–186, doi:10.1159/000334071.
- L. Schwingshackl, B. Strasser: High-MUFA Diets Reduce Fasting Glucose in Patients with Type 2 Diabetes. In: Ann. Nutr. Metab. 60, 2012, S. 33–34, doi:10.1159/000335162.
- Nutrition, and Allergies (NDA) EFSA Panel on Dietetic Products: Scientific Opinion on Dietary Reference Values for fats, including saturated fatty acids, polyunsaturated fatty acids, monounsaturated fatty acids, trans fatty acids, and cholesterol. In: EFSA Journal. Band 8, Nr. 3, März 2010, doi:10.2903/j.efsa.2010.1461.
- American Dietetic Association, Dietitians of Canada: Position of the American Dietetic Association and Dietitians of Canada: dietary fatty acids. In: J. Am. Diet Assoc. 107(9), 2007, S. 1599–1611, PMID 17936958.
- American Heart Association Nutrition Committee: Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. In: Circulation. 114(1), 2006, S. 82–96. PMID 16785338.
- Berthold Koletzko, Eric Lien, Carlo Agostoni u. a.: The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. In: Journal of Perinatal Medicine. Band 36, Nr. 1, 2008, S. 5–14, doi:10.1515/JPM.2008.001.
- H. U. Melchert, N. Limsathayourat, H. Mihajlović, J. Eichberg, W. Thefeld, H. Rottka: Fatty acid patterns in triglycerides, diglycerides, free fatty acids, cholesteryl esters and phosphatidylcholine in serum from vegetarians and non-vegetarians. Atherosclerosis. Mai 1987, 65 (1–2): S. 159–166, PMID 3606730
- B. Breuer, T. Stuhlfauth, H. P. Fock: Separation of fatty acids or methyl esters including positional and geometric isomers by alumina argentation thin-layer chromatography. In: J. of Chromatogr. Science. 25, 1987, S. 302–306, doi:10.1093/chromsci/25.7.302.
- S. Schuster, M. Fichtner, S. Sasso: Use of Fibonacci numbers in lipidomics – Enumerating various classes of fatty acids. In: Sci. Rep. 7 (2017) 39821, doi:10.1038/srep39821.
- H. A. Harper: Physiologische Chemie. Springer-Verlag, 2013, ISBN 978-3-662-09766-3, S. 595.