Taririnsäure
Die Taririnsäure ist eine ungesättigte Fettsäure in der Gruppe der Alkinsäuren. Sie ist der erste nachgewiesener Naturstoff mit Dreifachbindung, einer Acetylenverbindung; einer dreifach ungesättigten Bindung.[5] Ihr systematischer Name ist 6-Octadecinsäure, die Kurzschreibweise lautet 18:1-delta-6a, sie ist ein Isomer der Linolsäure.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
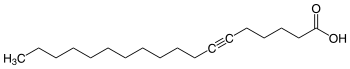 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Taririnsäure | ||||||||||||
| Andere Namen |
6-Octadecinsäure (IUPAC) | ||||||||||||
| Summenformel | C18H32O2 | ||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 280,45 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen
Taririnsäure kommt in spezifischen pflanzlichen Ölen und Fetten verestert mit Glycerin vor. Sie wurde erstmals 1892 aus dem Samenöl einer Picramnia-Art isoliert.[6] Weitere Nachweise erfolgten in Picramnia camboita aus Brasilien,[7] in Picramnia carpinterae aus Guatemala[8] und Picramnia lindeniana aus Mexico.[9] Die Biosynthese der Taririnsäure erfolgt aus Petroselinsäure; beide Fettsäuren wurden in Picramnia- und Alvaradoa-Arten nebeneinander nachgewiesen.[10][11]
Das Vorkommen von Taririnsäure als Hauptfettsäure gilt als Merkmal von Arten der Picramniaceae.[12]
Gewinnung und Darstellung
Fettsäuren lassen sich durch alkalische Verseifung aus den entsprechenden Triacylglyceriden gewinnen, indem die entsprechenden Fette oder Öle mit Basen gekocht werden. Die Verseifung selbst liefert zunächst deren Salze. Die freien Fettsäuren werden durch Neutralisation mit (Mineral-)Säure erhalten. Da die natürlichen Fette und Öle stets viele unterschiedliche Fettsäuren enthalten, schließt sich in der Regel eine Trennung des entstandenen Gemisches an.
Synthetisch wird Taririnsäure aus kommerziell in reiner Form erhältlicher Petroselinsäure hergestellt.
Eigenschaften
Physikalische Eigenschaften
Reine Taririnsäure ist bei Raumtemperatur fest (Schmelzpunkt 40 °C).[13] Die molare Masse beträgt 280,45 g·mol−1. Die Fettsäure ist unlöslich in Wasser, jedoch löslich in Methanol.
Chemische Eigenschaften
Die Dreifachbindung ist der reaktivste Teil der Taririnsäure. Die Säure und insbesondere ihre Salze sind amphiphil, das heißt, sie beinhalten sowohl einen polaren, hydrophilen Teil (die Carboxygruppe) als auch einen unpolaren, lipophilen Teil (die Kohlenwasserstoffkette).
Die Synthese reiner Taririnsäure erfolgt über Bromierung und Dehydrohalogenierung mit Kaliumhydroxid aus Petroselinsäure, die Reinheit wird nachgewiesen durch Kapillargaschromatographie, die Identität durch NMR-Spektroskopie, durch selektive Hydrierung[14] und anschließende Ozonolyse.[15]
Biologische Eigenschaften
Taririnsäure übt eine stärkere Hemmwirkung auf Mikroorganismen aus als Petroselinsäure.[16] Im Gegensatz zu Petroselinsäure kann Taririnsäure im Säugetierkatabolismus nicht vollständig abgebaut werden.[13]
Nachweis
Der Nachweis und die Gehaltsbestimmung von Taririnsäure wie auch anderer Fettsäuren in Fetten wird in der Regel durch Gaschromatographie der Methylester durchgeführt; ergänzend kann eine Trennung der ungesättigten Fettsäuren mit Silbernitrat-Dünnschichtchromatographie erfolgen.[17]
Eine zweite Nachweismethode wäre die Bromwasserprobe auf Mehrfachbindungen.
Nutzung
Taririnsäure wird derzeit nicht kommerziell genutzt.
Einzelnachweise
- Xing-Cong Li, Melissa R. Jacob, Hala N. ElSohly, Dale G. Nagle, Troy J. Smillie, Larry A. Walker, Alice M. Clark: Acetylenic Acids Inhibiting Azole-Resistant from. In: Journal of Natural Products. Band 66, Nr. 8, August 2003, S. 1132–1135, doi:10.1021/np030196r.
- J. A. Barve, F. D. Gunstone: Fatty acids, Part 33 The synthesis of all the octadecynoic acids and all the trans-octadecenoic acids. In: Chemistry and Physics of Lipids. Band 7, Nr. 4, Dezember 1971, S. 311–323, doi:10.1016/0009-3084(71)90009-0.
- D. E. Ames, A. N. Covell, T. G. Goodburn: 164. Syntheses of long-chain acids. Part VI. Acetylenic acids and cis,cis-docosa-5,13-dienoic acid. In: Journal of the Chemical Society. 1965, S. 894, doi:10.1039/JR9650000894.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- M. Arnaud: Sur la constitution de l'acide taririque. In. Comt. Rend. 134, (1902), 473.
- M. A. Arnaud: Sur un novel acide gras non saturé de la série CnH2n-4O2. In: Compt. Rend. 114, (1892), 79.
- B. Grützner: Ueber einen krystallisirten Bestandtheil der Früchte von Picramnia camboita. In: Chemiker Zeitung. 100, (1893), 1851.
- Cl. Grimme: Über einige seltene Ölfrüchte. In: Chemische Revue über die Fett- und Harzindustrie. 17, (1910), 156.
- Cl. Grimme: Über das Fett von Picramnia lindeniana. In: Chemische Revue über die Fett- und Harzindustrie. 19, (1912), 51.
- G. F. Spencer, R. Kleiman, F. R. Earle, I. A. Wolff: The Trans-6 fatty acids of Picramnia sellowii seed oil. In: Lipids. Band 5, Nr. 3, März 1970, S. 285–287, doi:10.1007/BF02531458.
- M. B. Pearl, R. Kleiman, F. R. Earle: Acetylenic acids of Alvaradoa amorphoides seed oil. In: Lipids. Band 8, Nr. 11, November 1973, S. 627–630, doi:10.1007/BF02533146.
- R. Hänsel: 22. Lipide In: R. Hänsel, O. Sticher (Hrsg.): Pharmakognosie Phytopharmazie. 9. Auflage (2010), Springer, Heidelberg, ISBN 978-3-642-00962-4, S. 673–674, (eingeschränkte Vorschau in der Google-Buchsuche).
- Karl Bernhard, Kushal Yekundi, Ekkehard Kaempf: Das biologische Verhalten von Fettsäuren mit Dreifachbindung: III. Der Abbau der Taririnsäure. In: Helvetica Chimica Acta. Band 51, Nr. 2, Januar 1968, S. 373–376, doi:10.1002/hlca.19680510217.
- H. Lindlar: Ein neuer Katalysator für selektive Hydrierungen. In: Helv. Chim. Acta. 35, (1952), 446.
- T. Stuhlfauth, H. Fock, H. Huber, K. Klug: The distribution of fatty acids including petroselinic and tariric acids in the fruit and seed oils of the Pittosporaceae, Araliaceae, Umbelliferae, Simarubaceae and Rutaceae. In: Biochemical Systematics and Ecology. 13, 1985, S. 447–453, doi:10.1016/0305-1978(85)90091-2.
- Jon J. Kabara, Anthony J. Conley, Dennis M. Swieczkowski, I. A. Ismail, M. Lie Ken Jie, Frank D. Gunstone: Antimicrobial action of isomeric fatty acids on group A Streptococcus. In: Journal of Medicinal Chemistry. Band 16, Nr. 9, 1973, S. 1060–1063, doi:10.1021/jm00267a028.
- B. Breuer, T. Stuhlfauth, H. P. Fock: Separation of Fatty Acids or Methyl Esters Including Positional and Geometric Isomers by Alumina Argentation Thin-Layer Chromatography. In: Journal of Chromatographic Science. 25, 1987, S. 302–306, doi:10.1093/chromsci/25.7.302.