Carnitin-Acyltransferase-System
Das Carnitin-Acyltransferase-System ist in der Biologie ein wichtiges Transportsystem, bestehend aus mehreren Enzymen, das zum Transport von Fettsäuren in die Mitochondrien dient. Dort wird aus den Fettsäuren im Rahmen der β-Oxidation Energie gewonnen.
| Carnitin-Acyltransferase-System | ||
|---|---|---|
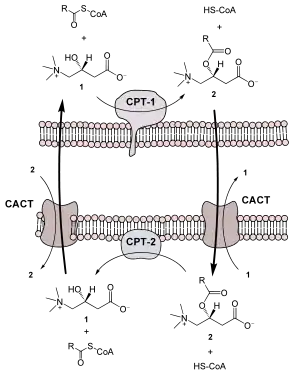 | ||
Das Carnitin-Acyltransferase-System. Damit die an L-Carnitin (1) gebundene Fettsäure (Acylcarnitin, 2) vom Intermembranraum in die Mitochondrienmatrix gelangen kann, wird eine Translokase (der Carnitin-Acylcarnitin-Transporter, CACT) benötigt. Die Carnitin-Acyltransferase 1 (auch als Carnitin-Palmitoyltransferase 1, CPT-1, bekannt) ist an der äußeren Mitochondrienmembran, die Carntin-Acyltransferase 2 (oder Carnitin-Palmitolytransferase 2, CPT-2) an der inneren Mitochondrienmembran lokalisiert. Malonyl-CoA inhibiert CPT-1. Es ist ein Produkt der Acetyl-CoA-Carboxylase und ein wichtiges Intermediat in der Fettsäuresynthese.[1] Die Größenverhältnisse in der Abbildung sind nicht maßstabsgetreu | ||
| Transporter-Klassifikation | ||
| TCDB | 4.C.2 | |
| Bezeichnung | CrAT family | |
Grundlagen
Triglyceride bestehen aus Fettsäuren und Glycerin, und sind wichtige Energiespeicher. Sie gelangen mit der Nahrungsaufnahme über die Speiseröhre und den Magen in den Dünndarm und werden durch Lipolyse mit Hilfe der Pankreas-Lipase, in freie Fettsäuren und Glycerin gespalten. Die beiden Produkte der Lipolyse können als Komplex mit Gallensäuren, so genannten Micellen, resorbiert, das heißt von den Epithelzellen des Dünndarms aufgenommen werden. In den Zellen werden aus den freien Fettsäuren und Glycerin wieder Triglyceride gebildet, die mit Apolipoproteinen verpackt und in Form von Chylomikronen über das Lymphsystem und die Blutbahn zu den Geweben transportiert werden.
Der Transport von Fettsäuren vom Zytosol in die mitochondriale Matrix, dem Ort der β-Oxidation, wird durch verschiedene Carnitin-Acyltransferasen, der Acyl-CoA-Synthetase sowie der Carnitin/Acylcarnitin-Translokase katalysiert. Nach bisherigem Verständnis existieren drei verschiedene Carnitin-Acyltransferasen mit unterschiedlichen Spezifitäten für unterschiedliche Kettenlängen der Substrate.[2] Im Einzelnen sind dies die Carnitin-Acyltransferase (CAT), die Carnitin-Oktanyltransferase (COT) und die Carnitin-Palmityltransferase (CPT).[3][4][5] Im Gegensatz zur CPT-Fraktion sind die CAT und COT vollständig löslich.
Genetik
Das Carnitin-Palmityltransferasesystem besteht aus zwei, immunologisch gegeneinander abgrenzbaren, auf unterschiedlichen Genen kodierten Komponenten: die Carnitin-Palmityltransferase 1 (CPT-1; EC 2.3.1.21) und die Carnitin-Palmityltransferase 2 (CPT-2). Während die CPT 2 als einzelnes Protein dem Chromosom 1 Genlocus p32 zugeordnet wurde, existieren für die Isoformen der CPT-1 jeweils eigene Gene, so dass die L-CPT 1 auf Chromosom 11 Genlocus q13 und die Muskelisoform (M-CPT 1) auf Chromosom 22 Genlocus q13.3 codiert ist.[6][7]
Einzelnachweise
- Thomas M. Devlin (Hrsg.): Textbook of Biochemistry with Clinical Correlations. Wiley & Sons; 6. Auflage 2005; ISBN 0-471-67808-2; S. 681.
- M. Zerbaum: Untersuchung der Substratspezifität der Carnitin Palmityltransferase 1 und 2 im menschlichen Skelettmuskel für geradzahlige Fettsäuren mit 8 bis 18 Kohlenstoffatomen. Originalarbeit.
- LL. Bieber: Carnitine. In: Ann Rev Biochem 57 (1988) 261–283; PMID 3052273; doi:10.1146/annurev.bi.57.070188.001401
- J. Bremer: Carnitine - metabolism and functions. In: Physiol Rev 63(4) (1983) 1420–1480; PMID 6361812
- S. Miyazawa et al.: Purification and properties of carnitine octanoyltransferase and carnitine palmitoyltransferase from rat liver. In: J Biochem 94(2) (1983); 529–542; PMID 6630173.
- C. H. Britton, D. W. Mackey u. a.: Fine chromosome mapping of the genes for human liver and muscle carnitine palmitoyltransferase I (CPT1A and CPT1B). In: Genomics. Band 40, Nummer 1, Februar 1997, S. 209–211, ISSN 0888-7543. doi:10.1006/geno.1996.4539. PMID 9070950.
- C. Gellera, E. Verderio u. a.: Assignment of the human carnitine palmitoyltransferase II gene (CPT1) to chromosome 1p32. In: Genomics. Band 24, Nummer 1, November 1994, S. 195–197, ISSN 0888-7543. doi:10.1006/geno.1994.1605. PMID 7896283.