Lactobacillsäure
Die Lactobacillsäure (englisch lactobacillic acid), wissenschaftlich 10-(2-Hexylcyclopropyl)decansäure, ist eine natürlich vorkommende chemische Verbindung aus der Gruppe der Fettsäuren. Als weitere Synonyme finden sich unter anderem Lactobacillussäure[3] und Phytomonsäure.[4] Die Salze heißen Lactobacillate. Eine Besonderheit ist der Cyclopropanring in der Kohlenstoffkette. Außerdem gehört die Lactobacillsäure mit 19 Kohlenstoffatomen zu den Fettsäuren mit einer ungeraden Anzahl an C-Atomen.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Lactobacillsäure | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C19H36O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 296,49 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Aceton, Chloroform, Diethylether und Petrolether[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Die Fettsäure wurde in den 1950er Jahren in Bakterien der Gattung Lactobacillus nachgewiesen, kommt allerdings auch bei zahlreichen anderen Bakterienarten vor. Die bakterielle Biosynthese der Lactobacillsäure erfolgt aus der cis-Vaccensäure (cis-11-Octadecensäure), einer ungesättigten Fettsäure, die ein Kohlenstoffatom weniger besitzt. Bakterien in einer Batch-Kultur bilden die Fettsäure am Ende der exponentiellen Phase des Wachstums oder in der frühen stationären Wachstumsphase. Bisherige Untersuchungen zeigen, dass die Biosynthese und Einlagerung der Lactobacillsäure in der Zellmembran mit einer schützenden Wirkung für die Bakterienzellen verbunden ist, ohne dass der genaue Mechanismus abschließend geklärt ist. In der Bakteriologie dient die Fettsäure vor allem analytischen Zwecken, beispielsweise bei der Identifizierung von Bakterien.
Geschichte
Entdeckung
In den 1950er Jahren forschte eine Arbeitsgruppe der Universität Pittsburgh an Bakterien der Gattung Lactobacillus, die Biotin als Wachstumsfaktor benötigen. Bereits vorher konnte gezeigt werden, dass Biotin nicht mehr notwendig für das Wachstum der Bakterien ist, falls stattdessen bestimmte Fettsäuren im Nährmedium vorhanden sind. Bei der Untersuchung des Einflusses von Biotin auf den Fettsäurestoffwechsel konzentrierten sich die Forscher zunächst auf die Art Lactobacillus arabinosus, die nach aktueller Systematik als Lactobacillus plantarum[5] geführt wird. Sie kultivierten die Bakterien in einem halbsynthetischen Nährmedium, ernteten die Zellen und extrahierten die „freien“ Lipide mit Aceton und Diethylether. Diese Fraktion macht etwa 20 % der Gesamtlipide aus. Um die „gebundenen“ Lipide zu erhalten, wurde anschließend eine saure Hydrolyse durchgeführt, bei der als Ester gebundene Fettsäuren freigesetzt und ebenfalls mit Diethylether extrahiert wurden.[6]
Die Fettsäuren wurden mit Diazomethan zu den Methylestern methyliert und mit Hilfe der fraktionierenden Destillation nach ihren Siedepunkten getrennt. Aufgrund der Destillationskurve wurde das Vorhandensein von Estern der C16-, C18- und C19-Fettsäuren erwartet. Die aus der C19-Fraktion erhaltene Fettsäure wies nach Reinigung durch Umkristallisation einen Schmelzpunkt bei 28–29 °C auf. Die Verbindung wurde mit zahlreichen physikalischen und chemischen Methoden untersucht und ihre Summenformel als C19H36O2 bestimmt. 1950 war dies erst die zweite Fettsäure mit 19 Kohlenstoffatomen, die aus Mikroorganismen isoliert wurde. Bereits 1929 wurde die Tuberkulostearinsäure (englisch tuberculostearic acid, Summenformel C19H38O2) entdeckt, die aus dem Tuberkulose-Erreger Mycobacterium tuberculosis isoliert wurde. In Analogie zu deren Namen schlugen die Biochemiker die englische Bezeichnung lactobacillic acid vor, da die Fettsäure aus einer Lactobacillus-Art stammte.[6] Auch aus Lactobacillus casei konnte die Lactobacillsäure isoliert werden.[7] In der Veröffentlichung betonten die Wissenschaftler die Auswirkungen ihrer Entdeckung, die im Widerspruch zu der damaligen Meinung stand, in der Natur würden nur Fettsäuren mit einer geraden Anzahl von Kohlenstoffatomen vorkommen.[8]
“The discovery in two lactobacilli of a fatty acid containing 19 carbon atoms raises some rather fundamental points and is in marked contrast to the accepted concept that the fatty acids of animal and plant tissues are mainly of the even carbon chain variety.”
„Die Entdeckung einer Fettsäure mit 19 Kohlenstoffatomen in zwei Lactobacillus-Arten wirft einige grundsätzliche Fragen auf und steht im deutlichen Gegensatz zur akzeptierten Auffassung, dass die Fettsäuren im Tier- und Pflanzengewebe hauptsächlich zum Typ der geradzahligen Kohlenstoffketten gehören.“
Strukturaufklärung
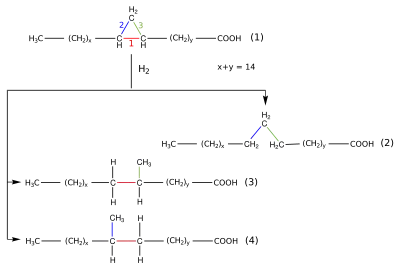
Die „freien“ und „gebundenen“ Lipide unterscheiden sich nicht bedeutend in ihrer Fettsäurezusammensetzung. Neben der Lactobacillsäure mit einem Anteil von 31 % sind noch Palmitinsäure (C16:0), Stearinsäure (C18:0) und cis-Vaccensäure (C18:1 cis-11) mit einem Anteil von 37 bzw. 2 bzw. 20 % enthalten. Die Untersuchungsergebnisse der neu entdeckten Fettsäure ergaben, dass es sich um eine gesättigte Fettsäure handelt. Sie ist gegenüber Oxidationsmitteln, die mit einer Doppelbindung in der Kohlenstoffkette reagieren würden, stabil. Bei der Reaktion mit Bromwasserstoff (HBr) erfolgt jedoch eine Addition von HBr im Molekül. Auch eine Hydrierung ist möglich, dabei entstehen mehrere isomere Fettsäuren mit der Summenformel C19H38O2, eine davon konnte als Nonadecansäure identifiziert werden. Bei der anderen Verbindung handelt es sich um eine verzweigtkettige Fettsäure mit einer Methylgruppe als Verzweigung (Methyloctadecansäure), wobei die Wissenschaftler zum damaligen Zeitpunkt nicht unterscheiden konnten, ob eine oder mehrere Isomere davon vorlagen. Basierend auf den Ergebnissen der chemischen und physikalischen (Infrarotspektroskopie und Röntgendiffraktometrie) Verfahren zur Strukturaufklärung wurde als Struktur eine gesättigte Fettsäure vorgeschlagen, die einen Cyclopropanring in der Kohlenstoffkette aufweist.[6] Der Cyclopropanring reagiert unter Öffnung des Rings mit Bromwasserstoff und ebenso mit Wasserstoff bei der Hydrierung (vergleiche Abbildung des Reaktionsschemas), ohne dass eine Doppelbindung vorhanden ist.
Nach der Entdeckung der Lactobacillsäure in den Lipiden von Lactobacillus arabinosus führte die Arbeitsgruppe um Klaus Hofmann ihre Untersuchungen an Lactobacillus casei fort und konnte auch aus dessen Lipiden die Fettsäure isolieren. Durch Vergleich mit synthetisch hergestellten Fettsäuren konnten sie die Lage des Cyclopropanrings bestimmen und schlugen als Bezeichnung 11,12-Methylenoctadecansäure (englisch 11,12-methyleneoctadecanoic acid) vor, ohne sich hinsichtlich der Stereoisomerie der Struktur festzulegen.[7] Die Bezeichnung Methylen verweist auf die Methylengruppe und kann auch für Ringglieder in Cycloalkanen verwendet werden. Die Ziffern dienen als Lokanten und beschreiben, an welcher Stelle der Cyclopropanring liegt. Von der Carboxygruppe aus gesehen sind die Kohlenstoffatome an Position 11 und 12 Bestandteil des Cyclopropanrings, dessen drittes Kohlenstoffatom – zusammen mit den daran gebundenen Wasserstoffatomen – als Methylen im Namen enthalten ist.
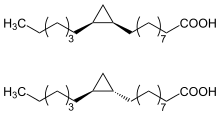
Vom Cyclopropanring aus betrachtet sind an zwei Kohlenstoffatomen jeweils unterschiedliche Substituenten vorhanden, so dass es zu einer cis-trans-Isomerie kommt (vergleiche Abbildung). Die Substituenten können auf der gleichen Seite (cis) oder auf unterschiedlichen Seiten (trans) der Ringbindung liegen. Welche Struktur tatsächlich vorliegt, konnten Hofmann u. a. bei der Entdeckung zunächst nicht klären. Jedoch stellten sie 1954 die Hypothese auf, dass das cis-Isomer vorliegt.[9] Dies wurde 2005 durch eine kanadische Forschergruppe bestätigt. Eine eindeutige Beschreibung der räumlichen Anordnung der Substituenten ist mit Hilfe der Cahn-Ingold-Prelog-Konvention möglich, nach dieser wird die absolute Konfiguration des Moleküls als 11R,12S angegeben.[10] Die davon abgeleitete Bezeichnung (11R,12S)-Methylenoctadecansäure ist gebräuchlich,[11][12][13] auch wenn sie nicht den Empfehlungen der IUPAC-Nomenklatur entspricht. Für die systematische Benennung der Lactobacillsäure wird die absolute Konfiguration vom Cyclopropanring aus angegeben, mit einem C6-Substituenten (Hexylgruppe) und einem C10-Substituenten, der die Carboxygruppe enthält (Decansäure), so dass man 10-[(1R,2S)-2-Hexylcyclopropyl]decansäure[4] erhält.
Etymologie
Lactobacillsäure und Lactobacillussäure sind Übersetzungen der englischen Bezeichnung lactobacillic acid, die die Wissenschaftler bei der Entdeckung dieser Fettsäure (1950) in einer Lactobacillus-Art vorgeschlagen haben. Dabei tritt in der deutschsprachigen Literatur die Bezeichnung Lactobacillsäure häufiger auf als Lactobacillussäure. Bereits 1938 wurde von einer anderen Forschergruppe eine ungewöhnliche Fettsäure aus dem Bakterium Agrobacterium tumefaciens (damals als Bacterium tumefaciens oder Phytomonas tumefaciens bezeichnet) isoliert[14] und nach dem Gattungsnamen als Phytomonsäure[4] (englisch phytomonic acid) bezeichnet. Diese gesättigte Fettsäure wies nach dem damaligen Kenntnisstand der Wissenschaftler die Summenformel C20H40O2 auf. Als Struktur wurde eine verzweigtkettige Fettsäure mit einer Methylgruppe als Verzweigung vorgeschlagen, Methylnonadecansäure.[15] Jedoch konnten K. Homann u. a. 1955 zeigen, dass es sich bei dieser aus Phytomonas tumefaciens isolierten Verbindung tatsächlich um Lactobacillsäure handelt. Nach ihren Angaben war die ursprünglich untersuchte Substanz verunreinigt gewesen.[16] Die Namen Lactobacillsäure bzw. Phytomonsäure werden sowohl für die Verbindung mit als auch ohne Angabe der absoluten Konfiguration verwendet.
Vorkommen
Vorkommen von Lactobacillsäure
Nach der Entdeckung der Lactobacillsäure in den Lipiden von Lactobacillus arabinosus konnte die Arbeitsgruppe um Klaus Hofmann auch in den Lipiden von Lactobacillus casei diese Fettsäure mit einem Gehalt von 16 % bestimmen.[7] Weiterhin ist sie bei L. acidophilus, L. buchneri,[17] L. delbrueckii subsp. bulgaricus, L. delbrueckii subsp. lactis, L. fermentum und L. helveticus mit einem Gehalt von 10 bis 30 % nachgewiesen worden.[18][17] Die Lactobacillsäure ist jedoch nicht auf Vertreter der Gattung Lactobacillus oder Milchsäurebakterien im Allgemeinen beschränkt. Die Fettsäure wurde ebenfalls in höheren Anteilen (10–20 %) bei gramnegativen Bakterien, wie Agrobacterium tumefaciens[16] und Escherichia coli[10] nachgewiesen, in geringeren Mengen (5–10 %) auch bei Serratia marcescens, Klebsiella aerogenes und Pseudomonas fluorescens.[19] Auch Brucella-Arten enthalten Lactobacillsäure,[20] ebenso wie Bordetella-Arten, der Gehalt liegt hier jedoch nur bei 1–2 %.[21]
Lactobacillsäure kommt sowohl bei grampositiven wie gramnegativen Bakterien vor, das Vorkommen erstreckt sich auf strikt aerobe, mikroaerophile, fakultativ und strikt anaerobe Gattungen. Obwohl die Fettsäure bei Bakterien weit verbreitet ist, ist sie nicht bei allen Gattungen zu finden. Bakterien, die keine ungesättigten Fettsäuren in den Membranlipiden aufweisen, besitzen auch keine Lactobacillsäure. Dies trifft insbesondere auf thermophile Bakterien und Archaeen zu. Eher selten ist die Fettsäure hingegen bei eukaryotischen Organismen zu finden.[22] Sie ist beispielsweise in Rapsöl enthalten, das wenig Erucasäure enthält (sogenannte LEAR-Sorten).[23]
Vorkommen weiterer Cyclopropanfettsäuren
Die Biosynthese und das Vorkommen der Lactobacillsäure ist eng verbunden mit der Dihydrosterculiasäure[24] (vergleiche Sterculiasäure), dabei handelt es sich ebenfalls um eine gesättigte Fettsäure mit der Summenformel C19H36O2, die einen Cyclopropanring enthält. Hier ist der Ring jedoch an den Positionen 9 und 10 der Kohlenstoffkette lokalisiert, folglich wird sie auch als cis-9,10-Methylenoctadecansäure bezeichnet.[22] Dihydrosterculiasäure kommt ebenfalls in den Lipiden von vielen Bakteriengattungen vor, wurde aber auch bei Eukaryoten gefunden, beispielsweise bei Protozoen aus der Gruppe der Trypanosomatida, hier bei den Gattungen Crithidia, Leishmania, Leptomonas, Herpetomonas und Phytomonas.[25] Nach einer 2014 veröffentlichten Untersuchung kommen Lactobacillsäure und Dihydrosterculiasäure auch in Kuhmilch in sehr geringen Mengen (< 0,1 % der Gesamtfettsäuren) vor, nicht jedoch in der Milch von Ziegen oder Schafen.[26]
Gewinnung und Darstellung
Extraktion
Die Lactobacillsäure lässt sich, wie von der Arbeitsgruppe bei der Entdeckung angewandt, aus den Lipiden der Bakterien isolieren. Dabei wird zunächst eine Hydrolyse (Verseifung) der Phospholipide oder Triglyceride durchgeführt, bei der die als Ester gebundene Fettsäure freigesetzt wird. Da neben Lactobacillsäure auch noch andere Fettsäuren vorhanden sind, erfolgt anschließend eine Auftrennung mit Hilfe der Harnstoff-Extraktiv-Kristallisation oder der Säulenchromatographie. Auch das Verfahren der fraktionierten Kristallisation kann angewendet werden.[27]
Chemische Synthese
Die chemische Synthese erfolgt ähnlich wie die Biosynthese, ausgehend von der ungesättigten Verbindung ohne Cyclopropanring, der Vaccensäure. In einer Simmons-Smith-Reaktion wird ein Carben an die Doppelbindung der ungesättigten Fettsäure addiert, zur Bildung des Carbens werden Diiodmethan und Zink eingesetzt. Die Simmons-Smith-Reaktion verläuft stereospezifisch, für die Darstellung von cis-11,12-Methylenoctadecansäure (Lactobacillsäure) wird die cis-11-Octadecensäure (cis-Vaccensäure) verwendet.[28] Diese kann natürlichen Ursprungs sein oder aus 11-Octadecinsäure synthetisiert werden.[7][29]
Biosynthese in Bakterien
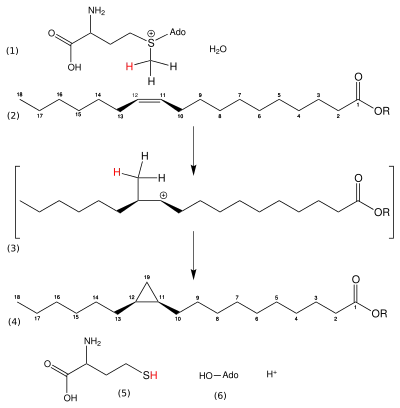
Die Biosynthese der Lactobacillsäure wurde in den Grundzügen bereits 1961 aufgeklärt.[30] Die Lactobacillsäure, wie auch weitere natürlich vorkommende Cyclopropanfettsäuren (englisch cyclopropane fatty acids, auch als CFA oder CPFA abgekürzt) werden aus den entsprechenden ungesättigten Fettsäuren gebildet, die ein Kohlenstoffatom weniger besitzen, und weisen am Cyclopropanring eine cis-Konfiguration auf.[22] Die Vorstufe der Lactobacillsäure (cis-11,12-Methylenoctadecansäure) ist somit die cis-Vaccensäure (cis-11-Octadecensäure). Dies wurde durch mit dem Kohlenstoff-Isotop 14C markierten Vorstufen gezeigt.[30]
Mit Hilfe des Enzyms Cyclopropanfettsäure-Synthase (EC 2.1.1.79) wird bei der cis-Vaccensäure eine Methylengruppe an der Doppelbindung addiert. Die Methylengruppe stammt von S-Adenosylmethionin. Die ungesättigte Fettsäure liegt dabei nicht frei vor, sondern ist als Ester innerhalb von Phospholipiden gebunden. Der Reaktionsmechanismus verläuft über die Bildung eines Carbokations. Das Enzym katalysiert die Reaktion nur bei ungesättigten Fettsäuren, deren Doppelbindung eine cis-Konfiguration aufweist, die entsprechenden trans-Isomere werden nicht umgesetzt.[22]
Die Bildung der CFA erfolgt bei der Kultivierung der Bakterien in einer Batch-Kultur eher plötzlich zu einem bestimmten Zeitpunkt als dass ihre Konzentration stetig zunehmen würde. Gleichzeitig wird die Abnahme der Konzentration der ungesättigten Fettsäure (als Vorstufe) beobachtet. Die Bildung der Cyclopropanfettsäure erfolgt am Ende der exponentiellen Phase des Wachstums oder in der frühen stationären Wachstumsphase.[22]
Biologische Bedeutung
Physiologische Bedeutung für Bakterien
Da die Entdeckung der Lactobacillsäure bei Bakterien erfolgte, die Biotin als Wachstumsfaktor benötigen, wurden in den 1950er Jahren zunächst Untersuchungen bei diesen Bakterien durchgeführt. Bei Lactobacillus plantarum (damals L. arabinosus), L. casei und L. delbrueckii wurde festgestellt, dass sie ohne Biotin wachsen können, wenn im Nährmedium Lactobacillsäure enthalten ist. L. acidophilus, für den Biotin nicht essentiell ist, wird durch Lactobacillsäure im Wachstum gefördert.[9] Inzwischen ist bekannt, dass Biotin ein wichtiger Bestandteil verschiedener Enzyme des Fettstoffwechsels ist, z. B. der Acetyl-CoA-Carboxylase und der Propionyl-CoA-Carboxylase. Weiter wurde damals erkannt, dass mehrere gesättigte Fettsäuren inhibitorische (hemmende) Wirkungen auf das bakterielle Wachstum haben, diese Wirkung jedoch durch Lactobacillsäure und einige ungesättigte Fettsäuren aufgehoben wird.[31] Seitdem konnte in mehreren Untersuchungen gezeigt werden, dass die Synthese von Lactobacillsäure für die entsprechenden Bakterien einen Vorteil darstellt, um sich an ungünstige Umweltbedingungen anzupassen. Beispiele dafür sind nicht optimale oder sogar extreme Temperaturen, sinkender pH-Wert im Medium oder der Eintritt in die stationäre Wachstumsphase.[32]
Die Bedeutung der Cyclopropanfettsäure-Synthese ist noch Gegenstand der Forschung. Zu diesem Zweck erfolgte eine Untersuchung von Mutanten von E. coli, denen das cfa-Gen fehlt, welches für das Enzym Cyclopropanfettsäure-Synthase codiert. Das Fehlen des Enzyms hat keinen negativen Einfluss auf das Wachstum und die Bakterien zeigen keine phänotypischen Unterschiede, mit der Ausnahme, dass Lactobacillsäure oder andere Cyclopropansäuren nicht unter den vorhandenen Fettsäuren auftreten.[22] Ein ähnliches Experiment wurde mit künstlich hergestellten Mutanten von Brucella abortus durchgeführt. Die Bakterien sind weiterhin in der Lage, sich in Makrophagen zu vermehren, Lactobacillsäure hat folglich keinen Einfluss auf den intrazellulären Lebenszyklus. Wenn die Bakterien jedoch in einem Nährmedium kultiviert werden, das einen niedrigen pH-Wert und eine hohe Osmolarität aufweist, ist im Vergleich zu den nicht veränderten Zellen geringeres Wachstum feststellbar. Diese Bedingungen lassen sich auf das Überleben von Brucella abortus in der Umwelt übertragen, auch dort kann eine saure Umgebung mit hoher Osmolarität auftreten. Die Mutanten, die keine Lactobacillsäure bilden, haben dort schlechtere Überlebenschancen und können folglich nicht so leicht auf einen Wirt übertragen werden, wie dies beispielsweise bei einer Schmierinfektion der Fall ist. Die Untersuchung des Promotors des cfa-Gens zeigt außerdem, dass die Exprimierung durch niedrigen pH-Wert und hohe Osmolarität gefördert wird, unter diesen Bedingungen also das Enzym CFA-Synthase gebildet wird.[33]
Aus Sicht des Energiestoffwechsels bedeutet die Bildung des Cyclopropanrings in der Lactobacillsäure einen relativ hohen Energieaufwand für die Zelle. Das als Überträger der Methylengruppe fungierende S-Adenosylmethionin muss anschließend wieder aus S-Adenosylhomocystein regeneriert werden. Dies ist pro Molekül mit der hydrolytischen Spaltung von drei ATP-Molekülen verbunden. Es wurde daher vermutet, dass der Cyclopropanring als Speicher für eine aktivierte Methylengruppe dient, um später folgende Methylierungsreaktionen zu ermöglichen. Dagegen spricht, dass zumindest bei E. coli der Gehalt an Lactobacillsäure konstant bleibt. Der Zeitpunkt der Biosynthese lässt vermuten, dass der Fettsäure eine schützende Wirkung der Bakterienzellen in der folgenden stationären Phase zukommt. Worin genau diese Schutzwirkung besteht, konnte aber trotz intensiver Forschung bisher nicht geklärt werden.[22]
Die Zusammensetzung der Fettsäuren in den Phospholipiden der Zellmembran beeinflusst deren Fluidität. Ein Austausch von cis-Vaccensäure durch Lactobacillsäure hat dabei unterschiedliche Auswirkungen, je nachdem an welcher Position des Glycerins die Fettsäure im Phosphoglycerid verestert ist. Innerhalb des für die meisten Lebewesen relevanten Temperaturbereiches führt der Einbau einer Fettsäure mit Cyclopropanring eher dazu, dass eine Temperaturänderung keinen großen Einfluss auf die Fluidität hat. Somit ist die Biomembran über einen etwas größeren Temperaturbereich fluide. Anders als es die enthaltene Struktur des Cyclopropans vermuten lässt, ist Lactobacillsäure – gebunden in den Phospholipiden – relativ stabil. Im Vergleich zur ungesättigten Fettsäure (als Vorstufe in der Biosynthese) ist sie sogar stabiler im Bezug auf milde Oxidationsmittel, wie bei der Behandlung mit Ozon (Ozonolyse) oder mit photochemisch gebildeten Singulett-Sauerstoff. Dies wird von einigen Forschern so gedeutet, dass der Einbau von Lactobacillsäure in der Zellmembran zwar keinen bedeutenden Einfluss auf die physikalischen Eigenschaften der Membran hat, aber dadurch deren chemische Eigenschaften verändert werden, was sich als Vorteil für den Organismus darstellt.[22]
Ein Beispiel für einen nützlichen Effekt der Lactobacillsäure liefert Oenococcus oeni. Das Milchsäurebakterium wird bei der Weinherstellung verwendet, um in der malolaktischen Gärung Äpfelsäure in Milchsäure umzuwandeln, die wiederum von Hefen zu Ethanol umgesetzt wird. Auf diese Weise wird der Säuregehalt des Weines verringert. Dabei ist Oenococcus oeni relativ hohen Konzentrationen an Ethanol ausgesetzt, das in der alkoholischen Gärung durch Hefen produziert wird. Untersuchungen der Zellmembran des Bakteriums ergaben, dass mit zunehmender Ethanolkonzentration im umgebenden Nährmedium die Biosyntheserate der Phospholidide gesteigert wird. Außerdem wird vermehrt Lactobacillsäure in den Membranlipiden gebildet, während der Gehalt an cis-Vaccensäure sinkt. Dies wird als Schutzmechanismus gegen die toxischen Effekte des Ethanols gedeutet. Die Bildung von Lactobacillsäure hilft dem Bakterium, sich an die ungünstigen Umweltbedingungen anzupassen.[34] Eine ähnliche Schutzwirkung wurde bei L. delbrueckii subsp. bulgaricus entdeckt. Er zeigt eine verbesserte Überlebensfähigkeit gegenüber Gefriertrocknung, wenn in der Zellmembran mehr Lactobacillsäure vorhanden ist.[35]
Die probiotische Wirkung von Lactobacillus reuteri wird auf immunmodulierende Substanzen zurückgeführt, die beim Menschen die Produktion des Cytokins TNF (Tumornekrosefaktor) hemmen. Die Untersuchung der Membranlipide verschiedener Stämme von Lactobacillus reuteri zeigt, dass nur die TNF-hemmenden Stämme Lactobacillsäure aufweisen. Auch hier wurde im Experiment das cfa-Gen in einem Lactobacillsäure-produzierenden Bakterienstamm inaktiviert und die Mutanten kultiviert. Der Überstand wurde in einer Zellkultur getestet und unterdrückt – im Gegensatz zu dem Überstand des Wildtyps – die Produktion von TNF. Allerdings führt ein Zusatz von Lactobacillsäure als Reinstoff nicht zur Hemmung der Cytokinproduktion. Somit ist die Fettsäure nur indirekt an der immunmodulierenden Aktivität von L. reuteri beteiligt, als mögliche Erklärung wird eine veränderte Membranfluidität genannt.[36]
Klassifizierung und Identifizierung von Bakterien
Mit der Entwicklung der instrumentellen Verfahren zur Fettsäureanalytik ist der Nachweis verschiedener Fettsäuren in Bakterien seit den 1970er Jahren ein gängiges Untersuchungsmerkmal geworden. Oft werden die Fettsäuremuster zur taxonomischen Einordnung benutzt, da verwandte Arten oft eine ähnliche Zusammensetzung der Fettsäuren in den Lipiden aufweisen.[37] So kann das Muster der Fettsäureverteilung genutzt werden, um Brucella- und Bordetella-Arten voneinander zu unterscheiden.[20] Untersuchungsergebnisse von 2013 zeigen, dass das Vorkommen von Lactobacillsäure bei Brucella canis abhängig von der geografischen Herkunft der Bakterienstämme ist und deuten darauf hin, dass nur humanpathogene Stämme diese Fettsäure enthalten.[12] Auch zur Unterscheidung von Weissella-Arten[38] oder anderen Milchsäurebakterien[39] untereinander eignet sich die Untersuchung des Fettsäuremusters einschließlich Lactobacillsäure und anderer Cyclopropanfettsäuren.
Nachweis
Der Nachweis wie auch die quantitative Bestimmung von Lactobacillsäure erfolgt – wie bei Fettsäuren üblich – durch Gaschromatographie des Methylesters, oft als Gaschromatographie mit Massenspektrometrie-Kopplung (GC/MS).[23] Wegen des Cyclopropanrings muss jedoch auf ein geeignetes Methylierungsreagenz geachtet werden.[19] Nicht geeignet ist beispielsweise Chlorwasserstoff in wasserfreiem Methanol, da dieses Reagenz mit dem Cyclopropanring reagieren kann, wobei dann eine verzweigtkettige Fettsäure mit einer Methoxygruppe entsteht. Gut geeignet ist hingegen Natriummethanolat in wasserfreiem Methanol, ebenso wie Natriumhydroxid oder Kaliumhydroxid in Methanol.[22] Besonders für die Strukturaufklärung mit Hilfe von Massenspektrometrie-Verfahren wird die Bildung der 3-Pyridylmethylester (Picolinylester) mit Nicotinylalkohol (Pyridylmethanol) empfohlen.[24]
Einzelnachweise
- Lactobacillic acid / Phytomonic acid. In: Website The official database of Japanese Conference on the Biochemistry of Lipids (JCBL). 19. Juni 2007, abgerufen am 24. März 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Claus Franzke (Hrsg.): Allgemeines Lehrbuch der Lebensmittelchemie. 3. Auflage. Behr’s Verlag, Hamburg 1996, ISBN 3-86022-234-1, S. 69.
- Lactobacillic acid (CHEBI:34811). In: Website The database and ontology of Chemical Entities of Biological Interest. 25. Februar 2011, abgerufen am 24. März 2014.
- Taxonomy Browser Lactobacillus plantarum. In: Website des National Center for Biotechnology Information (NCBI). Abgerufen am 24. März 2013.
- K. Hofmann, R. A. Lucas, S. M. Sax: The chemical nature of the fatty acids of Lactobacillus arabinosus. In: The Journal of Biological Chemistry. Band 195, Nr. 2, April 1952, S. 473–485, PMID 14946156.
- K. Hofmann, S. M. Sax: The chemical nature of the fatty acids of Lactobacillus casei. In: The Journal of Biological Chemistry. Band 205, Nr. 1, November 1953, S. 55–63, PMID 13117883.
- K. Hofmann, R. A. Lucas, S. M. Sax (1952): The chemical nature of the fatty acids of Lactobacillus arabinosus. S. 473–485, hier S. 484.
- K. Hofmann, C. Panos: The biotin-like activity of lactobacillic acid and related compounds. In: The Journal of Biological Chemistry. Band 210, Nr. 2, Oktober 1954, S. 687–693, PMID 13211606.
- L. J. Stuart, J. P. Buck u. a.: Configurational analysis of cyclopropyl fatty acids isolated from Escherichia coli. In: Organic Letters. Band 8, Nr. 1, Januar 2006, S. 79–81, doi:10.1021/ol052550d. PMID 16381572.
- Lactobacillic acid. In: Website Lipid Maps. Abgerufen am 26. März 2014.
- A. Brower, N. Lucero u. a.: Newly identified variability in Brucella canis fatty-acid content is associated with geographical origin. In: Epidemiology and Infection. Band 141, Nr. 4, April 2013, S. 852–858, doi:10.1017/S0950268812001240. PMID 23174310.
- Lactobacillic acid, Phytomonic acid, (11R,12S)-methylene-octadecanoic acid. In: Website The official database of Japanese Conference on the Biochemistry of Lipids (JCBL). Abgerufen am 28. März 2014.
- E. Chargaff, M. Levine: The Lipids of Bacterium tumefaciens. In: The Journal of Biological Chemistry. Band 124, 1938, S. 195–205.
- S. F. Velick, R. J. Anderson: The chemistry of Phytomonas tumefaciens: II. The composition of the acetone-soluble fat. In: The Journal of Biological Chemistry. Band 152, 1944, S. 523–531, online.
- K. Hofmann, F. Tausig: On the identity of phytomonic and lactobacillic acids; a reinvestigation of the fatty acid spectrum of Agrobacterium (Phytomonas) tumefaciens. In: The Journal of Biological Chemistry. Band 213, Nr. 1, März 1955, S. 425–432, PMID 14353943.
- T. Johnsson, P. Nikkila u. a.: Cellular Fatty Acid profiles of lactobacillus and lactococcus strains in relation to the oleic Acid content of the cultivation medium. In: Applied and Environmental Microbiology. Band 61, Nr. 12, Dezember 1995, S. 4497–4499, PMID 16535200. PMC 1388665 (freier Volltext).
- J. H. Veerkamp: Fatty acid composition of Bifidobacterium and Lactobacillus strains. In: Journal of Bacteriology. Band 108, Nr. 2, November 1971, S. 861–867, PMID 5128337. PMC 247153 (freier Volltext).
- B. L. Brian, E. W. Gardner: A simple procedure for detecting the presence of cyclopropane fatty acids in bacterial lipids. In: Applied Microbiology. Band 16, Nr. 4, April 1968, S. 549–552, PMID 4869615. PMC 547466 (freier Volltext).
- E. Jantzen, E. Knudsen, R. Winsnes: Fatty acid analysis for differentiation or Bordetella and Brucella species. In: Acta pathologica, microbiologica, et immunologica Scandinavica. Section B, Microbiology. Band 90, Nr. 5, Oktober 1982, S. 353–359, PMID 6293245.
- P. Vandamme, M. Heyndrickx, M. Vancanneyt, B. Hoste, P. De Vos, E. Falsen, K. Kersters, K.-H. Hinz: Bordetella trematum sp. nov., isolated from wounds and ear infections in humans, and reassessment of Alcaligenes denitrificans Rüger and Tan 1983. In: International Journal of Systematic Bacteriology. Band 46, Nr. 4, Oktober 1996, S. 849–858, doi:10.1099/00207713-46-4-849. PMID 8863408.
- D. W. Grogan, J. E. Cronan: Cyclopropane ring formation in membrane lipids of bacteria. In: Microbiology and Molecular Biology Reviews : MMBR. Band 61, Nr. 4, Dezember 1997, S. 429–441, PMID 9409147. PMC 232619 (freier Volltext). (Review).
- O. Berdeaux, S. Gregoire u. a.: Detection of lactobacillic acid in low erucic rapeseed oil – A note of caution when quantifying cyclic fatty acid monomers in vegetable oils. In: Chemistry and Physics of Lipids. Band 163, Nr. 7, September 2010, S. 698–702, doi:10.1016/j.chemphyslip.2010.07.002. PMID 20654602.
- William W. Christie: Fatty Acids: Natural alicyclic – Structures, Occurence and Biochemistry. (PDF; 137 kB) In: Website der AOCS Lipid Library. 27. Januar 2014, abgerufen am 9. März 2014.
- W. R. Fish, G. G. Holz u. a.: The cyclopropane fatty acid of trypanosomatids. In: Molecular and Biochemical Parasitology. Band 3, Nr. 2, Juni 1981, S. 103–115, PMID 7254247.
- A. Caligiani, A. Marseglia, G. Palla: An Overview on the Presence of Cyclopropane Fatty Acids in Milk and Dairy Products. In: Journal of Agricultural and Food Chemistry. [elektronische Veröffentlichung vor dem Druck] Juli 2014, doi:10.1021/jf4057204. PMID 25033416.
- Hans-Dieter Belitz, Walter Grosch: Lehrbuch der Lebensmittelchemie. 4. Auflage. Springer Verlag, Heidelberg/Berlin 1992, ISBN 3-540-55449-1, S. 151–155.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 21. Auflage. Hirzel Verlag, Stuttgart 1988, ISBN 3-7776-0438-0, S. 189, 390.
- Kamaluddin Ahmad, F. Merlin Bumpus, F. M. Strong: A Synthesis of cis-11-Octadecenoic and trans-11-Octadecenoic (Vaccenic) Acids. In: Journal of the American Chemical Society. Band 70, Nr. 10, Oktober 1948, S. 3391–3394, doi:10.1021/ja01190a051.
- T. Y. Liu, K. Hofmann: Cyclopropane ring blosynthesis. In: Biochemistry. Band 1, Nr. 1, Januar 1962, S. 189–191, doi:10.1021/bi00907a028. PMID 14465960.
- Merrill N. Camien, Max S. Dunn: Saturated fatty acids as bacterial antimetabolites. In: Archives of Biochemistry and Biophysics. Band 70, Nr. 2, August 1957, S. 327–345, doi:10.1016/0003-9861(57)90121-2.
- M. Suutari, S. Laakso: Temperature adaptation in Lactobacillus fermentum: interconversions of oleic, vaccenic and dihydrosterulic acids. In: Journal of General Microbiology. Band 138, Nr. 3, März 1992, S. 445–450, doi:10.1099/00221287-138-3-445.
- L. Palacios-Chaves, A. Zúñiga-Ripa u. a.: Identification and functional analysis of the cyclopropane fatty acid synthase of Brucella abortus. In: Microbiology. Band 158, Nr. 4, April 2012, S. 1037–1044, doi:10.1099/mic.0.055897-0. PMID 22262102.
- H. Teixeira, M. G. Gonçalves u. a.: Lactobacillic acid accumulation in the plasma membrane of Oenococcus oeni: a response to ethanol stress? In: Microbial Ecology. Band 43, Nr. 1, Januar 2002, S. 146–153, doi:10.1007/s00248-001-0036-6. PMID 11984636.
- Chun Li, Jia-Liang Zhao u. a.: Synthesis of cyclopropane fatty acid and its effect on freeze-drying survival of Lactobacillus bulgaricus L2 at different growth conditions. In: World Journal of Microbiology and Biotechnology. Band 25, Nr. 9, September 2009, S. 1659–1665, doi:10.1007/s11274-009-0060-0.
- S. E. Jones, K. Whitehead u. a.: Cyclopropane fatty acid synthase mutants of probiotic human-derived Lactobacillus reuteri are defective in TNF inhibition. In: Gut Microbes. Band 2, Nr. 2, März/April 2011, S. 69–79, PMID 21637024. PMC 3225771 (freier Volltext).
- T. Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiological Reviews. Band 55, Nr. 2, Juni 1991, S. 288–302, PMID 1886522. PMC 372815 (freier Volltext). (Review).
- J. Samelis, J. Rementzis u. a.: Usefulness of rapid GC analysis of cellular fatty acids for distinguishing Weissella viridescens, Weissella paramesenteroides, Weissella hellenica and some non-identifiable, arginine-negative Weissella strains of meat origin. In: Systematic and Applied Microbiology. Band 21, Nr. 2, Juni 1998, S. 260–265, doi:10.1016/S0723-2020(98)80031-3. PMID 9704112.
- R. Gilarová, M. Voldřich u. a.: Cellular fatty acids analysis in the identification of lactic acid bacteria. In: International Journal of Food Microbiology. Band 24, Nr. 1–2, Dezember 1994, S. 315–319, doi:10.1016/0168-1605(94)90129-5.
Literatur
- Klaus Hofmann, Robert A. Lucas, Sylvan M. Sax: The chemical nature of the fatty acids of Lactobacillus arabinosus. In: The Journal of Biological Chemistry. Band 195, Nr. 2, 1952, S. 473–485, PMID 14946156 (PDF, 1,2 MB).
- Dennis W. Grogan, John. E. Cronan, Jr.: Cyclopropane ring formation in membrane lipids of bacteria. In: Microbiology and Molecular Biology Reviews : MMBR. Band 61, Nr. 4, 1997, S. 429–441, PMC 232619 (freier Volltext).