Prostaglandine
Prostaglandine sind chemische Verbindungen aus der Gruppe der Eicosanoide. Sie wirken im menschlichen und höheren tierischen Organismus als Gewebshormone und kommen mit verschiedener Struktur und Funktion überall im Organismus vor. Besonders reich sind sie im Sperma vertreten.
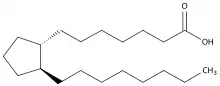
Das chemische Grundgerüst der Prostaglandine (PG) ist die Prostansäure. Drei mehrfach ungesättigte C20-Fettsäuren sind jeweils Ausgangsstoff für die Biosynthese der Prostaglandine.
Wegen ihrer vielfältigen physiologischen und pathophysiologischen Wirkungen ist der Einsatz von Prostaglandinen und ihrer synthetischen Strukturabkömmlinge von therapeutischem Interesse.
Entdeckung
Der Name prostaglandin ist von englisch prostate gland (Prostata-Drüse) abgeleitet. 1935 wurden Prostaglandine zum ersten Mal von dem schwedischen Physiologen Ulf von Euler,[1] und davon unabhängig von Maurice Walter Goldblatt,[2] im menschlichen Sperma isoliert und beschrieben. Man glaubte damals, dass sie ein spezifischer Teil der Prostatasekretion seien, doch wurde später entdeckt, dass diese Stoffe an den unterschiedlichsten Körperstellen ausgeschüttet werden, unter anderem auch in der Bläschendrüse. Prostaglandine sind ferner im menstruellen Ausfluss, im Gehirn, in der Lunge, in den Nieren und in der Bauchspeicheldrüse vorhanden.
1962 isolierten die schwedischen Wissenschaftler Sune Bergström und Bengt Ingemar Samuelsson kristallisierbare Derivate, die ihrer Löslichkeit nach als PGE (Ether-löslich) bzw. PGF (Phosphat-löslich; schwedische Schreibweise) klassifiziert werden.[3] 1982 erhielten die beiden sowie der Brite John Robert Vane gemeinsam den Nobelpreis „für ihre bahnbrechenden Arbeiten über Prostaglandine und verwandte biologisch aktive Substanzen“.
Außerhalb höherer Organismen wurde das Prostaglandin A2 (PGA2) in der karibischen Hornkoralle Plexaura homomalla gefunden.[4]
Biosynthese
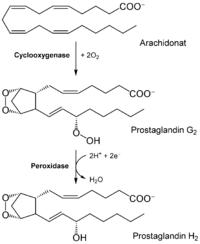
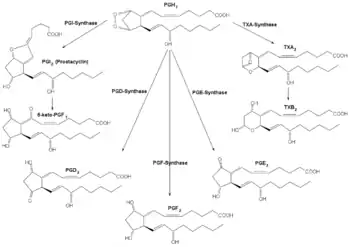
Die Prostaglandinsynthese und der Fettstoffwechsel sind eng miteinander verbunden. Aus dem Fettstoffwechsel stammen drei mehrfach ungesättigte C20-Fettsäuren, die Ausgangssubstanzen für die Prostaglandinbiosynthese darstellen:
- Dihomogammalinolensäure (DGLA), eine Eicosatriensäure aus der Gruppe der Omega-6-Fettsäuren
- Arachidonsäure (AA), eine Eicosatetraensäure und ebenfalls Omega-6-Fettsäure
- Eicosapentaensäure (EPA), eine Omega-3-Fettsäure
Unter Beteiligung der Cyclooxygenasen (COX-1 und COX-2) und von Prostaglandin-Synthasen entstehen daraus die Prostaglandine der Serien I, II und III. Entscheidend ist dabei die Einführung eines Sauerstoffmoleküls und anschließende Ringbildung mit fünf Kohlenstoffatomen.
Besteht eine Biosynthesestörung bei Omega-3- und Omega-6-Fettsäuren, so können Serie-I- und Serie-III-Prostaglandine nicht gebildet werden. Serie-II-Prostaglandine sind nicht betroffen, da der Ausgangsstoff Arachidonsäure in jedem tierischen Fett vorkommt, und das Enzym Cyclooxygenase auch immer präsent ist.
Terminologie und Einteilung
Die Prostaglandine werden, je nach Ausgangspunkt der Biosynthese, in drei Hauptgruppen eingeteilt:[6]
- Serie-I-Prostaglandine (aus der Dihomogammalinolensäure), erkennbar an der Indexzahl 1: Sie wirken unter anderem stark entzündungshemmend und mindern die Blutgerinnung. Beispiele für PG dieser Serie sind:
- Prostaglandin A1 (PGA1)
- Prostaglandin E1 (PGE1)
- Serie-II-Prostaglandine (aus der Arachidonsäure), tragen die Indexzahl 2: Ihre Wirkung ist der der Serie-I-Prostaglandine entgegengesetzt. Sie fördern Entzündungen, verengen die Blutgefäße, verstärken die Blutgerinnung und verstärken die Schmerzwahrnehmung. Sie lösen im Körper die notwendigen Maßnahmen aus, um auf Wunden oder andere Verletzungen zu reagieren.
- Zu den Serie-II-Prostaglandinen gehören:
- Prostaglandin D2 (PGD2)
- Prostaglandin E2 (PGE2)
- Prostaglandin F2α (PGF2α) und Prostaglandin F2β (PGF2β) :
- Prostaglandin G2 (PGG2)
- Prostaglandin H2 (PGH2)
- Prostaglandin I2 (PGI2) oder auch Prostacyclin genannt.
- Serie-III-Prostaglandine (aus der Eicosapentaensäure), Indexzahl 3: Neben verschiedenen anderen Funktionen verringern sie die Entstehung der Serie-II-Prostaglandine und werden deshalb oft als entzündungshemmend beschrieben.
- Prostaglandin E3 (PGE3)
Die Indexzahlen bedeuten: 1 = Δ13E, 2 = Δ5Z,13E und 3 = Δ5Z,13E,17Z
Die natürlich vorkommenden, biologisch aktiven PG besitzen eine 15(S)-Hydroxygruppe. Je nach Zahl und Stellung der Sauerstoffatome und der Lage der Doppelbindung im Cyclopentanring werden die PG durch Buchstaben gekennzeichnet.
Es bedeuten: A = 9-Oxo-10-dehydro-,
B = 9-Oxo-8(12)-dehydro-,
C = 9-Oxo-11-dehydro-,
D = 9-Oxo-10-dehydro-,
E = 9-Hydroxy-11-oxo-,
F = 9,10-dihydroxy-,
G und H = 9,11-peroxido-,
I = 6,9-Epoxy-11-hydroxy- und
J = 11-Oxo-8(9)-dehydro-[6]
Strukturell verwandt mit den PG sind die Thromboxane (TX), die aus PGH durch Integration eines O-Atoms am C-11 in den Cyclopentanring hervorgehen.
Wirkungsmechanismus
Prostaglandine modulieren Second-Messenger-Systeme. Ihre Wirkung ist überaus divers, da sie zwischen den verschiedenen Prostaglandinen variiert und teilweise sogar für ein Prostaglandin durch unterschiedliche Rezeptoren unterschiedlich vermittelt wird.
Prostaglandinrezeptoren gehören zu der Gruppe der G-Protein-gekoppelten Membranrezeptoren. Sie werden durch den Buchstaben „P“ und das Präfix „D“, „E“, „F“, „I“ oder „T“ bezeichnet, um eine Präferenz für die Prostaglandine D, E, F, I oder Thromboxane zu kennzeichnen. Bis 2004 wurden vier Subtypen des EP-Rezeptors identifiziert: EP1 bis EP4.
Darüber hinaus gibt es einige Prostaglandine (z. B. PGJ2), die Kernrezeptoren der PPAR-Klasse aktivieren können, welche IκB-Kinase hemmen und dadurch den NF-κB-Weg hemmen. Das vom PGF2α abgeleitete Bimatoprost wirkt durch seine Amidstruktur nicht an PG-Rezeptoren, sondern an Prostamid-Rezeptoren.
Die Wirkungen im Einzelnen sind in den Hauptartikeln zu den einzelnen Prostaglandinen dargestellt.
Einflussnahme auf die Prostaglandinwirkung
Das Hauptaugenmerk in der Pharmaforschung liegt auf den Prostaglandinen aus der Arachidonsäure (Serie-II), da diese für Schmerz, Blutgerinnung, Entzündungen und andere physiologische und pathophysiologische Vorgänge verantwortlich sind. Verschiedene, speziell chronische, Krankheitsbilder wie Rheuma, Asthma, Schmerzzustände, Allergien und Bluthochdruck entstehen unter Beteiligung der Serie-II-Prostaglandine. Ziel ist die Wirkung der Serie-II-Prostaglandine zu hemmen. Typische Arzneistoffe, deren Wirkung hier ansetzt, sind die nichtsteroidalen Antiphlogistika (z. B. Acetylsalicylsäure). Solche Medikamente hemmen jedoch nicht nur die Serie-II-Prostaglandine, sondern auch deren natürliche Gegenspieler aus den Serien I und III.
Auch durch diätetische Maßnahmen wird versucht, die Ausprägung der Prostaglandine aller drei Serien zu beeinflussen.[7][8] Beschrieben sind:
- direkte Aufnahme der Substrate, nämlich DGLA (z. B. in Nachtkerzenöl vorkommend), EPA (z. B. in Fischöl) oder AA,[9]
- Beeinflussung der Syntheserate von AA durch Linolensäure (im Leinöl), Ölsäure[10][11] (z. B. in Olivenöl) oder andere Stoffe, die das AA-bildende Enzym Delta-5-desaturase binden.
Übersicht über medizinisch verwendete Prostaglandine und Analoga
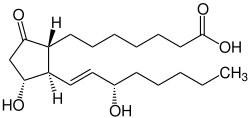
Von den natürlich vorkommenden Prostaglandinen (PG) werden das PGE1 (Freiname: Alprostadil), PGE2 (Freiname: Dinoproston), PGF2α (Freiname: Dinoprost) und PGI2 (Prostacyclin, Freiname: Epoprostenol) therapeutisch verwendet. Auch die spezifischen Wirkungen mehrerer synthetischer Abkömmlinge von Prostaglandinen werden in Anwendungsgebieten verschiedener medizinischer Fachrichtungen eingesetzt.
Kardiovaskuläre Wirkung
Die vasoaktive und thrombozytenaggregationshemmende Aktivität der PG wird in der Angiologie (Gefäßmedizin) zur Verbesserung der Durchblutung bei problematischen arteriellen Gefäßverschlüssen oder Gefäßverengungen genutzt, ferner gibt es Anwendungsgebiete in der Urologie, Kardiologie und Notfallmedizin. Die Wirkstoffe sind:
- Alprostadil zur intraarteriellen Behandlung der chronischen arteriellen Verschlusskrankheit (Prostavasin), intravenös zur zeitweiligen Aufrechterhaltung der Durchgängigkeit des Ductus arteriosus Botalli von Neugeborenen mit angeborenen Herzfehlern (Minprog) oder topisch zur Behandlung der erektilen Dysfunktion (Caverject, Muse)
- Prostacyclin zur parenteralen Behandlung der pulmonalen Hypertonie (Veletri)
- das synthetische Prostacyclin-Analogon Iloprost für die parenterale Behandlung der Thrombangiitis obliterans (Ilomedin) und zur inhalativen Behandlung der primären pulmonalen Hypertonie (Ventavis).
- Treprostinil, ebenfalls ein Prostazyklin-Analogon, zur Behandlung pulmonal-arterieller Hypertonie (Remodulin); wird subkutan oder intravenös infundiert.
Wirkung auf Säure- und Schleimsekretion des Magens
In der Gastroenterologie wird das PGE1-Analogon
- Misoprostol zur Prävention von Magenschleimhautschäden bei Langzeiteinnahme nichtsteroidaler Antiphlogistika eingesetzt (Cytotec).
Es ist oral wirksam und kann auch in fixer Kombination mit Diclofenac verabreicht werden.
Wirkung auf Uterus und Zervix
In der Gynäkologie sind folgende Wirkstoffe aufgrund ihrer uteruskontrahierenden und zervixerweichenden Wirkung angezeigt:
- Dinoproston (Minoprost E2), vaginal angewendet, zur medizinisch indizierten Geburtseinleitung durch Auslösung von Wehen bei Schwangeren mit unreifer Zervix oder zur Einleitung der Zervixreifung in der Spätschwangerschaft. Off-label erfolgt der Einsatz zur Weheneinleitung als Unterstützung bei einem medikamentösen Schwangerschaftsabbruch.
- Misoprostol zur oralen Behandlung von Blutungskomplikationen, zur Weheneinleitung, zur Auslösung einer verhaltenen Fehlgeburt und zur Unterstützung des medikamentösen Schwangerschaftsabbruchs. Diese gynäkologischen bzw. geburtshilflichen Anwendungen erfolgen weitgehend im Off-Label-Gebrauch, da sie nur in wenigen Ländern zugelassen sind.
- Der PGE2-Abkömmling Sulproston intravenös verabreicht (Nalador) zur Einleitung eines Abortes oder einer Geburt bei intrauterinem Fruchttod (Totgeburt), ferner zur Hemmung einer postpartalen atonischen Blutung.
- Gemeprost, ein weiteres PGE2-Analogon, vaginal appliziert zur Zervixerweichung und -erweiterung als Vorbereitung auf eine Ausräumung des Uterus bei Nichtschwangeren und Schwangeren.
Wirkung auf den Gelbkörper
- PGF2α (Dinoprost) und
- seine Analoga Cloprostenol und Luprostiol haben stark luteolytische Eigenschaften. Sie werden tiermedizinisch (z. B. bei Schweinen, Rindern, Pferden) intramuskulär zur Verlegung des Brunst- und Ovulationszeitpunktes sowie zum Trächtigkeitsabbruch und zur Geburtseinleitung gegeben.
Wirkung am Auge
Synthetische PGF2α-Analoga senken den Augeninnendruck (IOD) durch Verbesserung des Kammerwasserabflusses.[12] Sie werden daher in der Augenheilkunde eingesetzt zur Senkung des erhöhten Augeninnendrucks bei Patienten mit Offenwinkelglaukom (Grüner Star) und bei okulärer Hypertension. Verwendet werden:
- Latanoprost (Xalatan)
- Travoprost (Travatan)
- Tafluprost (Taflotan)
- Bimatoprost (Lumigan)
Die Stoffe können auch als Kombinationspräparate mit dem Betablocker Timolol zur Anwendung kommen, wenn die Einzelstoffe nicht ausreichend wirksam sind. In den USA ist Bimatoprost ferner zur Therapie von Wimpernwachstumsstörungen zugelassen (Latisse). Eine wimpernwachstumsfördernde Wirkung soll auch Cloprostenol aufweisen, das kosmetisch genutzt wird (Wimpernwachstumsserum).
Literatur
- Peter Welzel: Prostaglandine. In: Chemie in unserer Zeit. Band 7, Nr. 2, 1973, S. 43–48, doi:10.1002/ciuz.19730070203.
- Berg/Tymoczko/Stryer: Biochemie./, 5. Auflage, Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3827413036.
- Mutschler, Ernst: Mutschler Arzneimittelwirkungen. Pharmakologie, klinische Pharmakologie, Toxikologie. 10. Auflage, Stuttgart 2013.
Einzelnachweise
- Von Euler US: Über die spezifische blutdrucksenkende Substanz des menschlichen Prostata- und Samenblasensekrets. In: Wien Klin Wochenschr. 14, Nr. 33, 1935, S. 1182–3. doi:10.1007/BF01778029.
- Goldblatt MW: Properties of human seminal plasma. In: J Physiol. 84, Nr. 2, Mai 1935, S. 208–18. PMID 16994667. PMC 1394818 (freier Volltext).
- Bergström and Samuelsson: Isolation of prostaglandin E1 from human seminal plasma. Prostaglandins and related factors. (PDF; 744 kB) In: J. Biol. Chem. 1962(9); 237:3005-6; PMID 13867832 (freier Volltextzugriff).
- Donald J. Gerhart: Prostaglandin A2: an agent of chemical defense in the Caribbean gorgonian Plexaura homomalla. Mar. Ecol. Prog. Ser., Vol. 19, 1984; S. 181–187.
- Simmons DL, Botting RM and Hla T: Cyclooxygenase Isoenzymes: The Biology of Prostaglandin Synthesis and Inhibition. (PDF; 2,0 MB) Pharmacological Reviews 2004;56(3):387-437; PMID 15317910.
- E. Teuscher: Biogene Arzneimittel. 5. Auflage, Wissenschaftliche Verlagsgesellschaft, 1997, S. 411.
- Hu et al.: Types of dietary fat and risk of coronary heart disease: a critical review J Am Coll Nutr. 2001 Feb;20(1):5-19. PMID 11293467
- Cheng Z et al. Effect of dietary polyunsaturated fatty acids on uterine prostaglandin synthesis in the cow. J Endocrinol. 2001 Dec;171(3):463-73, PMID 11739012.
- Tabelle der Lebensmittel mit AA.
- Rosenthal et al.: The effects of trans fatty acids on fatty acyl delta 5 desaturation by human skin fibroblasts. Lipids. 1984 Nov;19(11):869-74. PMID 6521610
- margarine-institut.de: Stoffwechsel der ungesättigten Fettsäuren (Memento vom 3. November 2012 im Internet Archive).
- G. Geisslinger et al.: Mutschler Arzneimittelwirkungen: Pharmakologie - Klinische Pharmakologie – Toxikologie, 11. Auflage, 2019. S. 969 f.