Ketosäuren
Ketosäuren, auch Ketocarbonsäuren, sind Carbonsäuren, die eine zusätzliche Ketogruppe enthalten. Sie gehören zu den Oxocarbonsäuren.[2] Ihre Eigenschaften sind durch den Abstand der beiden funktionellen Gruppen geprägt. Den Abstand bezeichnet man oft durch griechische Buchstaben (α-ständig = 1,2-Abstand, β-ständig = 1,3-Abstand etc.).[3]
Biochemie
Ketosäuren spielen im zellulären Geschehen eine zentrale Rolle beim Aminosäurestoffwechsel und bei der Aufrechterhaltung des Redox-Status. α-Ketosäuren enthalten das Kohlenstoffgerüst der analogen α-Aminosäure. β-Ketosäuren sind energiereiche (instabile) Metabolite, die leicht Reaktionen unter CO2-Verlust (Decarboxylierung) eingehen.
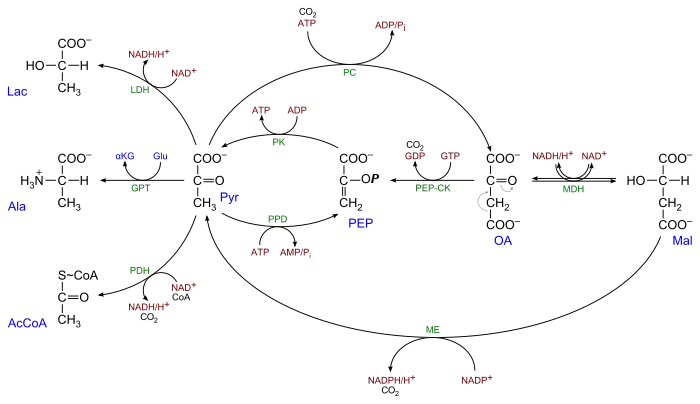
α-Ketosäuren
Brenztraubensäure mit ihren Salzen, den Pyruvaten, ist die einfachste α-Ketosäure. Unter Einwirkung einer Pyruvatdecarboxylase kann Brenztraubensäure während der alkoholischen Gärung zu Acetaldehyd (und CO2) bzw. im Multienzymkomplex der Pyruvat-Dehydrogenase zu Acetyl-CoA (und CO2) decarboxyliert werden. Im Citratzyklus gibt es eine weitere Reaktion nach dem gleichen Grundprinzip: die Decarboxylierung des α-Ketoglutarats zu Succinyl-CoA. Coenzyme dieser als „oxidative Decarboxylierung“ bezeichneten Prozesse sind Thiaminpyrophosphat und NAD+, ggf. Coenzym A. Unter anaeroben Bedingungen wird Pyruvat im Säugetierorganismus zu Lactat reduziert (z. B. im Muskel bei intensiver Beanspruchung).
Auch in vitro kann eine analoge Reaktion beobachtet werden: Die relativ schwache C–C-Bindung in der Gruppierung R–CO–COOH kann durch Zugabe konzentrierter Schwefelsäure gespalten werden und es entstehen Kohlenmonoxid und die entsprechende Carbonsäure R–COOH.
Eine weitere typische Reaktion von α-Ketosäuren ist die Transaminierung, die eine wechselseitige Aminierung unter gleichzeitiger Desaminierung von Glutaminsäure beinhaltet, ohne dass freier Ammoniak auftritt. So wird aus Pyruvat Alanin, aus Oxalacetat (einer Verbindung, die zugleich α- und β-Ketosäure ist) Aspartat und aus α-Ketoglutarat Glutamat, Coenzym ist Pyridoxalphosphat.
β-Ketosäuren
Die einfachste β-Ketosäure ist die unbeständige Acetessigsäure. β-Ketosäuren sind meist unbeständige Stoffe, die unter Decarboxylierung zerfallen. Dieser Prozess kann spontan, biochemisch in der Zelle auch katalysiert, ablaufen. Ein Beispiel ist die Decarboxylierung von Oxalacetat in der Gluconeogenese durch Phosphoenolpyruvat-Carboxykinase (PEP-CK) oder durch das Malatenzym (ME). Acetessigsäure zerfällt in Aceton und Kohlendioxid.
γ-Ketosäuren
Die einfachste γ-Ketosäure ist Lävulinsäure.
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 362–363, ISBN 978-3-906390-29-1.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 362, ISBN 978-3-906390-29-1.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 670.
