Doppelbindung
Eine Doppelbindung ist eine Form der kovalenten Bindung, bei der vier Bindungselektronen beteiligt sind. Die beiden Atome sind somit über zwei bindende Elektronenpaare miteinander verbunden. In Strukturformeln werden Doppelbindungen als zwei parallele Linien (=) zwischen den verbundenen Atomen dargestellt.
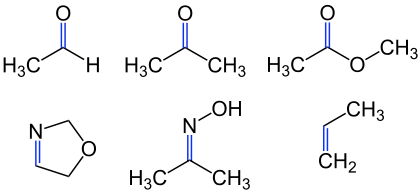
Viele Atome können miteinander Doppelbindungen ausbilden. Die häufigsten funktionellen Gruppen bzw. Stoffklassen mit Doppelbindungen sind die Alkene (C=C), Carbonyle (C=O), Sulfoxide (S=O), Imine (C=N) und die Azogruppe (N=N).
Doppelbindungen sind stärker und kürzer als Einfachbindungen. Die Bindungsordnung beträgt zwei. Doppelbindungen sind elektronenreich, was sie reaktiv macht.
Geschichte
Die Darstellung der Doppelbindung durch zwei Doppelstriche wurde von Joseph Loschmidt eingeführt. Um 1865 führte August Wilhelm von Hofmann die Endungen -an, -en, -in zur Bezeichnung von gesättigten und ungesättigten Alkanen ein.
Detailbeschreibung
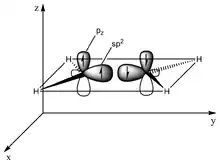
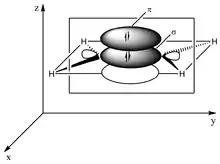
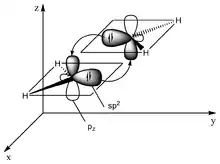
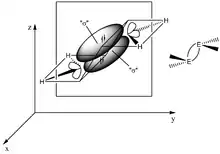
Die Bindungsverhältnisse eines Moleküls der 2. Periode mit Doppelbindung lassen sich mit sp2-Hybrid-Orbitalen beschreiben. Die benachbarten Atome eines solchen Atoms mit sp2-Hybridisierung befinden sich in einer Ebene (das Molekül ist planar). Die Winkel zwischen den gebundenen Atomen liegen meist nahe bei 120° (siehe VSEPR-Modell), der Abstand der bindenden Atome liegt bei etwa 1,34 Å. Das verbleibende Elektron befindet sich in einem Orbital mit reinem p-Charakter senkrecht zur Molekülebene. Jedes der beiden Atome, die durch die Doppelbindung verbunden sind, weisen jeweils ein solches einfach besetztes p-Orbital auf. Durch Kombination dieser beiden entsteht ein bindendes π-Orbital und ein antibindendes π*-Orbital.
Dieser Typ von Doppelbindung ist zwar nicht auf die 2. Periode beschränkt, doch findet man bei Doppelbindungen zwischen Elementen der höheren Perioden andere Bindungsmuster. Ursache hierfür sind einerseits generell geringere homonukleare Bindungsenergien bei größeren Atomen und andererseits eine geringere Hybridisierungstendenz der s- und p-Valenzorbitale. Das Zusammentreffen dieser Phänomene bringt es in bestimmten Fällen mit sich, dass die Energie, die benötigt wird, die dem Doppelbindungssystem zugrunde liegenden Molekülfragmente in einen bindungsfähigen Zustand zu bringen, durch die anschließend freiwerdende Bindungsenergie nicht mehr aufgebracht werden kann. In solchen Fällen erhält man entweder diese Fragmente (d. h. carbenhomologe oder -analoge Moleküle), als isolierbare Verbindungen oder die Dimerisierung erfolgt über eine doppelte Lewis-Säure-Base-Reaktion und ergibt zwei Donator-Akzeptor-Bindungen (eine doppelte dative Bindung). Erkennbar ist eine solche Doppelbindung, die beispielsweise bei den höheren Kohlenstoffhomologen beobachtet wird, an einer charakteristischen Struktur (trans-bent-Abwinkelung der Substituenten) sowie der geringen Energie, die zur Bindungstrennung notwendig ist. Die Dissoziationsenergie kann sogar deutlich kleiner sein als für eine normale kovalente Einfachbindung. Typische Beispiele für derartige Doppelbindungssysteme sind Distannene (R2Sn=SnR2) und Diplumbene (R2Pb=PbR2).
Die Energielücke zwischen dem bindenden π- und dem antibindenden π*-Orbital ist in der Regel kleiner als die Energielücke zwischen einem entsprechenden σ- und einem antibindenden σ*-Orbital. Im Falle konjugierter Doppelbindungen sinkt die Anregungsenergie soweit ab, dass bereits sichtbares Licht ausreichen kann, um ein Elektron in ein leeres Orbital anzuheben. Dabei wird umso weniger Energie (längerwelliges Licht) benötigt, je größer die Anzahl der konjugierten Doppelbindungen ist (siehe hierzu auch: Teilchen im Kasten). Im Falle von Carotin mit elf konjugierten Doppelbindungen wird blaues Licht absorbiert und das Molekül erscheint orange (die Komplementärfarbe Orange entsteht aus der Subtraktion des blauen Anteils vom eingestrahlten weißen Licht).
Bindungslängen und Bindungswinkel
Die Bindungslängen von Doppelbindungen zweier Atome in nichtkonjugierten Systemen sind kürzer als die der entsprechenden Einfachbindungen zwischen den gleichen Atomen.[1]
Bindungslängen und Bindungswinkel ausgewählter Doppelbindungen 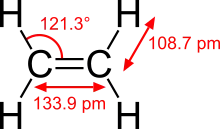
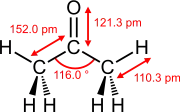
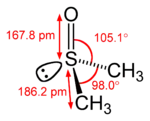
Ethen (Ethylen) Aceton Dimethylsulfoxid
Nomenklatur
Die Rotation um eine Doppelbindung ist ohne weiteres nicht möglich. Besitzen beide Bindungspartner zwei unterschiedliche Substituenten, wird daher bezüglich ihrer Stellung zueinander zwischen cis- und trans-Isomeren unterschieden.
Mehrere Doppelbindungen, die durch genau eine Einfachbindung getrennt sind, werden als konjugiert, direkt aneinandergrenzende als kumuliert und bei mehr als einer Einfachbindung bis zur nächsten Doppelbindung als isoliert bezeichnet.
Typische chemische Reaktionen von Molekülen mit einer Doppelbindung
- C=C-Doppelbindung (Alkene):
- elektrophile Addition an die Doppelbindung
- ein weiteres (elektrophiles) Molekül lagert sich entweder nach Angriff von E+ (E+ = Elektrophil) und ionischer Zwischenstufe unter Bruch der Doppelbindung an das Molekül an oder bei Elektrophilen mit größeren Atomen (z. B. Brom) unter Bildung einer ringförmigen, ionischen Zwischenstufe („-onium-Ion“, hier also Bromonium-Ion) mit anschließendem Rückseitenangriff des Restes (im Beispiel Br−).
- radikalische Addition an die Doppelbindung
- ein Molekül, dessen Bindung leicht homolytisch (in zwei Radikale) spaltbar ist, (z. B. Chlor) wird unter Licht (UV) in zwei Radikale gespalten, die dann die Doppelbindung angreifen.
- elektrophile Addition an die Doppelbindung
- C=O-Doppelbindung (Carbonyl, Keton, Aldehyd, Carbonsäure, Carbonsäureester):
- Reduktion der C=O-Bindung zu Alkoholen mit reduzierenden Reagenzien wie Wasserstoff oder Grignard-Reaktionen.
- Oxidation der C=O-Bindung (nur Aldehyd) zu einer Carbonsäure.
- Passerini-Reaktion.
- C=N-Doppelbindung
- Addition von Blausäure unter Bildung von α-Aminonitrilen.
- Ugi-Reaktion
- pericyclische Reaktionen
weitere Reaktionen siehe auch Namensreaktionen, Kumulierte Doppelbindung.
Nachweis von C=C-Doppelbindungen
Ein recht unspezifischer Nachweis von organischen Verbindungen mit C=C-Doppelbindungen, d. h. von Alkenen, ist über Bromwasser möglich. Bei Anwesenheit eines Alkens wird das durch Br2 gelbgefärbte Bromwasser nach Schütteln mit der Stoffprobe entfärbt. Über eine Additionsreaktion entsteht aus dem Alken ein Bromalkan. Zu Details siehe Alkennachweis.
Siehe auch
Einzelnachweise
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 54, ISBN 3-342-00280-8.