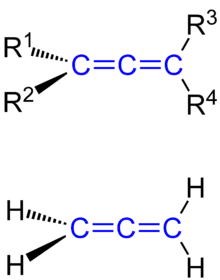
Allene
Als Allene (Betonung auf der zweiten Silbe: Allene) bezeichnet man eine Stoffgruppe in der organischen Chemie, deren Mitglieder sich durch die Abfolge ihrer Kohlenstoff-Kohlenstoff-Verknüpfung auszeichnet: sie haben zwei direkt benachbarte, also kumulierte Doppelbindungen.[1] Somit enthalten sie das Strukturelement C=C=C.
Der einfachste Vertreter der Allene ist das Propadien.
Ob die Allene zu der Stoffgruppe der Kumulene hinzuzurechnen sind, wird in der Fachliteratur kontrovers diskutiert. Der Römpp[2] bejaht dies, das Gold Book[3] dagegen definiert die Kumulene als Verbindungen mit einer Abfolge von mindestens drei kumulierten Doppelbindungen und schließt damit die Allene von den Kumulenen aus.
Relative Stabilität
Ein Vergleich der relativen Stabilität zeigt, dass konjugierte Diene stabiler als isolierte Diene und jene stabiler als Allene sind.[4]
Symmetrie und Stereochemie
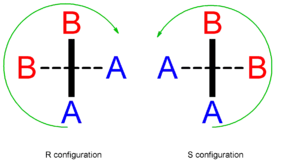
Die C=C=C-Gruppe ist linear aufgebaut, das mittlere Kohlenstoffatom ist sp-hybridisiert. Die randständigen C-Atome sind sp2-hybridisiert. Die Substituenten von Allenen bzw. Kumulenen mit einer geraden Anzahl an kumulierten Doppelbindungen liegen nicht in einer Ebene, sondern sind um 90° zueinander gedreht. Daraus folgt, dass die Moleküle eine axiale Chiralität aufweisen können, unter den Bedingungen R1≠R2 und R3≠R4.[5] Einzelne Isomere können durch stereoselektive Synthesestrategien gezielt synthetisiert oder aus dem Gemisch durch geeignete Methoden isoliert werden. Die Bestimmung der absoluten Konfiguration eines Isomers erfolgt nach dem Cahn-Ingold-Prelog-System. Zur Kennzeichnung werden entweder die stereochemischen Deskriptoren Ra und Sa oder die Plus (P)- / Minus (M)-Notation verwendet.[6]
Vorkommen
Substanzen mit Allen-Struktur kommen als Naturstoffe vor, so z. B. im Peridinin, einem in Dinoflagellaten vorkommenden Carotinoid. Das Pheromon des männlichen Speisebohnenkäfers (Acanthoscelides obtectus) hat ebenfalls eine Allen-Einheit.[7] Auch cyclische Allene sind aus der Natur bekannt.[8]
Synthese
Im Labor können Allene auf unterschiedlichen Wegen dargestellt werden.
- Eine Möglichkeit hierzu ist die konjugierte 1,6-Addition an Enine.[9]
- Auch die Reduktion von Propargylhalogeniden oder -acetalen führt zu Allenen.[10]
- Crabbé-Allensynthese von endständige Alkinen mit Formaldehyd und Kupfer(I)-bromid unter Basenzusatz.[11]
- Aus geminalen Dihalocyclopropanen kann mittels Organolithiumbasen ein Carben erhalten werden, das nach einer Skattebøl-Umlagerung zu Allenen führt.[12]
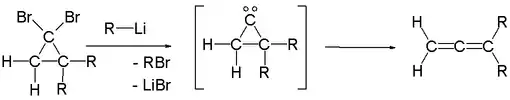
- Als Wittig-Reaktion von Triphenylphosphit mit einem Säurehalogenid, mit anschließender Dehydrohalogenierung.[13]
- Die Dehalogenierung von 2,3-Dihalogenpropenen mit Zink liefert ebenfalls Allene.[14]
- Die Dehydrohalogeniering von trisubstituierten Vinylhalogenide führt zu Allenen.
Literatur
- Norbert Krause, A. Stephen Hashmi: Modern allene chemistry. Wiley-VCH Weinheim 2004, ISBN 3-527-30671-4 (Auszug in der Google-Buchsuche)
- Alan R. Katritzky, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive organic functional group transformations. Elsevier Science 1995, ISBN 0-08-040604-1, S. 953–996 (eingeschränkte Vorschau in der Google-Buchsuche)
- Kay M. Brummond (Hrsg.) Allene chemistry Thematische Serie im Open Access Beilstein Journal of Organic Chemistry
Einzelnachweise
- Eintrag zu Allenes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00238 – Version: 2.1.5.
- Eintrag zu Kumulene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Juni 2014.
- Eintrag zu Cumulenes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C01440 – Version: 2.1.5.
- Paula Yurkanis Bruice: Organic Chemistry, Pearson Education Inc., 2004, 4. Auflage, S. 302, ISBN 0-13-121730-5.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 28, ISBN 3-211-81060-9.
- Eintrag zu Axiale Chiralität. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00547 – Version: 2.1.5.
- Horler, D.F.: (–)-Methyl n-tetradeca-trans-2,4,5-trienoate, an allenic ester produced by the male dried bean beetle, Acanthoscelides obtectus (Say). J. Chem. Soc. 1970, S. 859–862 doi:10.1039/J39700000859.
- Ferdinand Bohlmann, Jasmin Jakupovic, Rajinder K. Gupta, Robert M. King, Harold Robinson: Allenic germacranolides, bourbonene derived lactones and other constituents from Vernonia species. In: Phytochemistry, Volume 20, Issue 3, 13 March 1981, S. 473–480 doi:10.1016/S0031-9422(00)84169-2.
- N. Krause, A. Gerold: Regio- und stereoselektive Synthesen mit Organokupferreagentien. In: Angewandte Chemie 1997, Vol. 109 (3), S. 194–213. doi:10.1002/ange.19971090304.
- L. Brandsma, H. D. Verkruijsse: Synthesis of acetylenes, allenes and cumulenes: methods and techniques. Elsevier Oxford 2004, ISBN 0-12-125751-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pierre Crabbé, Bahman Nassim, Maria-Teresa Robert-Lopes: One-Step Homologation of Acatylenes to Allenes: 4-Hydroxynona-1,2-diene In: Organic Syntheses. 63, 1985, S. 203, doi:10.15227/orgsyn.063.0203; Coll. Vol. 7, 1990, S. 276 (PDF).
- Lars Skattebøl: Chemistry of gem-Dihalocyclopropanes. V.1 Formation of Tricyclo[4.1.0.04,6]heptane and Derivatives. in: J. Org. Chem. 1966, 31(9), S. 2789–2794 doi:10.1021/jo01347a014.
- Robert W. Lang, Hans-Jürgen Hansen: Eine einfache Allencarbonsäureester-Synthese mittels der Wittig-Reaktion. In: Helv. Chim. Acta. 63, Nr. 2, 1980, S. 438–455. doi:10.1002/hlca.19800630215.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 245, ISBN 3-342-00280-8.