α-Linolensäure
α-Linolensäure (alpha-Linolensäure oder kurz ALA nach der englischen Bezeichnung alpha-Linolenic acid genannt) ist eine dreifach ungesättigte Fettsäure mit 18 Kohlenstoffatomen und gehört zur Gruppe der Omega-3-Fettsäuren. Daraus ergibt sich ihr Lipidname 18:3 (ω−3). Sie wird auch mit (all-cis)-Octadeca-9,12,15-triensäure bezeichnet – ist also eine Alkensäuren, genauer Triensäure und eine Isolensäure, weil die drei Doppelbindungen jeweils durch eine Methylengruppe getrennt sind.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
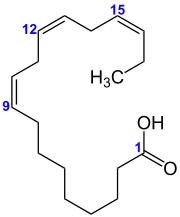 | ||||||||||||||||||||||
| Strukturformel mit der Nummerierung ausgewählter Kohlenstoffatome | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | α-Linolensäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C18H30O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 278,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,92 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,480 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Alpha-Linolensäure wird manchmal auch nur kurz Linolensäure genannt,[2] obwohl noch mehrere andere Fettsäuren das Wort Linolensäure in ihrem Namen tragen: Die gamma-Linolensäure [GLA, (all-cis)-Octadeca-6,9,12-triensäure] Kurzb.: [18:3 (ω−6)] und die Dihomo-gamma-Linolensäure [DGLA, (all-cis)-Eicosa-8,11,14-triensäure] Kurzb.: [20:3 (ω−6)] gehören beide zur Gruppe der Omega-6-Fettsäuren, wobei letztere außerdem aus 20 statt nur aus 18 Kohlenstoffatomen besteht. Auch die der Linolensäure namentlich ähnliche Linolsäure (Octadeca-9,12-diensäure) gehört zu den Omega-6-Fettsäuren. Sie besitzt eine Doppelbindung weniger als die Linolensäure.
Der Name Linolensäure leitet sich vom griechischen Wort linos für Lein (Flachs) ab.
Vorkommen
Linolensäure findet sich als Ester chemisch gebunden in vielen Triglyceriden, welche den Hauptanteil der natürlichen Fette und Öle ausmachen. Die Triglyceride einer ganzen Reihe natürlich gewonnener pflanzlicher Öle sind reich an Linolensäure-Resten. Hierzu gehören unter anderem Leinöl (56–71 %),[5] Chiaöl (ca. 60 %),[6] Perillaöl (31–42 %),[7], das Öl aus dem Iberischen Drachenkopf (bis zu 70 % der Fettsäure-Reste),[8] Hanföl (28 %),[2] Walnussöl (ca. 15 %), Rapsöl (5–16 %)[2] und Sojaöl (4–11 %).[2] Manche pflanzlichen Öle enthalten nur geringe Mengen (bis 1,5 %); dazu zählen Sonnenblumenöl, Olivenöl[2] und Traubenkernöl (weniger als 1 % Linolensäure, 72 % Linolsäure).[9] Tierische Quellen sind Pferdefett (ca. 30 %) und Schweineschmalz (< 1,5 %).[2]
Entgegen weitverbreiteter Anschauung enthalten diese natürlichen Fette und Öle keine freie Linolensäure, sondern deren Glycerinester.
Gewinnung und Darstellung
Die Fettsäure lässt sich durch alkalische Verseifung aus den entsprechenden Triglyceriden gewinnen, indem die entsprechenden Fette oder Öle mit Alkalien gekocht werden. Da die natürlichen Fette und Öle stets viele unterschiedliche Fettsäuren enthalten, schließt sich in der Regel eine Trennung des entstandenen Gemisches an. Kommerziell wird sie vor allem aus Leinöl gewonnen.[10]
Eigenschaften
Physikalische Eigenschaften
Sorgfältig gereinigte und unter Luftausschluss aufbewahrte Linolensäure ist eine farblose, ölige und fast geruchlose Flüssigkeit. Die molare Masse beträgt 278,43 g·mol−1 und die Dichte 0,91 g·cm−3[2] Sie hat einen Schmelzpunkt von −11 °C[3] und einen Siedepunkt von 232 °C (bei 23 mbar).[3] Die Fettsäure ist unlöslich in Wasser, jedoch gut in vielen organischen Lösungsmitteln.
Chemische Eigenschaften
Linolensäure ist sehr oxidationsempfindlich und altert an der Luft rasch unter Gelbfärbung, die auf die Bildung von Hydroperoxiden zurückzuführen ist. Im weiteren Verlauf der Oxidation kommt es zur Verharzung unter Bildung von Firnis, dieser Vorgang wird auch als Trocknung bezeichnet.
Biologische Bedeutung
α-Linolensäure (ALA) ist ein essentieller Nährstoff, der zur Bildung der Omega-3-Fettsäuren Docosahexaensäure (DHA) und Eicosapentaensäure (EPA) benötigt wird. Auch spielt ALA eine wichtige Rolle bei Entzündungsprozessen. Sie wird von den gleichen Enzymen zu EPA verarbeitet, die auch aus Linolsäure Dihomogammalinolensäure (DGLA) und Arachidonsäure (AA) produzieren. Aus DGLA und EPA werden wiederum entzündungshemmende Eicosanoide gebildet (Serie 1 und Serie 3), während aus der Arachidonsäure entzündungsfördernde Serie-2-Eikosanoide gebildet werden. ALA wirkt also entzündungshemmend, da sie
- 1. Enzymaktivität auf sich zieht, die sonst Arachidonsäure produzieren würde und
- 2. aus ihr die entzündungshemmenden Serie-3-Eikosanoide gebildet werden.
Studien zeigen, dass etwa 5–10 % der aufgenommenen α-Linolensäure in EPA und 2–5 % in DHA umgewandelt werden. Andere Studien sprechen von Umwandlungsraten in EPA und DHA geringer als 5 %. Eine Studie kommt zu dem Schluss, dass die Umwandlungsrate ALA zu DHA unter 1 % liegt.[12][13][14] Eine Studie des Royal Adelaide Hospital in Australien zeigt, dass α-Linolensäurereiches Pflanzenöl, zusammen mit einer linolsäurearmen Ernährung, den EPA-Spiegel im Gewebe ähnlich steigen lässt wie eine Supplementierung mit Fischöl.[15] Eine Steigerung des DHA-Spiegels im Blut durch Supplementierung von zusätzlicher ALA wird – außer bei Säuglingen – durch die International Society for the Study of Fatty Acids and Lipids (ISSFAL) verneint.[12] Barcel-Coblijn & Murphy hingegen kommen zu dem Schluss, dass der Körper ausreichend DHA bilden kann, wenn genug α-Linolensäure (>1200 mg) pro Tag aufgenommen wird.[16] Ein Review von 2016, welches die Umwandlungsraten von ALA in DHA untersuchte, kommt zu dem Schluss, dass ALA ein ungeeignetes Substitut für DHA ist.[17]
Nachweis
Zur Gehaltsbestimmung der Linolensäure-Anteile in den Triglyceriden werden diese zuerst zu dem Methylestern der Fettsäuren umgeestert. Es folgt in der Regel eine gaschromatographische Trennung der Fettsäuremethylester.
Ergänzend kann eine Trennung der ungesättigten Isomere mit Silbernitrat-Dünnschichtchromatographie erfolgen.[18]
Verwendung
Acylglycerine der Linolensäure und der Linolsäure werden als Zusatz zu Firnis und anderen trocknenden Ölen für Beschichtungen (Lacke u. a.) verwendet.
Einzelnachweise
- Eintrag zu LINOLENIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- Eintrag zu Linolensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- Eintrag zu α-Linolensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. Januar 2008. (JavaScript erforderlich)
- Datenblatt Linolenic acid bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- Deutsche Gesellschaft für Fettwissenschaft: Fettsäurezusammensetzung wichtiger pflanzlicher und tierischer Speisefette und -öle (Memento vom 22. Dezember 2008 im Internet Archive) (PDF).
- Peter N. Mascia(Hrsg.), Jürgen Scheffran(Hrsg.), Jack M. Widholm(Hrsg.): Plant Biotechnology for Sustainable Production of Energy and Co-Products. Band 66 der Reihe Biotechnology in Agriculture and Forestry, Springer, 2010, ISBN 978-3-642-13439-5, S. 235.
- Eintrag zu Perillaöl. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Mai 2011.
- Artporträt „Iberischer Drachenkopf“ (Memento vom 18. Dezember 2015 im Internet Archive) im Informationssystem Nachwachsende Rohstoffe (INARO).
- Robert Ebermann, Ibrahim Elmadfa: Lehrbuch Lebensmittelchemie und Ernährung. Springer-Verlag/Wien, 2008, ISBN 978-3-211-49348-9, S. 648 (eingeschränkte Vorschau in der Google-Buchsuche).
- Stichwort „α-Linolenic Acid“ In: Hans Zoebelein (Hrsg.): Dictionary of Renewable Ressources. 2. Auflage, Wiley-VCH, Weinheim und New York 1996, ISBN 3-527-30114-3, S. 92.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 653–654.
- J. T. Brenna, N. Salem, A. J. Sinclair, S. C. Cunnane: alpha-Linolenic acid supplementation and conversion to n-3 long-chain polyunsaturated fatty acids in humans. In: Prostaglandins, leukotrienes, and essential fatty acids. Band 80, Nummer 2–3, 2009, S. 85–91, doi:10.1016/j.plefa.2009.01.004, PMID 19269799 (Review).
- Breanne M Anderson, David WL Ma: Are all n-3 polyunsaturated fatty acids created equal?. In: Lipids in Health and Disease. 8, 2009, S. 33, doi:10.1186/1476-511X-8-33.
- J. T. Brenna: Efficiency of conversion of alpha-linolenic acid to long chain n-3 fatty acids in man. In: Current opinion in clinical nutrition and metabolic care. Band 5, Nummer 2, 2002, S. 127–132, PMID 11844977.
- E. Mantzioris, M. J. James, R. A. Gibson, L. G. Cleland: Dietary substitution with an alpha-linolenic acid-rich vegetable oil increases eicosapentaenoic acid concentrations in tissues. In: The American journal of clinical nutrition. Band 59, Nummer 6, 1994, S. 1304–1309, PMID 7910999.
- Gwendolyn Barcel-Coblijn, Eric J. Murphy: Alpha-linolenic acid and its conversion to longer chain n–3 fatty acids: Benefits for human health and a role in maintaining tissue n–3 fatty acid levels. In: Progress in Lipid Research. 48, 2009, S. 355–374, doi:10.1016/j.plipres.2009.07.002.
- E. J. Baker, E. A. Miles, G. C. Burdge, P. Yaqoob, P. C. Calder: Metabolism and functional effects of plant-derived omega-3 fatty acids in humans. In: Progress in lipid research. Band 64, 2016, S. 30–56, doi:10.1016/j.plipres.2016.07.002, PMID 27496755 (Review).
- B. Breuer, T. Stuhlfauth, H. P. Fock: Separation of fatty acids or methyl esters including positional and geometric isomers by alumina thin-layer chromatography. In: J. of Chromatogr. Science. 25 (1987), S. 302–306; doi:10.1093/chromsci/25.7.302.