cis-trans-Isomerie
Die cis-trans-Isomerie oder (Z)-(E)-Isomerie bezeichnet in der Chemie eine spezielle Form der Konfigurationsisomerie, bei der sich die Moleküle nur dadurch unterscheiden, ob zwei Substituenten sich auf der gleichen Seite einer Referenzebene befinden oder nicht. Eine Referenzebene kann beispielsweise durch eine Doppelbindung oder ein Ringsystem definiert sein. cis- und trans-Isomere unterscheiden sich in den chemischen und physikalischen Eigenschaften wie zum Beispiel Schmelztemperatur, Siedetemperatur, Bindungsenthalpie. Im Unterschied zu Konformeren können sie nur durch Bindungsbruch ineinander überführt werden.
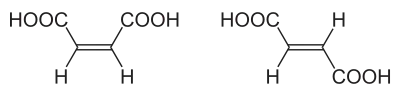
Grundbegriffe
Allgemein gilt:
- Zwei Substituenten sind cis-konfiguriert, wenn sie sich auf der gleichen Seite der Referenzebene befinden.
- Zwei Substituenten sind trans-konfiguriert, wenn sie sich auf der entgegengesetzten Seite der Referenzebene befinden.
Die traditionelle cis-trans-Notation kann mehrdeutig sein, wenn es mehr als zwei Substituenten gibt. In dem Fall muss entweder ein Referenzsubstituent angegeben oder die von der IUPAC definierte (Z)-(E)-Notation angewandt werden, um Eindeutigkeit sicherzustellen. Betrachtet werden dann diejenigen vicinalen Substituenten, die nach der Cahn-Ingold-Prelog-Konvention die jeweils höhere Priorität besitzen. In dem Fall erhält man eine eindeutige Benennung wie folgt:[1]
- Von einer (Z)-Anordnung spricht man, wenn sich die beiden prioritären Substituenten auf der gleichen Seite der Referenzebene (zusammen) befinden.
- Von einer (E)-Anordnung spricht man, wenn sich die beiden prioritären Substituenten auf der entgegengesetzten Seite der Referenzebene (entgegen) befinden.
cis- und trans- bzw. (Z)- und (E)- selbst werden als Deskriptoren bezeichnet und dem systematischen Substanznamen vorangestellt.
cis-trans-Isomerie bei Doppelbindungen

cis-trans-Isomerie tritt auf, wenn beide Atome einer Doppelbindung unterschiedliche Substituenten tragen. Die Referenzebene ist in diesem Fall diejenige Ebene, die die Achse der Doppelbindung enthält und zugleich senkrecht auf jener Ebene steht, in der die σ-Bindungen zu den Substituenten liegen.[1]
Ein Beispiel für cis-trans-Isomerie ist das Isomerenpaar cis-Butendisäure (Maleinsäure) und trans-Butendisäure (Fumarsäure). Die beiden Carboxylgruppen befinden sich im cis-Isomer zusammen auf der gleichen Seite der Ebene, die senkrecht zur Molekülebene steht und die Doppelbindungsachse enthält, im trans-Isomer befinden sie sich auf der entgegengesetzten Seite. In diesem Fall ist das cis-konfigurierte zugleich das (Z)-Isomer und das trans-konfigurierte zugleich das (E)-Isomer (siehe Bild oben).
Sind an den beiden Kohlenstoffatomen einer Doppelbindung jeweils ein Wasserstoffatom und ein größerer Substituent gebunden (vicinale Doppelbindungen), ist die Zuordnung von cis und trans eindeutig und diese traditionellen Nomenklaturbezeichnungen können verwendet werden. Sind dagegen mehr Substituenten vorhanden, muss die (E/Z)-Nomenklatur verwendet werden, für die über die Sequenzregel eine eindeutige Prioritäten-Reihenfolge festgelegt wurde.[2]
Nicht immer lässt sich die traditionelle Bezeichnung einfach durch Gleichsetzung von cis mit (Z) und trans mit (E) in (E/Z)-Nomenklatur überführen. Ein Gegenbeispiel liefert Furylfuramid. Traditionell werden die Isomere durch die Stellung der namensgebenden Furyl-Substituenten unterschieden.[3][4] Da aber gemäß CIP-Konvention das C-Atom der Carbonsäureamidgruppe aufgrund seiner Bindungspartner in zweiter Sphäre (O, N) höhere Priorität hat als das C-Atom im Furanring (zweite Sphäre: C, O), ist in diesem Fall das (Z)-Isomer dasjenige, in dem die Furyl-Substituenten trans zueinander stehen.
Bei zwei konjugierten Doppelbindungen (z. B. bei 1,3-Butadien) ist eine s-cis- und eine s-trans- Konformation möglich. Die Doppelbindungen können um die zwischen ihnen befindliche Einfachbindung rotiert werden und entweder auf der gleichen Seite (s-cis-Konformation) oder gegenüber voneinander (s-trans) stehen. Das vorgestellte „s“ steht hierbei für die sigma-Bindung zwischen den beiden Doppelbindungen und zeigt an, dass es sich hier nicht um zwei unterschiedliche Isomere, sondern lediglich um Konformationen derselben Verbindung handelt. In einigen Fällen ist in einer Verbindung aufgrund dessen Struktur nur eine Konformation möglich. Beispiele hierfür sind Cyclopentadien oder Cyclohexa-1,3-dien. Sie können ausschließlich in der s-cis-Konformation vorliegen, da durch die cyclische Struktur keine freie Rotation um die Einfachbindung stattfinden kann. Im Gegensatz dazu kann in 1,2,3,5,6,7-Hexahydronaphthalin aufgrund der Ringstruktur nur die s-trans-Konformation vorliegen.[5]
cis-trans-Isomerie bei Ringsystemen
cis-trans-Isomerie gibt es auch bei cyclischen Verbindungen, etwa bei Monocyclen, die an verschiedenen Kohlenstoffatomen Substituenten tragen, oder bei Bicyclen. Zur Benennung von Ringsystemen nach IUPAC-Regeln werden die Vorsilben „cis-“ und „trans-“ dem Verbindungsnamen kursiv vorangestellt und zur alphabetischen Einordnung nur bei Namensgleichheit herangezogen.
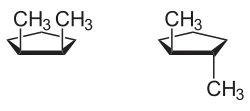
Ein Beispiel für eine monocyclische Verbindung mit cis-trans-Isomerie ist 1,2-Dimethylcyclopentan: Die beiden Methyl-Substituenten können sich entweder auf der gleichen Seite der Molekülebene befinden (cis-Form) oder auf einander entgegengesetzten Seiten (trans-Form).
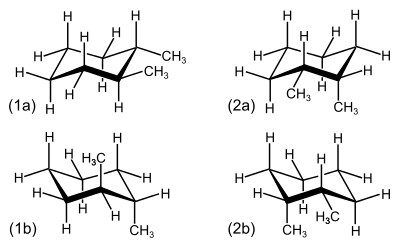
Bei 6-Ringen wie bei 1,2-Dimethylcyclohexan lassen sich die cis- und trans-Isomere schwer erkennen, da die Verbindungen nicht als planare Ringe betrachtet werden sollten. Verbindungen dieser Art liegen meist in der energetisch bevorzugten Sesselkonformation vor. Da je zwei Sesselkonformationen durch Ringinversion vorliegen, lassen sich beispielsweise trans-1,2-Dimethylcyclohexan und cis-1,2-Dimethylcyclohexan nicht unmittelbar erkennen. Bei trans-1,2-Dimethylcyclohexan liegen beide Methylgruppen entweder äquatorial oder axial vor. In den cis-Formen liegen je eine Methylgruppe äquatorial, die andere axial vor.
 |
 |
| (1a) und (1b) Sessel-Konformationen von trans-1,2-Dimethylcyclohexan; (2a) und (2b) Sessel-Konformationen von cis-1,2-Dimethylcyclohexan. | Stellungen bei der Sesselkonformation von Cyclohexan. Die Wasserstoffatome in axialer Stellung sind rot markiert und zueinander trans-positioniert. Die Wasserstoffatome in äquatorialer Stellung sind blau markiert und stehen zueinander ebenfalls in trans-Position, was aber schwerer zu erkennen ist. |
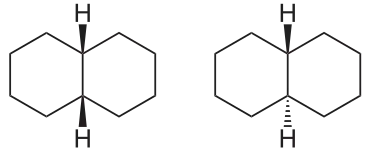
Ein Beispiel für eine bicyclische Verbindung ist Decalin, da die beiden Sechserringe unterschiedlich verknüpft sein können: Die beiden Wasserstoffatome an den Verknüpfungsstellen können sich entweder auf der gleichen Seite des Decalinmoleküls befinden (cis-Form) oder auf einander entgegengesetzten Seiten (trans-Form).
Gegenseitige Umwandlung
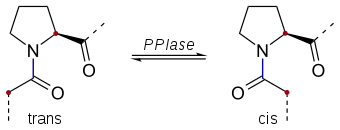 |
| Durch eine Peptidyl-Prolyl-cis-trans-Isomerase (PPIase) katalysiertes Gleichgewicht: Ohne enzymatische Katalyse findet die Rotation um die blau markierte Bindungsachse der Peptidbindung zwischen dem N-Terminus von L-Prolin und dem C-Terminus einer anderen Aminosäure nur langsam statt. |
Bei einer Doppelbindung lassen sich die cis- und trans-Isomere ineinander umwandeln (cis-trans-Interkonversion). Hierzu ist eine vorübergehende Auflösung der π-Bindung nötig, was meist photochemisch oder bei höheren Temperaturen erfolgt. Der Prozess der photochemischen Interkonversion erfolgt hierbei anhand elektronischer Anregung in den Singulett Spinzustand. Die nicht verdrillte Molekülstruktur ist hierbei sowohl sterisch, als auch energetisch benachteiligt. Es folgt eine Spinumkehr des aus dem HOMO angeregten Elektrons (nun SOMO; single occupied molecular orbital) in den Triplett-Zustand, welcher im Gleichgewicht zur cis-trans-Rekombination steht. Bei Erhöhung der Reaktionstemperatur wird hier das thermodynamische Transprodukt erhalten.[6][7][8]
cis-trans-Umwandlungen sind z. B. ein zentraler Bestandteil des Sehvorganges (siehe Retinal).
Die zwischen dem N-Terminus von L-Prolin und dem C-Terminus einer anderen Aminosäure in Peptiden vorliegende Amidbindung (Peptidbindung) kann sowohl in der trans- als auch in der cis-Konfiguration vorliegen, da diese Bindung einen gewissen Doppelbindungscharakter aufweist. Ein Wechsel zwischen beiden Konfigurationen findet nur langsam statt, kann jedoch enzymatisch durch eine Peptidyl-Prolyl-cis-trans-Isomerase katalysiert werden.
Siehe auch
Literatur
- Eintrag zu cis-trans-Isomerie. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Jerry March: Advanced Organic Chemistry. Reactions, Mechanisms, and Structure. 3. Auflage, John Wiley & Sons, New York 1985.
Einzelnachweise
- G. P. Moss: Basic terminology of stereochemistry (IUPAC Recommendations 1996). In: Pure and Applied Chemistry, 1996, Band 68, Nr. 12, S. 2203–2204. doi:10.1351/pac199668122193.
- D. Hellwinkel: Die systematische Nomenklatur der organischen Chemie. 5. Auflage, Springer, 2005, ISBN 3-540-26411-6, S. 188.
- M. Tomoeda, R. Kitamura: A cis-trans isomerising activity of Escherichia coli. Isomerization from 2-(2-Furyl)-3-cis-(5-nitro-2-furyl) acrylamide (furylfuramide) to its trans isomer. In: Biochimica et Biophysica Acta (BBA) - Enzymology, 1977, Band 480, Nr. 1, S. 315–325. doi:10.1016/0005-2744(77)90344-8.
- B. Kalyanaraman, Ronald P. Mason, Roger Rowlettb L. D. Kispert: An electron spin resonance investigation and molecular orbital calculation of the anion radical intermediate in the enzymatic cis-trans isomerization of furylfuramide, a nitrofuran derivative of ethylene. In: Biochimica et Biophysica Acta (BBA) - Enzymology, 1981, Band 660, Nr. 1, S. 102–109. doi:10.1016/0005-2744(81)90114-5.
- James Ashenhurst: s-cis and s-trans Conformations of Dienes. In: Master Organic Chemistry. 12. Mai 2017 (masterorganicchemistry.com [abgerufen am 3. September 2021]).
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 978-3-906390-29-1, S. 102.
- Paula Yurkanis Bruice, Oliver Reiser: Organische Chemie Pearson Studium, München 2007, ISBN 978-3-8273-7190-4, S. 159.
- Michael W. Tausch: Photochemische cis-trans Isomerisierungen; Der mathematische und naturwissenschaftliche Unterricht (MNU), 1987, 40/2, S. 92–103.