Alicyclobacillus
Alicyclobacillus ist eine Gattung grampositiver, endosporenbildender Bodenbakterien. Mehrere Arten enthalten in den Lipiden der Biomembran ungewöhnliche Fettsäuren, die als Omega-alicyclisch bezeichnet werden. Der Gattungsname verweist auf diese Fettsäuren. Alicyclobacillus-Arten sind thermophil und sie wachsen auch bei niedrigen pH-Werten. Sie sind am bakteriellen Verderb von Fruchtsäften beteiligt und stellen somit ein mögliches Problem bei deren Herstellung dar.
| Alicyclobacillus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Alicyclobacillus | ||||||||||||
| Wisotzkey 1992 emend. Karavaiko et al. 2005 |
Merkmale
Erscheinungsbild
Alicyclobacillus ist eine Gattung grampositiver Bakterien, in älteren Kulturen sind sie gramvariabel. Die Zellen haben die Form von Stäbchen mit einem Durchmesser von 0,3 bis 0,8 µm und einer Länge von 2,0 bis 4,5 µm.[1] Sie können sich aktiv bewegen, sie sind motil.[2] Unter ungünstigen Umweltbedingungen bilden sie Endosporen als Überdauerungsformen aus. Die Bildung der Endosporen erfolgt unabhängig davon, ob genügend Sauerstoff vorhanden ist.[1] Die Endosporen mancher Alicyclobacillus-Arten sind sehr hitzeresistent und überleben eine kurzzeitige Erhitzung auf 92 °C.[3] Das ist problematisch für die Fruchtsaftindustrie.
Wachstum und Stoffwechsel
Alicyclobacillus wächst strikt aerob, kann sich also nur vermehren, wenn Sauerstoff vorhanden ist. Alicyclobacillus-Arten sind thermophil („wärmeliebend“) und acidophil („säureliebend“). Sie wachsen bei Temperaturen zwischen 20 und 70 °C, wobei die optimale Wachstumstemperatur zwischen 35 und 60 °C liegt.[4] Das pH-Optimum liegt zwischen 2,0 und 6,0.[5]
Chemotaxonomische Merkmale
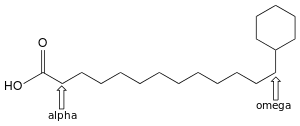
Obwohl für die Firmicutes eigentlich ein niedriger GC-Gehalt in der Bakterien-DNA typisch ist, liegt dieser bei Alicyclobacillus-Arten eher hoch, zwischen 48,7 und 62,7 Mol-Prozent.[4] Das Hauptchinon ist Menachinon vom Typ MK-7.[1] Die Lipide in der Biomembran weisen ungewöhnliche Fettsäuren auf, die als Omega-alicyclisch (ω-alicyclisch) bezeichnet werden[2] und im Gattungsnamen berücksichtigt wurden.[6] Der griechische Buchstabe Omega bezieht sich auf die letzte Position in der Kohlenstoffkette. Die Verwendung von griechischen Kleinbuchstaben als Lokant ist bei Fettsäuren üblich. Alicyclische Verbindungen sind ringförmige Kohlenwasserstoffe. Die Ringe in der Struktur dieser Fettsäuren bestehen meist aus sechs oder sieben Kohlenstoffatomen,[1] derartige Ringsysteme werden als Cyclohexan bzw. Cycloheptan bezeichnet.
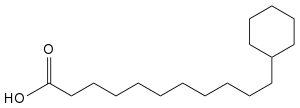
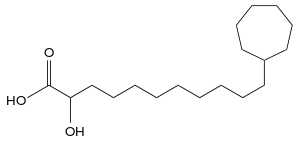
Auf diese Besonderheit ist im Artnamen Alicyclobacillus cycloheptanicus verwiesen worden.[6] Bei dieser Art finden sich in der Zellmembran überwiegend Fettsäuren mit einem endständigen Cycloheptan: Omega-Cycloheptylundecansäure (ω-Cycloheptan C18:0), Omega-Cycloheptyltridecansäure (ω-Cycloheptan C20:0) und Omega-Cycloheptyl-alpha-hydroxyundecansäure (ω-Cycloheptan C18:0 2-OH).[1] Bei A. acidocaldarius und A. acidiphilus überwiegen die Omega-alicyclischen Fettsäuren mit einem Ring aus sechs Kohlenstoffatomen: Omega-Cyclohexylundecansäure (ω-Cyclohexan C17:0) und Omega-Cyclohexyltridecansäure (ω-Cyclohexan C19:0).[1][7]
Mit der Entdeckung der Art A. pomorum wurde die Beschreibung typischer Fettsäuren 2003 erweitert: Neben den Omega-alicyclischen Fettsäuren kommen auch geradkettige und verzweigtkettige, gesättigte Fettsäuren vor. Typische Vertreter für die letzteren sind Fettsäuren mit den Abkürzungen iso-C15:0 (iso-Pentadecansäure), anteiso-C15:0 (anteiso-Pentadecansäure), iso-C16:0 (iso-Hexadecansäure), iso-C17:0 (iso-Heptadecansäure) und anteiso-C17:0 (anteiso-Heptadecansäure).[2] Die Fettsäuren mit insgesamt 15 bzw. 17 C-Atomen gehören außerdem noch zu den ungeradzahligen Fettsäuren.
Vorkommen
Das Habitat mehrerer Alicyclobacillus-Arten ist an extremen Standorten zu finden. Der erste Alicyclobacillus-Stamm wurde 1967 aus Heißwasserquellen in Japan isoliert.[8] In den folgenden Jahren wurden sowohl das Gewässer wie auch der Boden an Standorten untersucht, an denen thermophile und acidophile Bakterien wachsen können.[9] Die entdeckten Bakterien wurden später der Gattung Alicyclobacillus zugeordnet. Auch aus Böden, die nicht mit Thermalquellen in Verbindung stehen, konnten Alicyclobacillus-Arten isoliert werden, z. B. aus Ackerböden.[10][11] Erst 1982 wurde Alicyclobacillus mit dem Verderb von Fruchtsäften in Verbindung gebracht, seitdem sind mehrere Arten in säurehaltigen Getränken gefunden worden, beispielsweise A. acidoterrestris in Apfelsaft[10] und Maracujasaft[12] sowie A. acidiphilus. Die 2007 entdeckten Arten A. contaminans und A. fastidiosus wurden aus Orangensaft bzw. Apfelsaft isoliert.[11] In Brasilien durchgeführte mikrobiologische Überprüfungen von Orangenbäumen und des Bodens, in dem sie wachsen, zeigten die Anwesenheit von Alicyclobacillus bzw. der Bakteriensporen. Vom Boden als natürliches Habitat können sie auf die Früchte übertragen werden und damit unter Umständen in den Herstellungsprozess des Fruchtsaftes gelangen.[7] Sogar in Flüssigzucker wurde eine Spezies (A. sacchari) entdeckt.[11]
Systematik
Der erste Alicyclobacillus-Stamm wurde 1967 aus Heißwasserquellen isoliert[8] und nach weiteren Untersuchungen 1971 als neue Spezies Bacillus acidocaldarius benannt.[9] Auch weitere neu entdeckte Arten wurden zunächst der Gattung Bacillus zugeordnet. Basierend auf 16S-rRNA-Studien wurde 1992 Alicyclobacillus als neues Genus vorgeschlagen.[1] Zwei Bakterienstämme, die bis dahin der Gattung Sulfobacillus zugeordnet waren, wurden 2005 als A. tolerans und A. disulfidooxidans zu den Alicyclobacilli gestellt.[4] 2007 führten phylogenetische Untersuchungen an 146 Bakterienstämmen, die aus Fruchtsäften, deren Rohstoffen und Umweltproben isoliert wurden, zur Erstbeschreibung von sechs neuen Arten.[11]
Die Gattung Alicyclobacillus in der Familie der Alicyclobacillaceae wird zu der Ordnung Bacillales in der Abteilung der Firmicutes gestellt. Von der Gattung sind folgende Arten bekannt (Stand 2014):[6]
- Alicyclobacillus acidiphilus Matsubara et al. 2002
- Alicyclobacillus acidocaldarius (Darland & Brock 1971) Wisotzkey et al. 1992 emend. Goto et al. 2006 (die Typusart der Gattung)
- Alicyclobacillus acidocaldarius subsp. acidocaldarius (Darland & Brock 1971) Nicolaus et al. 2002
- Alicyclobacillus acidocaldarius subsp. rittmannii Nicolaus et al. 2002
- Alicyclobacillus acidoterrestris (Deinhard et al. 1988) Wisotzkey et al. 1992
- Alicyclobacillus aeris Guo et al. 2009
- Alicyclobacillus consociatus Glaeser et al. 2013
- Alicyclobacillus contaminans Goto et al. 2007
- Alicyclobacillus cycloheptanicus (Deinhard et al. 1988) Wisotzkey et al. 1992
- Alicyclobacillus disulfidooxidans (Dufresne et al. 1996) Karavaiko et al. 2005
- Alicyclobacillus fastidiosus Goto et al. 2007
- Alicyclobacillus ferroxydans Jiang et al. 2008
- Alicyclobacillus herbarius Goto et al. 2002
- Alicyclobacillus hesperidum Albuquerque et al. 2000
- Alicyclobacillus kakegawensis Goto et al. 2007
- Alicyclobacillus macrosporangiidus Goto et al. 2007
- Alicyclobacillus pohliae Imperio et al. 2008
- Alicyclobacillus pomorum Goto et al. 2003
- Alicyclobacillus sacchari Goto et al. 2007
- Alicyclobacillus sendaiensis Tsuruoka et al. 2003
- Alicyclobacillus shizuokensis Goto et al. 2007
- Alicyclobacillus tolerans Karavaiko et al. 2005
- Alicyclobacillus vulcanalis Simbahan et al. 2004
Industrielle Bedeutung
Alicyclobacilli sind für die Fruchtsaftindustrie besonders interessant, da übliche Pasteurisierungsverfahren (92 °C für 10 Sekunden) die Sporen nicht deaktivieren.[3] Die hohen Temperaturen führen zur Sporenkeimung.[13] Wenn Alicyclobacillus als Verunreinigung in einem Produkt vorliegt, entwickelt sich ein Desinfektionsmittel-ähnlicher Geruch und/oder Geschmack durch das Stoffwechselprodukt Guajacol.[7] Auch ähnliche Verbindungen, die halogenierten Phenole werden als unerwünschte sensorische Komponenten (off-flavour) von ihnen produziert.[5] Das Produkt bleibt optisch einwandfrei, d. h., es bilden sich keine Gase, die die Verpackung ausdehnen, und es findet keine Verfärbung statt.[14] Eine Kontamination mit Alicyclobacillus ist für Menschen nicht gefährlich.[15] Alicyclobacilli wurden mit dem Verderb von Birnen, Mangos und Traubensaft, sowie von Fruchtsaftmischungen und Produkten aus Tomaten in Verbindung gebracht.[13]
Die Art A. acidoterrestris wird als der wichtigste Verderbniserreger der Gattung Alicyclobacillus betrachtet,[3] allerdings wurden A. acidocaldarius, A. pomorum und A. herbarius ebenfalls aus verdorbenen Fruchtsaft-Produkten isoliert.[12] Weitere Arten, die in säurehaltigen Getränken gefunden wurden, beinhalten A. acidiphilus,[7] A. contaminans und A. fastidiosus.[11]
Fruchtsafthersteller arbeiten unter den Annahmen, dass Bakteriensporen bei einem pH-Wert unter 4,6 nicht auskeimen, und dass säuretolerante Organismen nicht sehr hitzeresistent sind. Mit diesen Annahmen ist ein Pasteurisierungsprozess bei niedrigen Temperaturen durchführbar. Heute ist es möglich, den Erreger früh im Herstellungsprozess mit Hilfe der Real-time PCR nachzuweisen und auf einen positiven Befund hin den Prozess anzupassen.[16] Alicyclobacillus ist somit ein wichtiger Mikroorganismus in der Qualitätskontrolle der Fruchtsaftindustrie.[7] Die Bedeutung von Alicyclobacillus als Verderbniserreger hat einige Forscher dazu bewegt, A. acidoterrestris als Referenz-Organismus für die Entwicklung eines Pasteurisierungsprozesses für stark säurehaltige Nahrungsmittel zu verwenden. In ähnlicher Weise wurde die Dezimalreduktionszeit („Absterbezeit“ bei einer bestimmten Temperatur) von Clostridium botulinum dazu benutzt, den Sterilisationsprozess für wenig säurehaltige, in Dosen abgefüllte Lebensmittel zu entwickeln.[17]
Analytik
Die kulturelle Bestimmung gemäß IFU-Methode Nr. 12 nutzt die physiologischen Besonderheiten von Alicyclobacillus spp. aus. Es wird parallel auf BAT (Bacillus acidoterrestris)-Medium mit einem niedrigen pH-Wert und auf einem herkömmlichen Plate Count-Agar (PCA) angesetzt. Alicyclobacillus spp. wachsen ausschließlich auf BAT-Agar. Ebenfalls hitzetolerante acidophile Begleitflora wächst auf beiden Medien. Problematisch für den Nachweis ist das langsame Wachstum von Alicyclobacillus Spezies. Für einen sicheren negativen Nachweis in prozessierten Produkten können daher Inkubationszeiten trotz Fortschritte in der Polymerase-Kettenreaktion (PCR) nicht weiter reduziert werden, um falsch-negative Befunde zu vermeiden. Ergänzende Bestätigungsreaktionen mittels Guajacol-Nachweis (biochemisch) und Speziesidentifizierung mittels MALDI-TOF MS können die klassisch kulturelle Analytik im positiven Fall beschleunigen und zusätzlich absichern.[18] Um die langen Generationszeiten und Matrixeffekte zu umgehen, ist eine Aptamer basierte Anreicherung der Sporen möglich. Mittels Real Time Quantitative PCR der ribosomalen DNA kann im Anschluss eine Zählung der Bakteriensporen erfolgen noch bevor diese im Produkt ausgekeimt sind.[19] Eine moderne kulturbasierte Methode ermöglicht die Aufnahme von Wachstumskurven während 96h Inkubation. Zur Bestätigung kann eine PCR in Kombination mit einem Lateral-Flow-Test zur schnellen Absicherung der Befunde eingesetzt werden.[20]
Einzelnachweise
- J. D. Wisotzkey, P. Jurtshuk u. a.: Comparative sequence analyses on the 16S rRNA (rDNA) of Bacillus acidocaldarius, Bacillus acidoterrestris, and Bacillus cycloheptanicus and proposal for creation of a new genus, Alicyclobacillus gen. nov. In: International journal of systematic bacteriology. Band 42, Nr. 2, April 1992, S. 263–269, ISSN 0020-7713. PMID 1374624.
- K. Goto, K. Mochida u. a.: Alicyclobacillus pomorum sp. nov., a novel thermo-acidophilic, endospore-forming bacterium that does not possess omega-alicyclic fatty acids, and emended description of the genus Alicyclobacillus. In: International journal of systematic and evolutionary microbiology. Band 53, Nr. 5, September 2003, S. 1537–1544, ISSN 1466-5026. PMID 13130044.
- Ana Cláudia N. F. Spinelli, Anderson S. Sant'Ana, Salatir Rodrigues-Junior, Pilar R. Massaguer: Influence of different filling, cooling, and storage conditions on the growth of Alicyclobacillus acidoterrestris CRA7152 in orange juice. In: Applied and environmental microbiology. Band 75, Nr. 23, Dezember 2009, S. 7409–7416, ISSN 1098-5336. doi:10.1128/AEM.01400-09. PMID 19801469. PMC 2786409 (freier Volltext).
- G. I. Karavaiko, T. I. Bogdanova u. a.: Reclassification of 'Sulfobacillus thermosulfidooxidans subsp. thermotolerans' strain K1 as Alicyclobacillus tolerans sp. nov. and Sulfobacillus disulfidooxidans Dufresne et al. 1996 as Alicyclobacillus disulfidooxidans comb. nov., and emended description of the genus Alicyclobacillus. In: International journal of systematic and evolutionary microbiology. Band 55, Nr. 2, März 2005, S. 941–947, ISSN 1466-5026. doi:10.1099/ijs.0.63300-0. PMID 15774689.
- Su-Sen Chang, Dong-Hyun Kang: Alicyclobacillus spp. in the fruit juice industry: history, characteristics, and current isolation/detection procedures. In: Critical reviews in microbiology. Band 30, Nummer 2, 2004, S. 55–74, ISSN 1040-841X. doi:10.1080/10408410490435089. PMID 15239380. (Review).
- Jean Euzéby, Aidan C. Parte: Genus Alicyclobacillus. In: List of Prokaryotic names with Standing in Nomenclature (LPSN).
- H. Matsubara, K. Goto u. a.: Alicyclobacillus acidiphilus sp. nov., a novel thermo-acidophilic, omega-alicyclic fatty acid-containing bacterium isolated from acidic beverages. In: International journal of systematic and evolutionary microbiology. Band 52, Nr. 5, September 2002, S. 1681–1685, ISSN 1466-5026. PMID 12361274.
- F. Uchino, S. Doi: Acido-thermophilic Bacteria from Thermal Waters. In: Agricultural and Biological Chemistry. Band 31, Nr. 7, 1967, S. 817–822, ISSN 0002-1369. doi:10.1271/bbb1961.31.817.
- G. Darland, T. D. Brock: Bacillus acidocaldarius sp. nov., an Acidophilic Thermophilic Spore-forming Bacterium. In: Journal of General Microbiology. Band 67, Nr. 1, Juli 1971, S. 9–15, ISSN 0022-1287. doi:10.1099/00221287-67-1-9.
- G. Deinhard, P. Blanz, K. Poralla, E. Altan: Bacillus acidoterrestris sp. nov., a New Thermotolerant Acidophile Isolated from Different Soils. In: Systematic and Applied Microbiology. Band 10, Nr. 1, November 1987, S. 47–53, ISSN 0723-2020. doi:10.1016/S0723-2020(87)80009-7.
- K. Goto, K. Mochida u. a.: Proposal of six species of moderately thermophilic, acidophilic, endospore-forming bacteria: Alicyclobacillus contaminans sp. nov., Alicyclobacillus fastidiosus sp. nov., Alicyclobacillus kakegawensis sp. nov., Alicyclobacillus macrosporangiidus sp. nov., Alicyclobacillus sacchari sp. nov. and Alicyclobacillus shizuokensis sp. nov. In: International journal of systematic and evolutionary microbiology. Band 57, Nr. 6, Juni 2007, S. 1276–1285, ISSN 1466-5026. doi:10.1099/ijs.0.64692-0. PMID 17551043.
- I. C. McKnight, M. N. U. Eiroa, A. S. Sant'Ana, P. R. Massaguer: Alicyclobacillus acidoterrestris in pasteurized exotic Brazilian fruit juices: isolation, genotypic characterization and heat resistance. In: Food microbiology. Band 27, Nummer 8, Dezember 2010, S. 1016–1022, ISSN 1095-9998. doi:10.1016/j.fm.2010.06.010. PMID 20832679.
- Willem H. Groenewald, Pieter A. Gouws, R. Corli Witthuhn: Isolation, identification and typification of Alicyclobacillus acidoterrestris and Alicyclobacillus acidocaldarius strains from orchard soil and the fruit processing environment in South Africa. In: Food microbiology. Band 26, Nr. 1, Februar 2009, S. 71–76, ISSN 1095-9998. doi:10.1016/j.fm.2008.07.008. PMID 19028308.
- Mirtha Nelly Uboldi Eiroa, Valéria Christina Amstalden Junqueira, Flaávio Schmidt: Alicyclobacillus in orange juice: occurrence and heat resistance of spores. In: Journal of food protection. Band 62, Nr. 8, August 1999, S. 883–886, ISSN 0362-028X. PMID 10456741.
- Filipa V. M. Silva, Paul Gibbs: Alicyclobacillus acidoterrestris spores in fruit products and design of pasteurization processes. In: Trends in Food Science & Technology. Band 12, Nr. 2, Februar 2001, S. 68–74, ISSN 0924-2244. doi:10.1016/S0924-2244(01)00070-X.
- S. Kohl: Alicyclobacillus im Fruchtsaft. In: Getränkeindustrie. Vol. 5, Mai 2011, S. 26–27.
- Filipa V. M. Silva, Paul Gibbs: Target selection in designing pasteurization processes for shelf-stable high-acid fruit products. In: Critical reviews in food science and nutrition. Band 44, Nr. 5, 2004, S. 353–360, ISSN 1040-8398. doi:10.1080/10408690490489251. PMID 15540648. (Review).
- A. Rau, M. Mailänder, B. Schütze: Nachweis acidophiler Getränkeschädlinge. In: Deutsche Lebensmittel-Rundschau. September 2016.
- Tim Hünniger, Christine Felbinger, Hauke Wessels, Sophia Mast, Antonia Hoffmann: Food Targeting: A Real-Time PCR Assay Targeting 16S rDNA for Direct Quantification of Alicyclobacillus spp. Spores after Aptamer-Based Enrichment. In: Journal of Agricultural and Food Chemistry. Band 63, Nr. 17, 6. Mai 2015, ISSN 0021-8561, S. 4291–4296, doi:10.1021/acs.jafc.5b00874.
- Nachweis von Alicyclobacillus binnen 96 Stunden möglich, Flüssiges Obst, 17. Juli 2019