Cycloheptan
Cycloheptan ist eine organische Verbindung, die zur Stoffgruppe der Cycloalkane gehört. Die Verbindung kann in verschiedenen Konformeren auftreten.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cycloheptan | ||||||||||||||||||
| Andere Namen |
Heptamethylen | ||||||||||||||||||
| Summenformel | C7H14 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,81 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
119 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4436 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
In der Natur kommt Cycloheptan im Erdöl vor und kann daraus gewonnen werden. Eine Synthese erfolgt durch eine Clemmensen-Reduktion aus Cycloheptanon.[4]
Eigenschaften
Physikalische Eigenschaften
Cycloheptan ist eine farblose Flüssigkeit mit einem milden, aromatischen Geruch. Der Siedepunkt liegt bei Normaldruck bei 119 °C.[1] Die molare Verdampfungsenthalpie beträgt 38,5 kJ·mol−1.[5] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,97710, B = 1330,402 und C = −56,946 im Temperaturbereich von 341,3 K bis 432,2 K.[5]
In der festen Phase tritt Cycloheptan in vier polymorphen Formen auf.[5][6] Die Umwandlungstemperaturen liegen für die Umwandlung von Form IV zu Form III bei −138 °C, von Form III zu Form II bei −75 °C und von Form II zu Form I bei −61 °C.[5] Die Form I schmilzt bei −8 °C.[5][1]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid | −156,4 kJ·mol−1[7] | |
| Standardentropie | S0liquid | 242,55 J·mol−1·K−1[5] | als Flüssigkeit |
| Verbrennungsenthalpie | ΔcH0liquid | −4598,9 kJ·mol−1[7] | |
| Wärmekapazität | cp | 180,614 J·mol−1·K−1 (25 °C)[8] 132,0 J·mol−1·K−1 (25 °C)[9] |
als Flüssigkeit als Gas |
| Tripelpunkt | Ttriple | 265,12 K[5] | |
| Kritische Temperatur | Tc | 604,2 K[10] | |
| Kritischer Druck | pc | 38,2 bar[10] | |
| Kritisches Volumen | Vc | 0.353 l·mol−1[10] | |
| Kritische Dichte | ρc | 2,83 mol·l−1[10] |
Chemische Eigenschaften
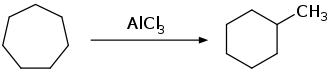
Cycloheptan kann in Gegenwart von Aluminiumchlorid thermisch in Methylcyclohexan umgelagert werden.[11]
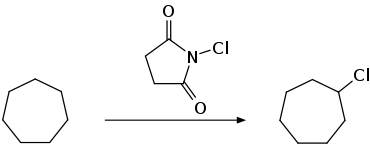
Eine Funktionalisierung kann durch die Chlorierung mit N-Chlorsuccinimid erfolgen.[12]
Die Verbindung ist brennbar und bildet mit Luft entzündbare Dampf-Luft-Gemische. Der Flammpunkt liegt bei 6 °C,[1][13] die untere Explosionsgrenze bei 1,1 Vol.-%.[1]
Verwendung
Cycloheptan kann als unpolares Lösungsmittel verwendet werden. In der organischen Synthese kann nach Funktionalisierung die Cycloheptylfunktion in organische Moleküle z. B. pharmazeutische Wirkstoffe eingeführt werden.
Gesundheitsgefahren
Eine Reizwirkung auf Augen und Atemswege wird in der Literatur erwähnt. Die toxische Wirkung ist eher mit dem Methylcyclohexan vergleichbar, welches die Schleimhäute nur schwach reizt. Im Tierversuch ergab sich hinsichtlich der Hautreizung nur eine geringfügige irritative Wirkung. Systemisch wirkt Cycloheptan depressiv auf das Zentralnervensystem.[1]
Weblinks
Einzelnachweise
- Eintrag zu Cycloheptan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Brockhaus ABC Chemie. F. A. Brockhaus Verlag, Leipzig 1965, S. 1587.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-126.
- Eintrag zu Cycloheptan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juni 2014.
- H. L. Finke, D. W. Scott, M. E. Gross, J. F. Messerly, G. Waddington: Cycloheptane, Cyclooctane and 1,3,5-Cycloheptatriene. Low Temperature Thermal Properties, Vapor Pressure and Derived Chemical Thermodynamic Properties. In: J. Am. Chem. Soc. 78, 1956, S. 5469–5476. doi:10.1021/ja01602a003.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1–525. doi:10.1063/1.555985.
- R. Spitzer, H. M. Huffman: The heats of combustion of cyclopentane, cyclohexane, cycloheptane and cyclooctane. In: J. Am. Chem. Soc. 69, 1947, S. 211–213. doi:10.1021/ja01194a006.
- J.-L. Fortier, P. J. D'Arcy, G. C. Benson: Heat capacities of binary cycloalkane mixtures at 298.15 K. In: Thermochim. Acta. 28, 1979, S. 37–43, doi:10.1016/0040-6031(79)87005-7.
- O. V. Dorofeeva: Thermodynamic properties of twenty-one monocyclic hydrocarbons. (Memento vom 4. März 2016 im Internet Archive) In: J. Phys. Chem. Ref. Data. 15, 1986, S. 437–464. doi:10.1063/1.555773.
- T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes. In: J. Chem. Eng. Data. 41, 1996, S. 365–372. doi:10.1021/je9501548.
- S. Hauptmann, J. Gräfe, H. Remane: Lehrbuch der organischen Chemie. Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 207.
- Ph. Buu-Hou, P. Demerseman: Halogenation of Saturated Compounds with N-Chloro- and N-Bromo-Succinimide. In: J. Org. Chem. 18, 1953, S. 649–652. doi:10.1021/jo01134a005.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.

