Ammoniumcarbamat
Ammoniumcarbamat, früher auch Ammoniumcarbaminat genannt, ist das Ammoniumsalz der Carbaminsäure, die in freiem Zustand nicht bekannt ist. Es ist ein Nebenbestandteil von Hirschhornsalz.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
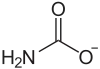 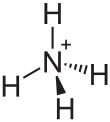 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniumcarbamat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | H2NCOONH4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff mit ammoniakartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 78,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,6 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
Zersetzung ab 35 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (790 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Ammoniumcarbamat bildet ein farbloses Kristallpulver, das sich in Wasser gut (zu 790 g/l) löst. Durch Zugabe von Ammoniakgas wird die Löslichkeit noch erhöht. In wässriger Lösung hydrolysiert Ammoniumcarbamat ab 35 °C teilweise, oberhalb von 60 °C vollständig unter Bildung von Ammoniumcarbonat, das wiederum in Ammoniak und Kohlenstoffdioxid zerfallen kann.
Der Zerfall kann über die entsprechenden Dissoziationsdrücke quantifiziert werden.[4]
| Dissoziationsdruck von Ammoniumcarbamat[4] | ||||||||||||
| Temperatur | in °C | 10,03 | 14,92 | 17,86 | 21,25 | 24,91 | 26,77 | 30,91 | 35,91 | 39,89 | 44,86 | |
| Druck | in kPa | 3,89 | 5,66 | 7,03 | 9,08 | 11,77 | 13,37 | 17,85 | 24.89 | 32.33 | 44,21 | |
Beim Erhitzen in einem geschlossenen System kann bei Temperaturen schon um Raumtemperatur ein Zerfall in Harnstoff und Wasser beobachtet werden. Die Umwandlungsgeschwindigkeit nimmt mit steigender Temperatur stark zu, wobei das gebildete Wasser katalytisch wirkt.
Synthese
Ammoniumcarbamat entsteht durch direkte Reaktion von Ammoniakgas und CO2 im Volumenverhältnis 2:1 unter Ausschluss von Wasser.
Verwendung
Ammoniumcarbamat wird in der Kosmetikindustrie und bei der Herstellung von Schädlingsbekämpfungsmitteln verwendet. Es ist auch eine wichtige Zwischenstufe bei der Herstellung von Harnstoff. Weitere Verwendung findet es als Reinigungs-, Beiz- und Neutralisationsmittel, sowie in dem oben erwähnten Hirschhornsalz zum Backen. In Deutschland beträgt die Direktproduktion von Ammoniumcarbamat wegen der geringen Nachfrage lediglich rund 1000 t/a. Die Automobilindustrie untersucht Ammoniumcarbamat als Alternative zur Harnstofflösung AUS 32 in SCR-Katalysatoren.
Einzelnachweise
- Eintrag zu AMMONIUM CARBAMAT in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Ammoniumcarbamat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- K.-H. Zapp, K.-H. Wostbrock, M. Schäfer, K. Sato, H. Seiter, W. Zwick, R. Creutziger, H. Leiter: Ammonium Componds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a02_243.
- T. R. Briggs, V. Migrdishian: The Ammoniumn Carbamate Equilibrium. In: J. Phys. Chem. 28, 1923, S. 1121–1135, doi:10.1021/j150245a001.

