Weinsäure
Weinsäure, auch als 2,3-Dihydroxybernsteinsäure oder 2,3-Dihydroxybutandisäure oder Weinsteinsäure, im Lateinischen als Acidum tartaricum und im Englischen mit tartaric acid bezeichnet, vom griechischen tartaros Hölle, aufgrund der ätzenden, brennenden Wirkung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
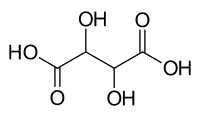 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Weinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6O6 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[5] mit säuerlichem Geschmack | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 150,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Es ist eine Dicarbonsäure in der Gruppe der α-Hydroxycarbonsäure. Sie gehört zu den Zuckerdicarbonsäuren (Aldarsäuren), ihre Salze und Ester heißen Tartrate. L-(+)-Weinsäure tritt beispielsweise in Weintrauben auf und ist in der EU als Lebensmittelzusatzstoff E 334 zugelassen. In Deutschland wird auch der Gesamtsäuregehalt von Weinen – berechnet als Weinsäure – angegeben, obgleich im Wein noch eine Anzahl anderer Säuren, vor allem Äpfelsäure, vorkommt.
Traubensäure bezeichnet das Racemat der Weinsäure. Durch intermolekulare Wasserabspaltung entsteht die polymere Metaweinsäure, die unter der Bezeichnung E 353 ebenfalls als Lebensmittelzusatzstoff verwendet wird.
Geschichte
Vor der Entdeckung der Weinsäure wurde ihr Salz Kaliumhydrogentartrat, der Weinstein, für eine Säure gehalten, da es durch seine schlechte Wasserlöslichkeit im Wein leicht ausfällt und daher für die Chemiker einfacher erkennbar war als die gut lösliche Weinsäure. Damals war der auch heute noch volkstümlich verwendete Begriff Weingeist für den reinen Alkohol üblich. 1732 wurde Weinstein von Boerhaave als feste Säure angeführt. 1764 wurde von Marggraf ein Alkalimetall im Weinstein nachgewiesen, woraufhin er diesen mit Calcium zu Calciumtartrat zersetzte, das er jedoch nicht genauer untersuchte. Erst 1769 zersetzte Scheele, der gemeinhin als Entdecker der Weinsäure gilt, Calciumtartrat mit Schwefelsäure und bezeichnete die abgeschiedene kristalline Säure als „Weinsteinsäure“. Der Weinstein wurde kurz darauf als saures Kalisalz dieser Säure erkannt.

1819 wurde die Traubensäure (Vogesensäure) vom Fabrikanten Karl Kestner als Nebenprodukt der Weinsäureherstellung entdeckt.[11] Die Isomerie der Weinsäure wurde 1826 von Gay-Lussac festgestellt und von Pasteur detaillierter untersucht, wobei damals nur die optisch aktive „rechtsdrehende Weinsäure“, also die L-Weinsäure und die Traubensäure, als „racemische Säure“ bezeichnet, bekannt waren. Pasteur stellte das Natriumammoniumsalz dieser Säuren her und entdeckte dabei die Chiralität. Mit Lupe und Pinzette trennte Pasteur die Kristalle in linksdrehende und rechtsdrehende Exemplare.
Die so aus dem Racemat getrennten enantiomeren Natriumammoniumtartrate brachte Pasteur wieder in Lösung und untersuchte ihren Drehwert im Polarimeter. Dabei stellte er fest, dass beide Lösungen der aus der optisch inaktiven Traubensäure gewonnenen Salze optisch aktiv waren und dieselbe spezifische Drehung wie aus L-Weinsäure gewonnenes Natriumammoniumsalz aufwiesen, jedoch mit entgegengesetztem Vorzeichen. Daraus folgerte Pasteur, dass Traubensäure kein Reinstoff, sondern ein gleichteiliges Gemisch aus rechts- und linksdrehender Weinsäure, also ein Racemat ist. Der Begriff Racemat für eine Mischung zweier Enantiomere zu gleichen Teilen leitet sich aus der lateinischen Bezeichnung für Traubensäure (Acidum racemicum) ab.
Die Deutungen von Pasteurs Experiment erschöpfen sich allerdings nicht darin, dass Traubensäure ein Racemat aus L- und D-Weinsäure ist. Zwar erkannte Pasteur, dass die optische Aktivität eine Folge einer Eigenschaft des Weinsäuremoleküls selbst sein musste. Doch erst 1874 konnten Le Bel und van ’t Hoff, der in der Folge zum ersten Chemie-Nobelpreisträger wurde, dies unabhängig voneinander anhand der Molekülstruktur erklären. Im Wissen, „dass vier unterschiedliche Objekte auf zwei verschiedene Weisen in den Ecken eines Tetraeders angeordnet werden können und dass sich diese Anordnungen zueinander wie Bild und Spiegelbild verhalten, die nicht zur Deckung zu bringen sind“[12] stellten sie die Hypothese auf, dass die vier an ein Kohlenstoffatom gebundenen Reste tetraedrisch angeordnet sind. Davon ausgehend vermuteten sie, dass optisch aktive Moleküle mindestens ein Kohlenstoffatom mit vier verschiedenen Resten, also ein asymmetrisches Kohlenstoffatom, enthalten. „Optisch inaktive organische Substanzen enthalten demnach entweder kein asymmetrisches Kohlenstoffatom oder sie sind Gemische aus gleichen Teilen zweier Enantiomerer.“[12]
Van ’t Hoff und Le Bel erkannten damit zum einen die tetraedrische Geometrie des Kohlenstoffatoms und gaben zum anderen eine schlüssige Erklärung für die optische Aktivität organischer Stoffe. Nur die meso-Verbindungen ließen sich durch ihre Definition nicht abdecken, erst sehr viel später wurde die Struktur der meso-Weinsäure entdeckt. Lange unbekannt blieb auch, welches Enantiomer der Weinsäure nun die Polarisationsebene des Lichts nach rechts, und welches sie nach links dreht. Erst 1951 konnte Bijvoet mit einer speziellen Röntgenmethode anhand des Natriumrubidiumtartrats klären, dass es sich bei L-Weinsäure um das rechtsdrehende (+)-Enantiomer und bei D-Weinsäure um das linksdrehende (−)-Enantiomer handelt. Durch Umwandlung von Weinsäure in andere chemische Verbindungen konnte dies ebenfalls für viele andere Enantiomerenpaare geklärt werden.
Vorkommen
Besonders die L-(+)-Weinsäure sowie deren Calcium-, Kalium- und Magnesiumsalze finden sich reichlich in den Reben, Trauben und Blättern des Weinstocks sowie im Löwenzahn, in Zuckerrüben, in Tamarinden, in unreifen Vogelbeeren, in den Samen des Spindelbaums, in den Blättern der Agaven, in schwarzem Pfeffer, in der Ananas und in vielen weiteren Früchten. Bei der Weinherstellung scheiden sich schwerlösliche Salze der Weinsäure als Weinstein am Boden von Weinfässern oder Weinflaschen ab. Die D-(−)-Weinsäure, nicht ganz korrekt unnatürliche Weinsäure genannt, findet sich nur in den Blättern des westafrikanischen Orchideenbaums Bauhinia reticulata.[8] Die meso-Form existiert in der Natur nicht.
Herstellung
Die Herstellung von Weinsäure aus Weinstein gelingt nach der Umwandlung in Calciumtartrat. Aus diesem kann mit Schwefelsäure die Weinsäure freigesetzt werden, als Nebenprodukt entsteht Gips. Die meso-Form lässt sich durch Oxidation von Fumarsäure oder Maleinsäureanhydrid mit Wasserstoffperoxid, Kaliumpermanganat oder anderen Persäuren herstellen.
Reine D-(−)-Weinsäure kann durch den Abbau mit Pinselschimmel Penicillium glaucum aus dem Racemat erhalten werden, da Penicillium glaucum nur die L-(+)-Weinsäure abbaut.
Eigenschaften
Die zwei Kohlenstoffatome, die die beiden Hydroxygruppen im Molekül der Weinsäure tragen, sind Stereozentren. Je nach der Konfiguration dieser Zentren liegt D-(−)-Weinsäure [Synonym: (2S,3S)-Weinsäure], L-(+)-Weinsäure [Synonym: (2R,3R)-Weinsäure] oder die optisch inaktive meso-Weinsäure vor. In der meso-Form ist eines der Stereozentren (R)- das andere (S)-konfiguriert. In der Natur kommt meist die rechtsdrehende L-(+)-Form vor. Die beiden Enantiomeren der Weinsäure [L-(+)-Weinsäure und D-(−)-Weinsäure] unterscheiden sich nicht in ihren physikalischen und chemischen Eigenschaften nur im Drehwert gegen linear polarisiertes Licht Der Drehwert α beträgt bei L-(+)-Weinsäure +12,7°, bei D-(−)-Weinsäure −12,7°[13] bei gleichen Messbedingungen. Der Drehwert der meso-Weinsäure beträgt, wie bei allen meso-Verbindungen, ± 0°. Die physiologischen Eigenschaften aller drei Stereoisomere der Weinsäure sind verschieden.
| Isomere der Weinsäure | ||||
| Name | D-(−)-Weinsäure | L-(+)-Weinsäure | meso-Weinsäure | |
| Andere Namen | (2S,3S)-Weinsäure | (2R,3R)-Weinsäure | ||
| Strukturformel | 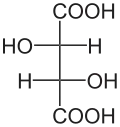 |
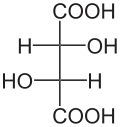 |
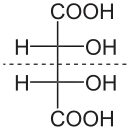 Gestrichelte Linie: Spiegelebene | |
| CAS-Nummer | 147-71-7 | 87-69-4 | 147-73-9 | |
| 133-37-9 [DL-(±)-Gemisch] | ||||
| 526-83-0 (unspez.) | ||||
| EG-Nummer | 205-695-6 | 201-766-0 | 205-696-1 | |
| 205-105-7 [DL-(±)-Gemisch] | ||||
| 610-885-0 (unspez.) | ||||
| ECHA-Infocard | 100.005.178 | 100.001.606 | 100.005.179 | |
| 100.004.642 [DL-(±)-Gemisch] | ||||
| 100.121.903 (unspez.) | ||||
| PubChem | 439655 | 444305 | 440015 | |
| 875 (unspez.) | ||||
| Wikidata | Q23034947 | Q18226455 | Q12447642 | |
| Q4111665 [DL-(±)-Gemisch] | ||||
| Q411237 (unspez.) | ||||
Die Alkalisalze der Weinsäure vermögen in alkalischer Lösung Kupfer(II)-Ionen zu komplexieren (zu binden) und dadurch in Lösung zu halten (Fehlingsche Lösung). Als zweibasische, verhältnismäßig starke Säure können auch Hydrogentartrate gebildet werden. Eine Mischung gleicher Mengen von L-(+)- und D-(−)-Weinsäure (Racemat) wird als Traubensäure bezeichnet, Schmelzpunkt 205–206 °C. Diese Mischung wird manchmal auch racemische Weinsäure genannt. Eine Mischung der drei Stereoisomere der Weinsäure mit variablen Anteilen L-(+)-, D-(−)- und meso-Weinsäure wird als Isomerengemisch der Weinsäure gehandelt.
Verwendung
In größerem Maßstab findet nur die L-Weinsäure Verwendung, da sie das Produkt der meisten Syntheseverfahren von Weinsäure darstellt. 50 % der produzierten L(+)-Weinsäure gehen in die Lebensmittelindustrie und Pharmazie, die andere Hälfte in technische Anwendungsgebiete.
Weinsäure wird als Ingredienz von Desinfektionsmitteln verwendet. Dabei wird in der Regel nicht ausgewiesen, ob es sich um L- oder D- Weinsäure, die racemisch gemischte Weinsäure oder ein anderes Mischungsverhältnis handelt.
Verwendung als Lebensmittelzusatzstoff
Der offensichtlichste Anwendungsbereich der Weinsäure liegt in ihrer Verwendung als Lebensmittelzusatzstoff. Die in diesem Bereich als E 334 bezeichnete L-Weinsäure findet sich nicht nur natürlich in vielen Lebensmitteln, sondern wird aufgrund ihrer geschmacklichen und konservierenden Eigenschaften auch vielen Lebensmittel-Mischprodukten zugesetzt. Weinsäure wird bei der Bereitung von Speiseeis, Kunsthonig, Obst, Limonaden und Erfrischungsgetränken, Gelee, Weingummis und Konditorwaren, z. B. zur Stabilisierung von Cremes und Schäumen, und bei der Säuerung säurearmer Weine verwendet. In Backbüchern wird auch fälschlicherweise die Bezeichnung Weinsteinsäure verwendet. Die orale Toxizität der L-Weinsäure war im Tierversuch mit Ratten äußerst gering; die LDLo lag für Ratten bei oraler Gabe bei 7500 mg/kg Körpergewicht.[10]
Die als Lacton polymere Metaweinsäure (E 353) wird hauptsächlich zur Weinsteinstabilisierung verwendet; als Schutzkolloid verhindert sie die Kristallisation von Weinstein im Wein.[14]
Technische Verwendungsmöglichkeiten
Weiterhin findet Weinsäure auch in vielen technischen Bereichen Verwendung, unter anderem beim Griffigmachen und Glätten von Seide. Bedeutsam ist die Fähigkeit der Weinsäure, mit Metallen Komplexe zu bilden: Bei diesen Komplexen wird das Metall-Kation durch die Weinsäure fester gebunden, als bei den meisten anderen organischen Säuren. Dadurch ergeben sich zahlreiche Anwendungsmöglichkeiten. Kaliumnatriumtartrat wird beispielsweise als Komplexbildner in Fehlingscher Lösung eingesetzt, Weinsäure zur Oberflächenbehandlung von Kupfer- und Messingartikeln. Letztere kann ebenfalls zur Reinigung schwermetallkontaminierter Böden verwendet werden, da sie hier giftige Schwermetalle bindet, aber selbst biologisch abbaubar ist. Setzt man sie Zement und Gips zu, verzögert sie deren Abbinden durch Komplexieren der Calciumionen und verlängert damit die Bearbeitungs- und Verformbarkeitszeit. Weiterhin dient sie als Reduktionsmittel und zur Racematspaltung organischer Basen. In der modernen organischen Synthese sind LiAlH4-Weinsäurederivate wie TADDOL wichtige chirale Reagenzien oder Katalysatoren zur enantioselektiven Reduktion von Ketonen sowie anderen stereoselektiven Syntheseverfahren.[15][16]
Weblinks
Einzelnachweise
- Alfred Henry Allen: Commercial Organic Analysis. Vol. I, 2nd Edition, J. & A. Churchill, 1885, S. 435, online auf babel.hathitrust.org, abgerufen am 13. November 2017.
- Rudolf Wagner: Die Chemie. 6. Auflage, Wiegand, 1873, S. 515.
- Hans Meyer: Lehrbuch der Organisch-Chemischen Methodik. Zweiter Band, Springer, 1933, ISBN 978-3-662-37141-1 (Reprint), S. 161.
- Eintrag zu E 334: Tartaric acid (L(+)-) in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Datenblatt D-(−)-Weinsäure (PDF) bei Carl Roth, abgerufen am 7. August 2010.
- K. Peter C. Vollhardt: Organische Chemie. 1. korrigierter Nachdruck der 1. Auflage, VCH, Weinheim 1990, ISBN 3-527-26912-6, S. 166.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1557–1558.
- Eintrag zu Weinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- Eintrag zu Weinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Tartaric acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. März 2021.
- Johann Christian Poggendorff: Biographisch-literarisches Handwörterbuch. 1. Band: A–L, Barth, 1863, S. 1251.
- H. Hart, L. E. Crane, D. J. Hart: Organische Chemie. 2. Auflage, WILEY-VCH Verlag, Weinheim 2002, ISBN 978-3-527-30379-3, S. 193.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. 4. Auflage, Thieme Verlag, 2001, ISBN 978-3-13-541504-8.
- S. Görtges: Metaweinsäure zur Weinsteinstabilisierung (Memento vom 15. August 2016 im Internet Archive) (PDF). In: Schweiz. Z. Obst-Weinbau. Nr. 1, 2002, S. 8–9.
- D. Seebach, A. K. Beck und A. Heckel: TADDOLs, Their Derivatives, and TADDOL Analogues: Versatile Chiral Auxiliaries. In: Angewandte Chemie International Edition. 40, 2001, S. 92–138, PMID 11169693.
- M. Aoki und D. Seebach: Preparation of TADOOH, a Hydroperoxide from TADDOL, and Use in Highly Enantioface- and Enantiomer-Differentiating Oxidations. In: Helvetica Chimica Acta. 84, 2001, S. 187–207, doi:10.1002/1522-2675(20010131)84:1<187::AID-HLCA187>3.0.CO;2-O.
