Polare Atombindung
Polare Atombindungen sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen.[1] Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht.
Das Atom mit dem größeren Elektronegativitätswert (EN) zieht die bindenden Elektronen stärker zu sich heran als das Atom mit dem kleineren Elektronegativitätswert. Dadurch wird die Ladungsverteilung entlang der Atombindung asymmetrisch. Das Atom des stärker elektronegativen Elements erhält eine negative Teilladung, das Atom des schwächer elektronegativen Elements eine positive Teilladung. Diese Teilladungen sind kleiner als die Ladungen von Ionen. Die polare Atombindung stellt einen Übergang von der reinen Atombindung zur Ionenbindung dar.

Prinzipiell ist jede Paarung zwischen Atomen, die unterschiedliche Elemente sind, polar. Die Polarität der Bindung kann aber unterschiedlich hoch sein. Die häufig zitierte Faustregel, dass bis zu einer bestimmten Elektronegativitätsdifferenz (Delta-EN) von etwa 0,4 eine kovalente Bindung und ab ca. 1,7 eine ionische Bindung vorliegt, sollte eher so verstanden werden, dass es in diesen Fällen sinnvoll ist, die Bindung eher kovalent oder eher ionisch zu beschreiben. Die EN-Differenz ist aber nicht das einzige Kriterium. Auch Größe und Größenverhältnis der beteiligten Atome sowie die Koordinationszahlen können eine große Rolle spielen.
So ist beispielsweise Fluorwasserstoff trotz der großen EN-Differenz von 1,8 ein polar kovalent gebundenes Molekül. Die Verbindung ist bei Raumtemperatur ein Gas. Lithiumhydrid (LiH) und Magnesiumhydrid (MgH2) sind demgegenüber trotz der wesentlich geringeren EN-Differenzen von ca. 1,2 bzw. 0,8 salzartige Verbindungen, die sich gut ionisch beschreiben lassen. LiH weist z. B. die gleiche Struktur wie Kochsalz (NaCl) auf. Außerdem können sich auch Moleküle mit niedriger polarer Bindung unter Bildung von Ionen in Wasser (oder anderen Lösungsmitteln) lösen. Ein sehr anschauliches Beispiel ist Iodwasserstoff (HI). Hier liegt eine EN-Differenz von etwa Null vor. Trotzdem ist das Molekül leicht polar (Hδ+-Iδ−) und eine sehr starke Säure (stärker als HCl). Sie bildet mit Wasser H3O+- und I−-Ionen.
In Brommethan und anderen Halogenalkanen ist das Halogenatom negativ (δ–) polarisiert, das nebenstehende Kohlenstoffatom positiv (δ+) polarisiert (siehe Abbildung).[2]
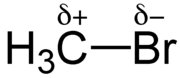
Beim Molekülaufbau ist es etwas anders. Es kann vorkommen, dass ein Molekül mit polaren Atombindungen nach außen kein Dipolmoment aufweist. Dies tritt immer dann auf, wenn wegen des symmetrischen Aufbaus des Moleküls der positive und der negative Ladungsschwerpunkt identisch sind. Dies ist zum Beispiel bei Molekülen wie Kohlenstoffdioxid (CO2) oder Kohlenstofftetrafluorid (CF4) der Fall. Hier beträgt die delta-EN 1,0 bzw. 1,5. Weil die Moleküle linear bzw. tetraedrisch aufgebaut sind, fallen in beiden Fällen die Ladungschwerpunkte zusammen und beide haben kein Dipolmoment. Erkennbar ist das zum Beispiel an den relativ niedrigen Siedepunkten. Die zwischenmolekulare Anziehung beruht hier nur auf Van-der-Waals-Kräften.

Unpolare Atombindungen kommen nur zustande, wenn sich zwei Atome absolut gleicher Elektronegativität miteinander verbinden. Dies ist nur bei Bindungen zwischen Atomen des gleichen chemischen Elements der Fall. Bei sehr kleinen EN-Differenzen – wie im Fall der Kombination C-H – findet man nur eine sehr schwache Bindungspolarität. Die meisten Kohlenwasserstoff-Moleküle weisen dementsprechend sehr kleine Teilladungen auf. Ihre Siedepunkte sind daher, verglichen mit anderen Molekülen ähnlicher Größe, relativ niedrig, da durch die geringe Polarität die Kräfte der Wasserstoffbrückenbindungen entsprechend gering ausfallen.
Einzelnachweise
- Brockhaus ABC Chemie, VEB F. A. Brockhaus-Verlag Leipzig 1965, S. 304–305.
- Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 29–31, ISBN 3-7776-0406-2.