Cyanwasserstoff
Cyanwasserstoff (Blausäure) ist eine farblose bis leicht gelbliche, brennbare, sehr flüchtige und wasserlösliche Flüssigkeit. Die Bezeichnung Blausäure rührt von der früheren Gewinnung aus Eisenhexacyanidoferrat (Berliner Blau) her, einem lichtechten tiefblauen Pigment. Blausäure kann als Nitril der Ameisensäure angesehen werden (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff), daher rührt auch der Trivialname Ameisensäurenitril.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Cyanwasserstoff | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | HCN | ||||||||||||||||||
| Kurzbeschreibung |
farblose, nach Bittermandeln riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 27,03 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
0,69 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
26 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
9,40[2] | ||||||||||||||||||
| Löslichkeit |
mit Wasser vollständig mischbar[1] | ||||||||||||||||||
| Brechungsindex |
1,2614 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
108,9 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Blausäure ist hochgiftig. Ihre tödliche Wirkung wurde in der Geschichte verschiedentlich gegen Menschen eingesetzt, vor allem bei den Massenmorden zur Zeit des Nationalsozialismus im KZ Auschwitz, und fand auch Eingang in die Literatur (Kriminalromane). Industriell wird Blausäure als Vorprodukt und Prozessstoff sowie zur Schädlingsbekämpfung eingesetzt.
Nach verbreiteter Auffassung geht von Blausäure ein charakteristischer Geruch nach Bittermandeln aus. Der tatsächliche Geruch der Substanz wird jedoch in der Literatur nicht einhellig so beschrieben und von manchen Menschen abweichend wahrgenommen, z. B. „dumpf“ oder „scharf“. Ein erheblicher Teil der Bevölkerung nimmt den Geruch von Blausäure überhaupt nicht wahr (siehe auch Handhabung).
Eigenschaften
Blausäure ist in hochreiner Form eine farblose, leichtbewegliche, mit Wasser und Alkohol in jedem Verhältnis mischbare Flüssigkeit. Der Siedepunkt liegt bei 26 °C. Die Substanz verdampft bei Raumtemperatur so schnell, dass ein Teil davon wegen der Verdunstungskälte erstarren kann.
Blausäure besitzt in verdünnter Form einen betäubend-dumpfen, an bittere Mandeln erinnernden Geruch, der sich aber signifikant von z. B. Bittermandelaroma unterscheidet. In konzentrierter Form riecht Blausäure unangenehm und nicht definierbar, intensiv stechend-scharf und kratzend, reizt die Schleimhäute und die Kehle und hinterlässt einen bitteren Geschmack und kurzzeitiges Brennen in der Nase. Allerdings lähmt die Substanz schon in sehr kleinen Mengen nach kurzer Zeit die Geruchs- und Geschmacksnerven.[9]
Blausäure ist in Wasser eine sehr schwache Säure, die schon von Kohlensäure aus ihren Salzen, den Cyaniden, getrieben wird und nur zu einem kleinen Anteil dissoziiert:
Von den Salzen der Blausäure sind die der Alkali- und Erdalkalimetalle sowie das Quecksilber(II)-cyanid in Wasser leicht löslich, alle anderen sind schwer löslich.[10]
Ihr pKS-Wert wird, je nach Quelle, mit 9,04 bis 9,31 angegeben. Die Dissoziationskonstante beträgt 4,0·10−10.[11] Blausäure ist hochentzündlich, Gemische mit Luft sind im Bereich von 5,4–46,6 Vol.-% explosiv. Da Blausäure zudem mit Wasser in jedem Verhältnis mischbar ist, besteht beim Löschen von Bränden die Gefahr einer Kontamination des Grundwassers. Daher wird gegebenenfalls ein kontrolliertes Abbrennen in Betracht gezogen.
Blausäure kann in einer autokatalysierten Reaktion spontan polymerisieren oder in die Elemente zerfallen. Diese Reaktion ist stark exotherm und verläuft explosionsartig. Sie wird durch geringe Mengen an Basen initiiert und durch weitere Base, die sich dabei bildet, beschleunigt. Wasserhaltige Blausäure ist dabei instabiler als vollkommen wasserfreie. Es entsteht ein braunes Polymer. Aus diesem Grund wird Blausäure durch Zugabe geringer Mengen an Säuren, wie Phosphor- oder Schwefelsäure, stabilisiert. Die Säure neutralisiert die Basen und vermeidet eine Durchgehreaktion.
Geschichte
Der Name Blausäure geht auf das Pigment Berliner Blau zurück, aus dem die Substanz zuerst hergestellt wurde. 1782 erschien eine Veröffentlichung von Carl Wilhelm Scheele, die die Herstellung von Blausäure sowohl aus gelbem Blutlaugensalz und Schwefelsäure als auch aus Berliner Blau und Schwefelsäure beschreibt. Die Versuche dazu hatte Scheele bereits 1768 begonnen.[12] Die Silbe Cyan wurde von Joseph Louis Gay-Lussac eingeführt.
Nachweis
- Ein klassisches Verfahren ist der Nachweis über die Cyanid-Ionen: Zu einer alkalischen Lösung wird im Unterschuss Eisen(II)-sulfat-Lösung zugegeben. Sind Cyanid-Ionen vorhanden, bildet sich nach dem Ansäuern Berliner Blau. Es entweicht Blausäure.
- Bei Zugabe von Quecksilber(II)-chlorid entsteht Chlorwasserstoff-Gas. Dieses kann durch einen Säureindikator nachgewiesen werden.
- Ein Becherglas mit der leicht angesäuerten zu prüfenden Lösung wird mit einem Filterpapier abgedeckt, welches zuvor mit einer wässrigen Lösung, enthaltend Kupfer(II)-acetat und Benzidinacetat, angefeuchtet wurde. Bei Anwesenheit von HCN tritt eine deutliche Blaufärbung des Filterpapiers auf (Benzidinblau). Über diese sehr empfindliche Reaktion können noch 25 mg HCN in 1 m3 Luft nachgewiesen werden.[10]
Giftwirkung
Blausäure ist extrem giftig, schon 1–2 mg Blausäure pro kg Körpermasse wirken tödlich. Die Aufnahme kann, neben der direkten Einnahme, auch über die Atemwege und die Haut erfolgen. Letzteres wird durch Schweiß begünstigt, da Blausäure eine hohe Wasserlöslichkeit besitzt. In Deutschland wurde die Substanz vom Umweltbundesamt in die Wassergefährdungsklasse 3 (stark wassergefährdend) eingestuft.[1]
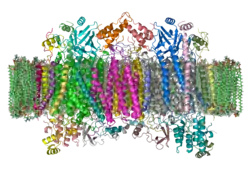
Die primäre Giftwirkung besteht in der Blockade der Sauerstoff-Bindungsstelle in der Atmungskette der Körperzellen. Dabei bindet sich das Cyanid irreversibel an das zentrale Eisen(III)-Ion des Häm-a3-Kofaktors in der Cytochrom-c-Oxidase in den Mitochondrien. Durch die Inaktivierung des Enzyms kommt die Zellatmung zum Erliegen, die Zelle kann den Sauerstoff nicht mehr zur Energiegewinnung verwerten, und es kommt damit zur sogenannten „inneren Erstickung“. Der Körper reagiert auf den vermeintlichen Sauerstoffmangel mit einer Erhöhung der Atemfrequenz. Da der Sauerstoff im Blut nicht verwertet werden kann und sich in Folge auch im venösen Blut ansammelt, zeigt sich eine hellrote Färbung der Haut. Schließlich sterben die Zellen an Mangel an ATP, das normalerweise in der Zellatmung gebildet wird. Die Bindung des Cyanids an Eisen(II)-Ionen ist vergleichsweise schwach. Die Inaktivierung des Hämoglobins spielt daher bei Vergiftungen eine untergeordnete Rolle.
Gegengifte sind 4-Dimethylaminophenol (4-DMAP), Natriumthiosulfat, Hydroxycobalamin, Isoamylnitrit.
Der in vielen Nahrungsmitteln in geringen Konzentrationen enthaltene Cyanwasserstoff wird vom menschlichen Enzym Rhodanase zu dem wesentlich weniger gefährlichen Thiocyanat (Rhodanid) umgewandelt.
Natürliches Vorkommen

Die Kerne einiger Steinobstfrüchte (Mandel, insbesondere Bittermandel, Aprikose, Pfirsich, Kirsche) und anderer Rosengewächse enthalten geringe Mengen an Blausäure; diese dient teilweise als Fraßschutz der Samen und auch als chemischer Keimungshemmer, indem die Atmung der Samen gehemmt wird. Erst nachdem die Fruchtwand (Endokarp) verrottet ist, kann die Blausäure entweichen und somit den Keimungsprozess aktivieren. Die in den Tropen vielfach als Nahrungsmittel genutzte Knolle des Maniok enthält ebenfalls als cyanogenes Glykosid gebundene Blausäure, die durch die Verarbeitung vor dem Verzehr der Pflanze entfernt wird. Weitere wichtige Nahrungsmittel mit toxikologisch relevanten Blausäuregehalten sind Yamswurzel, Süßkartoffel (gewisse Sorten), Zuckerhirse, Bambus, Leinsamen und Limabohne. Unreife Bambussprossen, die in östlichen Ländern als Delikatesse gelten, enthalten hohe Blausäuregehalte, Vergiftungsfälle sind bekannt. Durch Zubereitung (intensives Kochen) wird die Blausäure von den Glykosiden abgespalten und in die Luft abgegeben.
Cyanogene Giftpflanzen sind unter den höheren Pflanzen weit verbreitet und können bei Verletzung des Pflanzengewebes durch Pflanzenfresser HCN aus cyanogenen Glykosiden mittels des Enzyms Hydroxynitrillyase freisetzen. Einige Beispiele für cyanogene Pflanzen sind der tropische Goldtüpfelfarn (Phlebodium aureum), ein Mitglied der Tüpfelfarngewächse, oder der brasilianische Gummibaum (Hevea brasiliensis). Weiß-Klee enthält das Blausäureglyklosid Linamarin, das bei oraler Aufnahme von Pflanzenteilen für kleine Tiere (z. B. Schnecken) besonders giftig ist, da sich hieraus Blausäure abspalten kann. Einer der bekanntesten Stoffe, die Blausäure abspalten und in Kernen einiger Steinobstfrüchte vorkommen, ist Amygdalin.
Blausäure als Neuromodulator und endogene Bildung von Blausäure im menschlichen Organismus
Blausäure wird auch endogen im menschlichen Organismus gebildet und hat offenbar die Rolle eines Neuromodulators.[13] Weiterhin wird Blausäure z. B. auch durch Gabe von Opioiden über die Aktivierung von µ-Opioidrezeptoren generiert.[14] Die endogene Bildung von Blausäure ist auch in der Forensik von Bedeutung.[15] So wird beim Aufbewahren von Leichen bei 4 °C nach etwa 2 Wochen durch Fäulnisprozesse und Autolyse Blausäure gebildet, wobei die Konzentration nach etwa 6 Wochen ihr Maximum erreicht und danach langsam geringfügig abfällt.
Herstellung
Industrielle Erzeugung
Für die Herstellung von Cyanwasserstoff sind folgende Verfahren von Bedeutung:
- Bei der Ammonoxidation von Methan (Andrussow-Verfahren) wird ein Gemisch aus Ammoniak und Methan bei rund 1200 °C an einem Platinnetz als Katalysator oxidiert. Die Reaktion ist stark exotherm.
- Bei der Ammondehydrierung von Methan (Degussa-BMA-Verfahren) werden Ammoniak und Methan mit Hilfe eines Platinkatalysators zu Blausäure und Wasserstoff umgesetzt. Die Reaktion verläuft endotherm.[16][17]
- Bei der Formamid-Spaltung in Cyanwasserstoff und Wasser werden Katalysatoren verwendet, die die erwünschte Reaktion beschleunigen, während die thermische Spaltung, die zu unerwünschten Produkten führt, verdrängt wird. Hierfür sind geheizte Metalloberflächen – aus Messing oder Eisen – geeignet, die mit einer Metalloxidschicht, etwa aus Zink-, Aluminium-, Magnesium-, Chrom- oder Zinnoxiden, überzogen sind, oder auch gesinterte Formkörper aus Aluminiumoxid und Siliciumdioxid oder solche aus Chrom-Nickel-Edelstahl.[18][19]
- Als Nebenprodukt bei der Herstellung von Acrylnitril durch Ammoxidation von Propylen (Sohio-Verfahren). Die Menge an anfallender Blausäure kann dabei durch Zugabe von Methanol erhöht werden.
- Fluhomic- oder Shawinigan-Verfahren, bei dem Kohlenwasserstoffe und Ammoniak in einem Lichtbogen umgesetzt werden. Dieses Verfahren ist nur von untergeordneter Bedeutung und wird dort ausgeübt, wo elektrischer Strom preiswert ist.
- Von historischer Bedeutung ist außerdem die Thermolyse von Kaliumhexacyanoferrat (III) (Erlenmeyer-Verfahren).
Im Labor
Werden im Labor geringe Mengen Cyanwasserstoff benötigt und steht keine entsprechende Gasdruckflasche zur Verfügung, so kann er leicht aus seinen Salzen durch Zugabe einer stärkeren Säure gewonnen werden:
oder
Auf Grund dieser leichten Freisetzung von Cyanwasserstoff ist beim Arbeiten mit seinen Salzen im Labor immer darauf zu achten, dass der pH-Wert der Lösung nicht sauer wird, da ansonsten eine (unbeabsichtigte) Freisetzung erfolgt.
Abfall- und Nebenprodukt
Blausäure wird bei fehlerhafter Handhabung von Prozessschritten in der Galvanik frei.
Beim Verbrennen stickstoffhaltiger Polymere (Kunststoffe) kann in erheblichem Umfang Blausäure entstehen.
Beim Rauchen von Tabak und bei der Verbrennung von Esbit werden geringe Mengen Blausäure freigesetzt.
Handhabung
Genetisch bedingte Wahrnehmungseinschränkung
Mehr als ein Viertel der Bevölkerung kann den Geruch von Blausäure nicht wahrnehmen, häufig wird die Wahrnehmung durch Lähmung der Geruchsnervenzellen verhindert.[20][21][22] Es müssen daher besondere Sicherheitsmaßnahmen beim Umgang mit Blausäure getroffen werden. Das Bayerische Landesamt für Gesundheit und Lebensmittelsicherheit berücksichtigt dies bei Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung.[23]
Lagerung
Wasserfreie Blausäure muss gekühlt gelagert werden, und Gefäße mit Blausäure dürfen nur in stark gekühltem Zustand vorsichtig geöffnet werden. Anderenfalls stehen diese wegen des niedrigen Siedepunkts unter starkem Druck, wobei beim unvorsichtigen Öffnen schlagartig erhebliche Mengen davon gasförmig entweichen und schlimmstenfalls flüssige Substanz verspritzen kann. Reinste, wasserfreie Blausäure ist einige Monate beständig. Allerdings darf sie nicht bedenkenlos gelagert werden, da Blausäure nach einer gewissen Zeit explosionsartig polymerisieren kann (Bildung der sogenannten Azulminsäure, ein brauner flockenartiger Feststoff). Die Polymerisierung kann durch Spuren von Alkalien (auch die Glasoberfläche ist hier von Bedeutung) oder Schwermetalloxiden – insbesondere in Kombination mit geringen Mengen Wasser – beschleunigt und durch Zusatz geringer Mengen Mineralsäuren oder Oxalsäure verzögert werden. Eine beginnende Gelb- oder später Braunfärbung ist ein Hinweis darauf, dass mit dieser spontanen Zersetzung bald zu rechnen ist.[24]
Wässrige Lösungen der Blausäure sind nur eine sehr begrenzte Zeit haltbar, da langsame Hydrolyse unter Bildung von Ameisensäure und Ammoniak eintritt:[10]
Transport
Um den Transport dieses Gefahrstoffes zu vermeiden, wird Blausäure in der Regel sofort am Herstellungsort weiterverarbeitet.
Verwendung
Gemäß EINECS, dem europäischen Verzeichnis der vor Inkrafttreten der REACH-Verordnung vorhandenen chemischen Stoffe, gehört Cyanwasserstoff zur Liste der Altstoffe und hat die Nummer 200-821-6. Das englische Synonym prussic acid ist ein Hinweis auf die historische Verwendung.
Hinrichtungen/Morde
- Die tödliche Wirkung der Blausäure wurde in den NS-Vernichtungslagern Majdanek, Mauthausen und Auschwitz-Birkenau benutzt, um Menschen in großer Zahl zu ermorden. Die Blausäurekonzentrationen waren je nach Entfernung zur Einwurfstelle unterschiedlich, lagen jedoch immer über 300 ppm. (Vergleiche Zyklon B, Gaskammer, Holocaust).
- Einige NS-Politiker sowie führende Angehörige der Wehrmacht entzogen sich gerichtlicher Aufarbeitung ihres Handelns durch Suizid mit einer Blausäurekapsel.
- Zur Vollstreckung der Todesstrafe in den Vereinigten Staaten wurde bis 1999 Blausäuregas in der Gaskammer eingesetzt; heute ist diese Hinrichtungsmethode dort nur noch zulässig, wenn die Giftspritze aus anderen Gründen nicht eingesetzt werden kann.
- Bei Attentaten mittels einer Blausäure-Sprühpistole wurden 1957 Lew Rebet und 1959 Stepan Bandera durch einen Agenten des KGB ermordet.
Als Biozid
Blausäure wird zur Bekämpfung von Ungeziefer eingesetzt. Hierzu wird ein Trägermaterial, z. B. Kieselgur, mit Blausäure getränkt, und es werden Riechstoffe zur Warnung hinzugefügt.
Kampfmittel
Als Giftgas wurde Blausäure erstmals durch die französische Armee am 1. Juli 1916 eingesetzt.[25] Aufgrund seiner hohen Flüchtigkeit blieb der Einsatz aber wirkungslos.[26] Nach anderen Angaben blieb die erhoffte Wirkung aus, weil der Plan den Deutschen durch Verrat bereits bekannt geworden war und der Gasmaskeneinsatz rechtzeitig verbessert werden konnte.[25] 1918 wurde Blausäure auch von den USA und Italien eingesetzt.
Industrielle Verwendung
Blausäure wird in vielen Prozessen in der Industrie und im Bergbau eingesetzt, beispielsweise für die Herstellung von Chlorcyan, Cyanurchlorid, Aminosäuren (besonders Methionin), Natriumcyanid und vieler weiterer Derivate sowie zum Auslaugen von Gold:
Die Gold-Lösung wird dann mit Zink reduziert. Der Cyanido-Komplex kann auch durch zugesetzte Kokosnussschalen-Aktivkohle absorptiv gebunden werden. Aus der so mit dem Cyanidokomplex beladenen Aktivkohle kann das Gold nach dem Verbrennen des organischen Anteils als „Asche“ gewonnen werden. In moderneren Anlagen wird der Cyanido-Komplex aus der abgetrennten beladenen Aktivkohle durch Eluieren mit heißer Natriumcyanid-Lösung in konzentrierter Form gewonnen (wegen der besseren Handhabung wird hierbei nicht flüssige Blausäure, sondern eine Natriumcyanid-Lösung eingesetzt). Dieses Verfahren führt, wie auch das alternativ nur noch sehr selten eingesetzte Quecksilber-Amalgamverfahren, zu den teilweise katastrophalen Gewässervergiftungen in den Goldfördergebieten der Dritten Welt.
Blausäure wird in großen Mengen zur Herstellung von Adiponitril und Acetoncyanhydrin, beides Zwischenprodukte der Kunststoffproduktion, verwendet. Bei der Adiponitrilherstellung wird Blausäure mittels eines Nickel-Katalysators an 1,3-Butadien addiert (Hydrocyanierung). Zur Acetoncyanhydrinherstellung wird Blausäure katalytisch an Aceton addiert. Aus Blausäure werden im industriellen Maßstab in mehrstufigen Verfahren auch die α-Aminosäure DL-Methionin (Verwendung in der Futtermittel-Supplementierung) und der Heterocyclus Cyanurchlorid hergestellt. Aus Cyanurchlorid werden Pflanzenschutzmittel und andere Derivate synthetisiert.
Weblinks
- Eintrag zu Zyankali-Intoxikation im Flexikon, einem Wiki der Firma DocCheck
- Concise International Chemical Assessment Document (CICAD) für Hydrogen Cyanide and Cyanides
- Cyanogenic Glycosides and Cyanide Toxicity, frot.co.nz
- Blausäure in Nahrungspflanzen – Eine Gefahr für Lebensmittel? Blausäure in Nahrungspflanzen – Eine Gefahr für Lebensmittel?, ifp.tu-bs.de
Einzelnachweise
- Eintrag zu Cyanwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- chem.wisc.edu: pKa Data, Compiled by R. Williams (PDF; 645 kB).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-286.
- Eintrag zu Hydrogen cyanide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-90-8 bzw. Cyanwasserstoff), abgerufen am 2. November 2015.
- Eintrag zu Hydrogen cyanide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021.
- Department of Health: Hydrogen Cyanide. Version 1.2 vom 4. Februar 2004.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Karlheinz Lohs: Synthetische Gifte. Vierte, überarbeitete und ergänzte Auflage. Militärverlag der Deutschen Demokratischen Republik, Leipzig 1974.
- Gerhart Jander, Hildegard Wendet: Lehrbuch der analytischen und präparativen anorganischen Chemie. 2. verbesserte Auflage. S. Hirzel Verlag, Leipzig 1954, S. 294 ff.
- Svirbely, W.J., Roth, J.F.: The Kinetics of Cyanohydrin Formation in Aqueous Solution. In: J. Am. Chem. Soc. Band 75, 1953, 3106, doi:10.1021/ja01109a020.
- Anders Lennartson: Isolation of Hydrocyanic Acid from Prussian Blue. In: The Chemical Works of Carl Wilhelm Scheele. Springer, 2017, S. 75–78.
- Rita Cipollone, Paolo Visca: Is there evidence that cyanide can act as a neuromodulator? In: IUBMB Life. Band 59, Nr. 3, 2007, S. 187–189, doi:10.1080/15216540600981768.
- J. L. Borowitz, P. G. Gunasekar, G. E. Isom: Hydrogen cyanide generation by mu-opiate receptor activation: possible neuromodulatory role of endogenous cyanide. In: Brain Research. Band 768, Nr. 1-2, 1997, S. 294–300, doi:10.1016/S0006-8993(97)00659-8, PMID 9369328.
- T. Grabowska, H. Sybirska: The role of endogenous Hydrogen cyanide in forensic medical appraisal and interpretation of fire victims. In: Problems of Forensic Sciences. Band 54, 2003, S. 82–92 (forensicscience.pl [PDF]).
- F. Endter: Die technische Synthese von Cyanwasserstoff aus Methan und Ammoniak ohne Zusatz von Sauerstoff, Chemieingenieurtechnik, Nr. 30, 1958, S. 305–310, doi:10.1002/cite.330300506.
- Wilhelm Keim, Arno Behr, Günter Schmitt: ''Grundlagen der Industriellen Chemie,'' 1. Auflage, Otto Salle Verlag GmbH &Co., Frankfurt am Main, Verlag Sauerländer AG, Aarau 1986, ISBN 3-7935-5490-2. (Salle), ISBN 3-7941-2553-3. (Sauerländer), S. 313–314.
- Patentanmeldung WO2004050587A2: Blausäure aus Formamid. Angemeldet am 3. Dezember 2003, veröffentlicht am 17. Juni 2004, Anmelder: BASF AG, Erfinder: Peter Bassler et al.
- Patent EP1791787B1: Verfahren zur Herstellung von Blausäure. Angemeldet am 2. September 2005, veröffentlicht am 3. März 2010, Anmelder: BASF SE, Erfinder: Andreas Deckers et al.
- Tödlicher Giftanschlag auf BASF Mitarbeiter, Chemie im Alltag, 2006.
- Schadstoff-Glossar: Cyanwasserstoff beim Umweltbundesamt Baden-Württemberg.
- Cyanide, inability to smell. In: Online Mendelian Inheritance in Man. (englisch)
- Bayerisches Landesamt für Gesundheit und Lebensmittelsicherheit: Eignungsuntersuchungen von Befähigungsscheinbewerbern für Begasungen bzw. Schädlingsbekämpfung (Memento vom 4. März 2016 im Internet Archive).
- Th. Völker: Polymere Blausäure. In: Angewandte Chemie. Band 72, 1960, S. 379–384, doi:10.1002/ange.19600721104.
- Otto Jekel: Giftwolken. Giftgase im Weltkrieg und heute. In: Neues Wiener Tagblatt (Wochen-Ausgabe), 15. Juni 1935, S. 11 (online bei ANNO).
- Markus Schnedlitz: Chemische Kampfstoffe: Geschichte, Eigenschaften, Wirkung. GRIN Verlag, 2008, ISBN 3-640-23360-3, S. 13 (eingeschränkte Vorschau in der Google-Buchsuche).



