Dimethylformamid
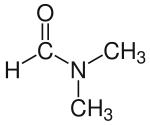
Dimethylformamid (DMF), genauer N,N-Dimethylformamid, ist ein Amid der Ameisensäure. DMF wird als polares, aprotisches, organisches Lösungsmittel eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Dimethylformamid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H7NO | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit schwach aminartigem Geruch[1][2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 73,10 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
0,95 g·cm−3 (20 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
153 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser und vielen organischen Lösungsmitteln[2] | |||||||||||||||||||||
| Dipolmoment | ||||||||||||||||||||||
| Brechungsindex |
1,4305 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[6] | |||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−239,3 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Die Verwendung als Lösungsmittel für Polyacrylnitril, das dessen Verwendung als Kunstfaser ermöglichte (Orlon, Dralon u. a.), wurde 1941 von Herbert Rein bei IG Farben und 1944 unabhängig bei DuPont in den USA entdeckt.
Herstellung
Die großtechnische Herstellung von DMF erfolgt auf zwei verschiedenen Wegen, nach einem einstufigen und einem zweistufigen Prozess. Bei der einstufigen Synthese wird Dimethylamin mit Kohlenmonoxid bei erhöhter Temperatur und erhöhtem Druck direkt zu DMF umgesetzt. Die Reaktion wird in der Flüssigphase mit Hilfe eines Katalysators (Natriumethanolat) durchgeführt:
Bei der zweistufigen Synthese wird die Umsetzung von Dimethylamin mit Ameisensäuremethylester durchgeführt, es entsteht Methanol als Kuppelprodukt:
Beide Synthesen verlaufen mit hohen Ausbeuten ohne die Bildung nennenswerter Nebenprodukte. Die Produktaufarbeitung erfolgt in beiden Fällen durch mehrstufige Destillation.
Eigenschaften
Physikalische Eigenschaften
DMF ist eine farblose bis gelbliche, schwerflüchtige Flüssigkeit, die sich mit Wasser und vielen organischen Lösungsmitteln mischt.[2] Bei Normaldruck siedet die Verbindung bei 153 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,93068, B = 1337,716 und C = −82,648 im Temperaturbereich von 303 K bis 363 K.[9] Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid | −239,4 kJ·mol−1[10] | als Flüssigkeit |
| Verbrennungsenthalpie | ΔcH0liquid | −1941,6 kJ·mol−1[10] | als Flüssigkeit |
| Wärmekapazität | cp | 148,16 J·mol−1·K−1 (25 °C)[11] 2,03 J·g−1·K−1 (25 °C) |
als Flüssigkeit |
| Kritische Temperatur | Tc | 649,6 K[12] | |
| Kritische Dichte | ρc | 3,82 mol·l−1[12] | |
| Verdampfungsenthalpie | ΔVH0 ΔVH |
46,7 kJ·mol−1[13] 39,409 kJ·mol−1[14] |
am Siedepunkt |
| Schmelzenthalpie | ΔFH | 8,95 kJ·mol−1[15] |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der vereinfachten Watsongleichung ΔVH=A·(1−Tr)n (ΔVH in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 59,3545 kJ/mol, n = 0,381 und Tc = 647,0 K im Temperaturbereich zwischen 213 K und 647 K beschreiben.[14]
Die Verbindung bildet azeotrop siedende Gemische mit n-Heptan bei 97 °C bei einem Gehalt von 5 Ma% bzw. mit Ethylbenzol bei 134 °C mit einem Gehalt von 15 Ma%. Keine Azeotrope werden mit Wasser, Methanol, Ethanol, Benzol, Toluol, und Acetonitril gebildet.[16]
Chemische Eigenschaften
Das Amid zersetzt sich unter Licht und Hitzeeinwirkung zu Dimethylamin und Kohlenstoffmonoxid.[17] Lösungen in Wasser sind hydrolysebeständig. Zusätze von Säuren oder Basen katalysieren den Zerfall in Ameisensäure und Dimethylamin.[2] Als Lösungsmittel ist die Verbindung gegenüber einer Reihe von Stoffen nicht inert. Mit Stoffen wie Natriumhydrid, Natriumtetrahydroborat, Lithiumazid, Natrium, Thionylchlorid und Triethylaluminium treten heftige Reaktionen ein. Es reagiert auch mit halogenierten Kohlenwasserstoffen, wie Tetrachlorkohlenstoff.[18]
Sicherheitstechnische Kenngrößen
Dimethylformamid bildet entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 58 °C.[1][19] Der Explosionsbereich liegt zwischen 2,2 Vol.‑% (70 g/m³) als untere Explosionsgrenze (UEG) und 16 Vol.‑% (500 g/m³) als obere Explosionsgrenze (OEG).[1][19] Hier ergibt sich ein oberer Explosionspunkt von 51 °C.[1] Der maximale Explosionsdruck beträgt 7,2 bar.[1][19] Die Grenzspaltweite wurde mit 1,02 mm bestimmt.[1][19] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[19] Die Zündtemperatur beträgt 440 °C.[1][19] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
- DMF dient als Lösungsmittel für eine Vielzahl fester, flüssiger oder gasförmiger Stoffe, für Polymere, wie beispielsweise Polyacrylnitril, PVC, Polyamide, Polyurethane, Epoxidharze, sowie für Cellulose und deren Derivate.
- DMF dient als Katalysator bei der Herstellung von Säurechloriden aus Carbonsäuren und Oxalylchlorid.
- DMF wird im Labor, da polar aprotisch, bei Reaktionen mit polaren Übergangszuständen gerne als Lösemittel verwendet. Bei nukleophilen Substitutionen können gegenüber z. B. Methanol drastische Geschwindigkeitserhöhungen verzeichnet werden.
- DMF dient in der chemischen Technik als Extraktionsmittel zur Abtrennung von Benzol, Ethin, 1,3-Butadien.
- DMF ist ein Zusatzstoff zu Kerosin, es dient als Katalysator für dessen Verbrennung
- DMF ist ein Zwischenprodukt in der Synthese von Acetalen, Aldehyden, Carbonsäureestern und Nitrilen
- Aus DMF und Phosphoroxychlorid lässt sich das Vilsmeier-Haack-Reagenz herstellen, das zur Formylierung von Aromaten und zur Chlorierung von Carbonsäuren dient.
- DMF wird als Reagenz zur Synthese von Aldehyden mittels Bouveault-Aldehyd-Synthese verwendet.
- DMF-d7 wird als Lösungsmittel in der NMR-Spektroskopie verwendet.
Sicherheitshinweise
Sowohl nach akuter, als auch nach chronischer Einwirkung, kann es zu einer Leberzellschädigung kommen. Histologisch zeigen sich dann mikrovesikuläre Fetteinlagerungen (Fettleber) und Veränderungen des Lebergewebes ohne ausgeprägte Entzündungen.
DMF ist in Anlage 6 zu Nummer 30 des Anhangs XVII der REACH-Verordnung (EG) Nr. 1907/2006 als fortpflanzungsgefährdend der Kategorie 2 gelistet.
Einzelnachweise
- Eintrag zu N,N-Dimethylformamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Dimethylformamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. August 2012.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-55.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-198.
- Eintrag zu N,N-dimethylformamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 68-12-2 bzw. Dimethylformamid (DMF)), abgerufen am 26. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- Gopal, R.; Rizvi, S.A.: Vapour Pressures of Some Mono- and Di-Alkyl Substituted Aliphatic Amides at Different Temperatures in J. Indian Chem. Soc. 45 (1968) 13–16.
- Vasil'eva, T.F.; Zhil'tsova, E.N.; Vvedenskii, A.A.: Enthalpies of combustion of NN-dimethylformamide and NN-dimethylacetamide in Russ. J. Phys. Chem. (Engl. Transl.) 46 (1972) 315.
- Kolker, A.M.; Kulikov, M.V.; Krestov, Al.G.: Volumes and heat capacities of binary non-aqueous mixtures. Part 2. The systems acetonitrile-N,N-dimethylformamide and acetonitrile-hexamethylphosphoric triamide in Thermochim. Acta 211 (1992) 73–84.
- Teja, A.S.; Anselme, M.J.: The critical properties of thermally stable and unstable fluids. I. 1985 results in AIChE Symp. Ser., 1990, 86, 279, 115–121.
- Panneerselvam, K.; Antony, M.P.; Srinivasan, T.G.; Vasudeva Rao, P.R.: Enthalpies of vaporization of N,N-dialkyl monamides at 298.15 K in Thermochimica Acta 495 (2009) 1–4, doi:10.1016/j.tca.2009.05.007.
- Carl L. Yaws, Marco A. Satyro: Thermophysical Properties of Chemicals and Hydrocarbons – Chapter 7: Enthalpy of Vaporation, Organic Compounds, 1st Edition Elsevier 2008, ISBN 978-0-8155-1596-8, S. 316, doi:10.1016/B978-081551596-8.50012-2.
- Smirnova, N.N.; Tsvetkova, L.Ya.; Bykova, T.A.; Marcus, Yizhak: Thermodynamic properties of N,N-dimethylformamide and N,N-dimethylacetamide in J. Chem. Thermodyn. 39 (2007) 1508–1513, doi:10.1016/j.jct.2007.02.009.
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 245–247.
- Daniel L. Comins, Sajan P. Joseph: Encyclopedia of Reagents for Organic Synthesis (en). John Wiley & Sons, Ltd, 1. Januar 2001, ISBN 978-0-470-84289-8, doi:10.1002/047084289x.rd335.
- P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 6. Edition, Vol. 1, Butterworth/Heinemann 1999, ISBN 0-7506-3605-X, S. 131, 441.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.


